神经肽P物质对高氧暴露下肺泡Ⅱ型上皮细胞的影响及其对信号分子Gli1的调控*
杨 林,党红星,刘 聪,方 芳,许 峰
(儿童发育疾病研究省部共建教育部重点实验室,儿科学重庆市重点实验室,重庆市“儿童发育重大疾病诊治与预防”国际科技合作基地,重庆医科大学附属儿童医院PICU,重庆 400014)
氧疗是临床上治疗呼吸系统疾病的常用方法,但长时间吸入高浓度氧,可产生大量的氧自由基,从而引起炎症、细胞损伤、坏死和凋亡,可导致各种急性或慢性肺损伤[1-2]。肺泡上皮细胞是高氧所致肺损伤的主要靶点,其损伤后的修复主要依赖于肺泡Ⅱ型上皮细胞(AECⅡ)的增殖、分化为肺泡Ⅰ型上皮细胞(AECⅠ)。AECⅡ细胞的功能状态是决定肺损伤病理转归的主要因素[3]。
神经肽P物质(SP)广泛分布于气道上皮细胞层内,可启动早期的神经源性炎症反应,参与对损伤细胞的修复、增殖、迁移、分化调控[4-5]。本课题组前期研究发现SP能够降低高氧诱导的氧化损伤,但调节的分子机制尚不完全清楚[6]。SHH信号通路是一种重要的信号转导通路,在细胞损伤修复中有着重要的作用,其成员包括SHH、Patched1(Ptch1)、Smoothened(Smo)以及Gli,而Gli1是SHH信号通路最主要的效应分子[7-8]。研究发现SHH信号通路在肺的形态发生和器官形成中起着至关重要的作用[9-10],并参与了胚胎形成、组织修复、创伤愈合[11-13]。
SP能否降低高氧暴露对肺泡Ⅱ型上皮细胞的损伤,促进损伤后的修复,且是否与调控SHH信号通路有关,目前,相关研究甚少。本文探讨了高氧暴露及SP干预对AECⅡ细胞存活、凋亡及对SHH信号通路分子Gli1的影响,为高氧肺损伤预防和治疗提供理论指导和实验依据。
1 材料与方法
1.1实验动物 清洁级雌、雄性SD大鼠,体质量180~200 g,由重庆医科大学实验动物中心提供,所有实验遵守国家关怀和使用实验动物的指导方针,本实验通过了重庆市伦理委员会审查。
1.2材料 SP(Abcam公司),DMEM/F12培养基、胎牛血清(Hyclone公司),胰蛋白酶(BBI公司),AnnexinV-FITC凋亡检测试剂盒(南京凯基生物),流式细胞仪(美国BD公司),Gli1多克隆抗体(Abbiotec公司),BCA蛋白定量检测试剂盒(北京百泰克公司),荧光定量PCR仪FTC2000(加拿大),RT试剂、荧光定量PCR试剂、sybr green Ⅰ(Shine Gene公司)。
1.3早产鼠AECⅡ的分离及培养 健康成年SD大鼠,雌雄按1∶1合笼交配,次日晨查见阴栓记为妊娠第1天,将孕鼠于孕第19天(足月为22 d)时行剖宫产取出早产鼠,分别用0.25%胰酶、0.3%胶原酶消化,采用差速离心和差速贴壁方法分离AECⅡ。AECⅡ纯化后24 h接近增殖状态,活性良好,用于实验。每天更换培养液并在相差显微镜下观察其形态和基本生长情况,巴氏染色法、透射电镜下观察培养细胞中是否存在板层小体,巴氏染色法检测细胞纯度,台盼蓝染色检测细胞存活率,细胞纯度达95%,存活率达90%。
1.4氧化损伤性细胞模型制备及实验分组 原代培养早产鼠AECⅡ,AECⅡ贴壁纯化后随机分组的办法将细胞分为空气组、高氧组、高氧+SP组。空气组和高氧组分别将AECⅡ置于氧体积分数为0.21(21%)和0.95(95%)的密闭氧仓中,高氧SP组于暴露前加入SP 1×10-8mol/L,再置于氧体积分数为0.95(95%)密闭氧仓暴露,各组细胞密闭氧仓均置于5% CO2培养箱,培养24 h后收集细胞检测。
1.5光镜和电镜下观察细胞形态 原代培养的AECⅡ细胞,分组培养24 h后收集细胞,通过透射电镜观察细胞形态。
1.6MTT细胞存活检测 AECⅡ细胞存活率通过3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四唑(MTT)试剂盒检测,按说明书进行。
1.7AnnexinV/PI 双标记法检测 AECⅡ凋亡 原代培养的AECⅡ细胞,以1×106个/mL浓度接种于6孔板中,按上述分组处理24 h,胰酶消化贴壁细胞,PBS重悬3次,调整细胞浓度约1×106个/mL,加入5 μL AnnexinV-FITC和10 μL PI,20~25 ℃避光孵育15 min,上流式细胞仪,计算出右下象限的早期凋亡细胞所占比率。
1.8荧光定量PCR检测Gli1的mRNA的含量 采用TRizol一步法提取AECⅡ的总RNA,测吸光度A260/A280值,计算提取的RNA浓度。逆转录合成cDNA,PCR引物由Primer premier 5.0自行设计。扩增Gli1基因正义链的引物序列:5′-TGT GGC AAC AGG ACG GAA C-3′,反义链序列为:5′-CCA GAG TGT CAG CAG AAG AAA AG-3′;GAPDH正义链的引物序列:5′-CCC ATC TAT GAG GGT TAC GC-3′,反义链序列为:5′-TTT AAT GTC ACG CAC GAT TTC-3′。荧光定量PCR扩增条件:94 ℃ 4 min,94 ℃ 20 s、60 ℃ 30 s、70 ℃ 30 s,共35个循环,72 ℃检测信号。记录deta Ct值,通过2-△△CT计算荧光值,并以GAPDH为标准计算相对比值。
1.9Western blot检测Gli1的蛋白含量 RIPA裂解液提取细胞总蛋白,BCA法定量蛋白。取30 μg蛋白质上样,10%SDS-聚丙烯酰胺凝胶电泳分离,电转移至PVDF膜,经5%脱脂奶粉封闭后,与Gli1多克隆抗体适度稀释,4 ℃振摇孵育过夜,再加入稀释后辣根过氧化物酶标记的二抗,用ECL法检测,蛋白条带用Quantity One 4.5.0软件进行处理分析,蛋白含量用目的条带校正容积(Adj volume)/GAPDH校正容积(Adj volume)表示。
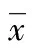
2 结 果
2.1高氧暴露及SP干预后AECⅡ形态学的变化 空气组:AECⅡ细胞胞浆丰富,含有大小不一的板层小体,胞膜上有微绒毛结构(封3图1A)。与空气组比较,高氧暴露24 h,AECⅡ细胞核较空气组伸展,细胞器减少,线粒体肿胀,板层小体结构变化甚至消失,胞质边缘有较多吞饮小泡,可见较多早期凋亡的改变(封3图1B)。SP干预后,与高氧组比较,细胞器变化减轻,细胞形态基本正常(封3图1C)。
2.2高氧暴露及SP干预对AECⅡ存活率和凋亡率的影响 与空气组比较,高氧组AECⅡ在高氧暴露24 h后细胞存活率明显降低,凋亡率明显升高(P<0.05)。而在高氧+SP组,SP干预后与单纯高氧组比较,AECⅡ存活率明显增加,凋亡率降低(P<0.05),见图2、3。

*:P<0.05,与空气组比较;#:P<0.05,与高氧组比较。
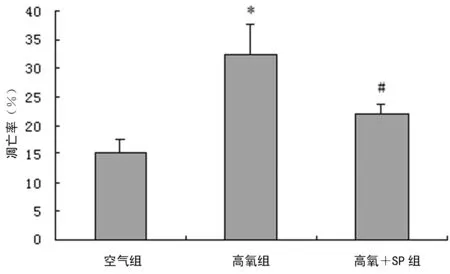
*:P<0.05,与空气组比较;#:P<0.05,与高氧组比较。
2.3高氧及SP干预后Gli1 mRNA表达的影响 空气组AECⅡ,通过荧光定量PCR法可检测到Gli1 mRNA表达。与空气组比较,高氧暴露24 h后,AECⅡ内Gli1 mRNA表达升高(P<0.05)。SP干预后,进一步促进高氧组AECⅡ内Gli1 mRNA表达,高氧+SP组Gli1 mRNA水平较单纯高氧组升高(P<0.05),见图4。
2.4高氧及SP干预对Gli1蛋白表达的影响 空气组AECⅡ,通过Western blot可检测到Gli1蛋白表达。与空气组比较,高氧暴露后,Gli1蛋白表达升高(P<0.05)。SP干预后,进一步促进高氧组AECⅡ内Gli1蛋白表达,高氧+SP组Gli1蛋白表达水平较单纯高氧组明显升高(P<0.05),见图5。
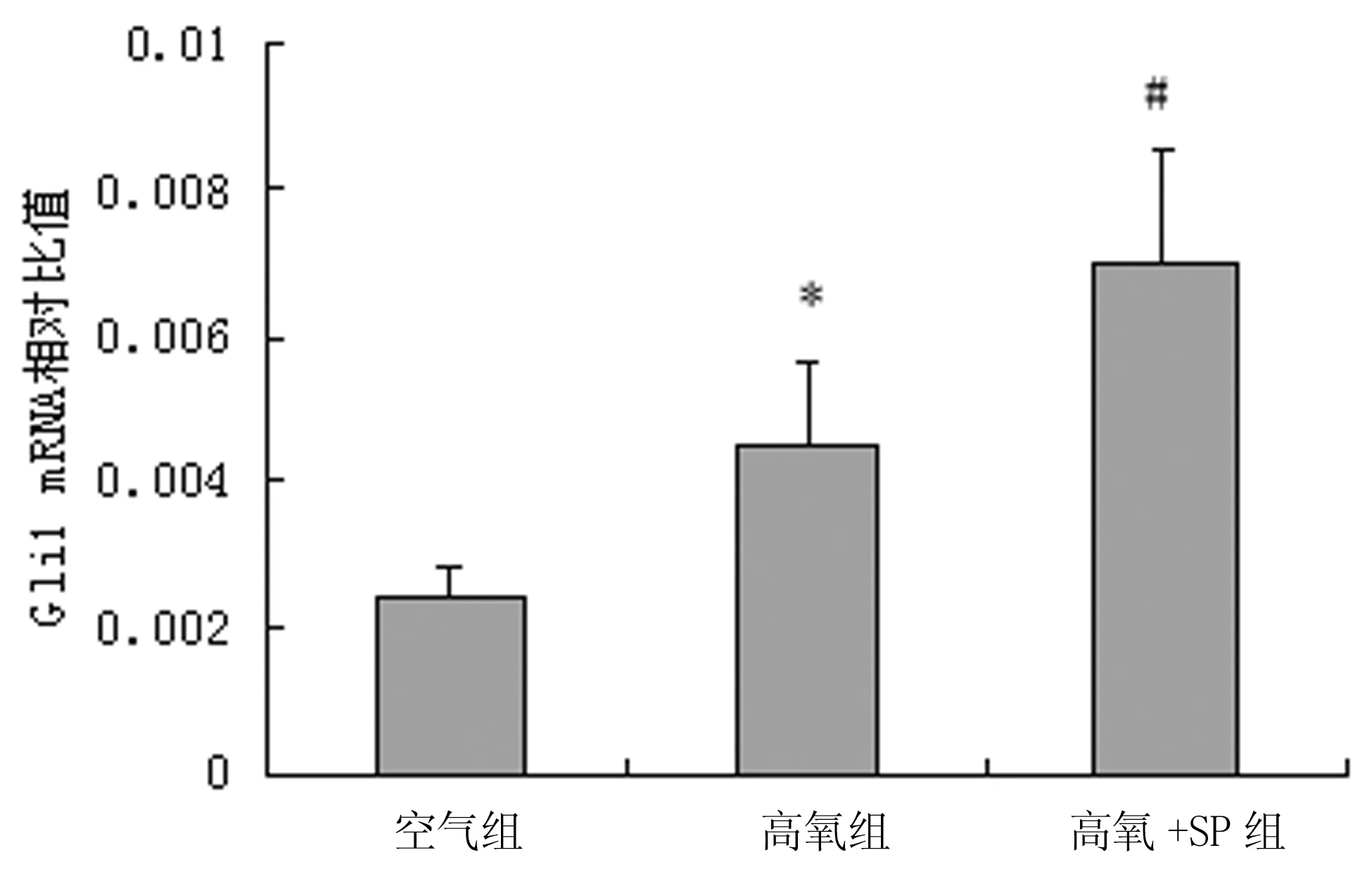
*:P<0.05,与空气组比较;#:P<0.05,与高氧组比较。
*:P<0.05,与空气组比较;#:P<0.05,与高氧组比较。
3 讨 论
慢性肺疾病(CLD)或支气管肺发育不良(BPD)是新生儿持续用氧治疗后的一种肺氧化性损伤疾病,在存活的早产儿中可达60%以上,发生CLD或BPD的早产儿均伴有肺发育障碍和呼吸功能低下。目前,国际上尚无确定有效的防治方法,但大量临床资料显示其病因与肺的发育成熟及肺损伤修复密切相关[14]。
AECⅡ是肺泡表面一类重要的细胞群体,在肺泡上皮损伤时可不断增殖,补充和分化为AECⅠ,被称为肺泡上皮“干细胞”[15]。由于肺损伤的修复完全依赖AECⅡ的增殖和分化,因此寻找保护AECⅡ氧化损伤的因素,可为高氧肺损伤的防治提供理论基础。
SP是一种重要的感觉神经肽,SP释放后可以特异性地与神经激肽1受体(NK1R)结合,具有多种生物学效应,可调节气道血流,气道平滑肌收舒反应,气道炎症和上皮细胞损伤后的迁移和增殖[16-17]。急性烧伤患者,SP在增生的疤痕组织中的浓度明显高于烧伤皮肤,其可能启动愈合早期的神经源性炎症反应,与细胞增殖、再生和瘢痕形成等密切相关[4]。Oslund等[18]报道通过活化NK1R有助于肺损伤后上皮细胞增殖,是参与损伤修复的重要组件。Yaraee等[19]发现SP能够直接调节人支气管上皮细胞释放TGF-β,参与调节肺损伤修复以及肺纤维化过程。Marwan等[20-21]发现感觉神经递质通过激活NK1R能够保护急性高氧肺损伤。Huang等[6]发现SP对高氧肺损伤有明显的保护作用,可降低细胞凋亡,促进细胞存活。
本研究发现早产鼠AECⅡ高氧暴露24 h,电镜下可见明显的细胞损伤和凋亡,流式细胞仪检测细胞的凋亡率明显升高,细胞存活明显降低。SP干预后从细胞的超微结构可见损伤明显减轻,细胞凋亡率明显降低,细胞存活率升高。提示SP可以减轻AECⅡ的氧化损伤,维持细胞的正常生理功能,对氧化应激状态下的AECⅡ细胞可能起到保护作用。
在大量发育和肿瘤形成的研究成果中发现,SHH信号通路对细胞增生起调节作用,提示该信号途径也可能参与组织损伤修复和再生过程。Kusano等[11]报道体外心肌细胞给予SHH蛋白能够保护过氧化氢诱导的细胞凋亡。Lavine报道阻断正常成年小鼠在体心肌细胞中的SHH信号传导通路可以导致室腔增大,心肌纤维化,心功能降低甚至死亡。此外,文献报道SHH信号在骨折、胆道、肝脏损伤的修复中发挥作用[22-24]。然而,这一信号途径在呼吸系统,特别是对肺修复再生及AECⅡ细胞损伤修复中的作用还不十分明确。Bellusci等[25]报道SHH信号通路在肺的支气管形态发育中具有重要作用,转基因老鼠过表达SHH可促进间叶细胞和上皮细胞的增殖。SHH信号通路中的核转录因子Gli1有3种,即Gli1、Gli2、Gli3,Gli1是SHH信号途径最重要的下游转录因子之一,也是SHH信号最终的响应者和功能的执行者[26]。Grindley等[27]发现在肺组织SHH基因过表达时,Gli1 mRNA明显上调,参与肺发育的调控。因而,Gli1的表达反映了SHH信号通路的功能状态。
本研究显示,SHH信号通路参与了高氧诱导细胞凋亡的信号转导系统,高氧暴露后Gli1信号分子表达明显增加,可能参与高氧损伤后早期的防御作用。SP干预后,进一步激活高氧组AECⅡ内Gli1信号分子基因和蛋白表达,同时,AECⅡ凋亡率降低,存活率增加,显示对高氧暴露下AECⅡ起到一定的保护作用。提示SP可抑制细胞的凋亡,促进细胞存活,其可能通过对SHH信号途径激活而对氧化应激状态下的AECⅡ起到保护作用。
[1]Mantell LL,Horowitz S,Davis JM,et al.Hyperoxia-induced cell death in the lung--the correlation of apoptosis,necrosis,and inflammation[J].Ann N Y Acad Sci,1999,887:171-180.
[2]Gordo-Vidal F,Calvo-Herranz E,Abella-Alvarez A,et al.Hyperoxia-induced pulmonary toxicity[J].Med Intensiva,2010,34(2):134-138.
[3]Miyake Y,Kaise H,Kyo-Ichi I,et al.Protective role of macrophages in noninflammatory lung injury caused by selective ablation of alveolar epithelial type Ⅱ cells[J].J Immunol,2007,178(8):5001-5009.
[4]Scott JR,Muangman PR,Richard TN,et al.Substance P levels and neutral endopeptidase activity in acute burn wounds and hypertrophic scar[J].Plast Reconstr Surg,2005,115(4):1095-1102.
[5]Scott JR,Muangman P,Gibran NS,et al.Making sense of hypertrophic scar:a role for nerves[J].Wound Repair Regen,2007,15(Suppl 1):S27-31.
[6]Huang B,Fu HM,Yang M,et al.Neuropeptide substance P attenuates hyperoxia-induced oxidative stress injury in type II alveolar epithelial cells via suppressing the activation of JNK pathway[J].Lung,2009,187(6):421-426.
[7]Jacob L,Lum L.Deconstructing the hedgehog pathway in development and disease[J].Science,2007,318(5847):66-68.
[8]Wang G,Zhang ZY,Xu Z,et al.Activation of the sonic hedgehog signaling controls human pulmonary arterial smooth muscle cell proliferation in response to hypoxia[J].Biochim Biophys Acta,2010,1803(12):1359-1367.
[9]Pepicelli CV,Lewis PM,McMahon AP,et al.Sonic hedgehog regulates branching morphogenesis in the mammalian lung[J].Curr Biol,1998,8(19):1083-1086.
[10]Gomi T,Kimura A,Adriaensen D,et al.Stages in the development of the rat lung:morphometric,light and electron microscopic studies[J].Kaibogaku Zasshi,1994,69(4):392-405.
[11]Kusano KF,Pola R,Murayama T,et al.Sonic hedgehog myocardial gene therapy:tissue repair through transient reconstitution of embryonic signaling[J].Nat Med,2005,11(11):1197-1204.
[12]Fu M,Lui VC,Sham MH,et al.Sonic hedgehog regulates the proliferation,differentiation,and migration of enteric neural crest cells in gut[J].J Cell Biol,2004,166(5):673-684.
[13]Daya-Grosjean L,Couve-Privat S.Sonic hedgehog signaling in basal cell carcinomas[J].Cancer Lett,2005,225(2):181-192.
[14]Dieperink HI,Blackwell TS,Prince LS,et al.Hyperoxia and apoptosis in developing mouse lung mesenchyme[J].Pediatr Res,2006,59(2):185-190.
[15]Sugahara K,Tokumine J,Teruya K,et al.Alveolar epithelial cells:differentiation and lung injury[J].Respirology,2006,11(Suppl 1):S28-31.
[16]Bai TR,Zhou D,Weir T,et al.Substance P (NK1)- and neurokinin A (NK2)-receptor gene expression in inflammatory airway diseases[J].Am J Physiol,1995,269(3 Pt 1):L309-317.
[17]Hafstrom I,Ringertz B,Lundeberg T,et al.The effect of endothelin,neuropeptide Y,calcitonin gene-related peptide and substance P on neutrophil functions[J].Acta Physiol Scand,1993,148(3):341-346.
[18]Oslund KL,Hyde DM,Putney LF,et al.Activation of neurokinin-1 receptors during ozone inhalation contributes to epithelial injury and repair[J].Am J Respir Cell Mol Biol,2008,39(3):279-288.
[19]Yaraee R,Ghazanfari T,Substance P.Potentiates TGFbeta-1 production in lung epithelial cell lines[J].Iran J Allergy Asthma Immunol,2009,8(1):19-24.
[20]Marwan D,Zsengeller Z,Mitsialis A,et al.A paradoxical protective role for the proinflammatory peptide substance P receptor (NK1R) in acute hyperoxic lung injury[J].Am J Physiol Lung Cell Mol Physiol,2009,297(4):L687-697.
[21]Miyaji T,Nakase T,Iwasaki M,et al.Expression and distribution of transcripts for sonic hedgehog in the early phase of fracture repair[J].Histochem Cell Biol,2003,119(3):233-237.
[22]Omenetti A,Yang L,Li YX,et al.Hedgehog-mediated mesenchymal-epithelial interactions modulate hepatic response to bile duct ligation[J].Lab Invest,2007,87(5):499-514.
[23]Sicklick JK,Li YX,Melhem A,et al.Hedgehog signaling maintains resident hepatic progenitors throughout life[J].Am J Physiol Gastrointest Liver Physiol,2006,290(5):G859-870.
[24]Watkins DN,Berman DM,Burkholder SG,et al.Hedgehog signalling within airway epithelial progenitors and in small-cell lung cancer[J].Nature,2003,422(6929):313-317.
[25]Bellusci S,Furuta Y,Rush MG,et al.Involvement of sonic hedgehog (Shh) in mouse embryonic lung growth and morphogenesis[J].Development,1997,124(1):53-63.
[26]Bai CB,AL Joyner.Gli1 can rescue the in vivo function of Gli2[J].Development,2001,128(24):5161-5172.
[27]Grindley JC,Bellusci S,Perkins D,et al.Evidence for the involvement of the Gli gene family in embryonic mouse lung development[J].Dev Biol,1997,188(2):337-348.

