碳纤维纳米电极用于微流控芯片安培测定单个PC12细胞中神经递质多巴胺
程 寒,袁 琳,明 月,杨天鸣,程介克
(1 中南民族大学 药学院,武汉 430074;2 武汉大学 化学与分子科学学院,武汉 430072)
细胞是生物体的形态结构和生命活动的基本单位,其体积很小,样品量很少. 细胞群体分析所获得的统计平均结果,掩盖了单个细胞之间的差异,使生物学及医学等很多领域的发展受到限制.
微流控芯片已用于各种细胞分析的研究,如细胞输送[1]、进样[2,3]、培养[4]、分类[4]、分离[5,6]和溶胞[7].电化学检测具有灵敏度高、选择性好,易于微型化和集成化等优点,已成为微流控芯片电泳中最具有发展前途的检测方法之一. 芯片上集成电化学检测器的挑战主要在于电极与分离通道出口的准确定位.现有的设计大多是利用光刻蚀法或化学沉积法将工作电极置于通道出口处[8-10],电极损坏后,芯片也随之报废.本研究以碳纤维纳米电极为工作电极,自行组装了微流控芯片安培柱末检测系统,设计了一种微流控芯片电泳单细胞进样和溶膜的控制方式,仅需一路高压控制即可实现单细胞进样和溶膜操作.该系统具有良好的重现性,更换电极后可重复使用.鼠嗜铬神经瘤细胞(PC12)中含有儿茶酚胺类物质多巴胺[11-13],适于电化学方法进行检测. 笔者以PC12细胞为研究对象,实现了单个细胞在自组装微流控芯片电化学检测系统上的进样、溶膜和检测,分析了单个细胞中的多巴胺含量.
1 材料和方法
1.1 仪器
电化学工作站(CHI660,上海辰华仪器公司);高压电源(XCDY,山东师范大学化学化工与材料科学学院);倒置显微镜(XDP-1, 上海光学仪器厂).
1.2 试剂
PC12细胞购自中国典型物保藏中心,多巴胺(DA)、肾上腺素(NE)、去甲肾上腺素(E)以及儿茶酚(CA)为Sigma公司产品,十二烷基硫酸钠(SDS)为国产化学纯,其他试剂均国产分析纯.细胞培养及电泳实验中所有溶液均用超纯水配置,待测物用0.1 mol/L的HClO4配置成1.0×10-2mol/L的母液,置于4℃的冰箱冷藏室中保存,使用时用相应的缓冲溶液稀释到所需浓度.
1.3 自组装集成电化学检测器
自组装置见图1.毛细管电泳芯片(AMC-μchip-T180, Alberta Microelectronic Corporation,Canada). 进样通道为双T布局,通道宽50 μm,高20 μm,截面近似半圆,分离通道长76 mm,双T进样通道长250 μm.样品池S、缓冲液池B和废液池SW距离双T交叉通道均为5 mm.在毛细管电泳芯片原废液池处截断,将芯片粘在一块载波片上,另外一块凹形的3 mm厚的有机玻璃片与载波片和芯片粘连,形成电化学检测池. 纳米碳纤维电极的制作方法见文献[14],电极尖端的直径控制约为100 nm. 将纳米碳纤维电极夹在微操纵手上,在显微镜下用五维操纵器将工作电极的尖端对准分离通道轴心,距离分离通道出口约30 μm,用粘胶将工作电极粘在检测池上,待粘胶固化后即可移走微操纵手,从而将工作电极集成到芯片上.将Ag/AgCl参比电极靠近检测点,粘在检测池上.将离心管切去一段,对准芯片上另外3个小槽粘好,作为储液池.如需更换工作电极,用刀片切除工作电极上的粘胶,取下电极,用同样的方法另外粘上一根工作电极并固定即可.芯片可以长期反复使用.用此法集成的电化学检测器重现性优良.

S为样品池, B为缓冲液池, SW为样品废液池,DC为检测池, RE为参比电极, WE为工作电极
1.4 PC12细胞悬液制取
PC12细胞从培养瓶中消化取出置于10 mL离心管中,于800 r/min转速离心6 min,弃去培养液,用生理盐溶液清洗5次并用血球记数板计数,收集细胞,将细胞中加入适量的PBS,并用移液枪对细胞液进行吹打,形成均匀的细胞悬液,并控制细胞悬液的密度约5×104cells/mL.
2 结果与分析
2.1 重现性实验
通过测量DA在微流控芯片上所得结果,分析电泳的重现性. 电泳条件:20 mmol/L Tris-HCl(pH 8.0)作为电泳缓冲溶液,样品池中加入1.0×10-4mol/L DA,其它液池中为电泳缓冲液,进样电压500 V, 进样时间20 s,分离电压1000 V,工作电极电位0.6 V(vs Ag/AgCl).图2为0.1 mmol/L DA标准溶液连续10次进样的电泳图谱. 图2中实线箭头所指即为DA的电泳峰,2个虚线箭头所指为电泳的进样电压与分离电压切换时工作电极上出现的电流峰(峰宽约1 s), 其余部分电压切换时的电流峰以及DA电流峰未逐一标示.

t/s
表1为0.1 mmol/L DA 连续10次进样分离的峰高及迁移时间,计算得出峰高相对标准偏差为1.40 %, 迁移时间的相对标准偏差为1.52%,通过实验计算出同一根电极检测0.1 mmol/L DA 连续40次进样峰高与迁移时间的相对标准偏差分别为1.27 %和1.31 %.

表1 连续10次进样分离结果的重复性比较
由上分析可知,工作电极固定在芯片通道的出口处,电泳实验结果表现出良好的重复性.该设计方便了实验操作,在固定的工作电极钝化或毁坏之前,微流控芯片可持续使用而不必调整电极位置,且芯片电泳实验勿需在显微镜平台上进行;该设计可方便快速更换电极.较未将工作电极组装在微流控芯片上的系统相比,本装置能显著节省实验时间,从而提高实验效率.
2.2 儿茶酚及儿茶酚胺类物质的分离
笔者在自组装测试系统上进行了儿茶酚及儿茶酚胺类物质的分离和检测,电泳条件:20 mmol/L Tris-HCl(pH 8.0)作为电泳缓冲溶液,500 V进样20 s,分离电压1000 V,工作电极电位0.6 V(vs Ag/AgCl),实验中保持各液池液面高度于同一水平面; NE、CA的浓度均为1.0×10-5mol/L,DA、E的浓度均为5.0×10-6mol/L . 在此条件下DA与CA可达到基线分离,而DA、E、NE分离效果则不佳,尤其E和NE的电泳峰发生严重重叠.在电泳缓冲溶液中加入0.1 % SDS 可显著改善DA、E、NE的分离度,并可得其分开的电泳峰. 与传统毛细管电泳相比,分析速度有了很大提高,结果见图3. 由图3可见,4种电活性物质得到了较好的分离,其分离度由左至右依次为:2.24,1.66,2.18.

t/s
2.3 标准样品电泳分析
电泳在未经修饰的芯片通道中进行,每次电泳实验前芯片通道依次浸泡0.1 mol/L HCl(15 min),超纯水(10 min),Tris-HCl(pH 8.0)缓冲溶液(30 min),进行预处理.所有电泳实验均为进样时样品池加进样电压,样品废液池接地,其它2个液池悬浮;分离时缓冲溶液池加分离电压,检测池接地,其它2个液池悬浮,实验过程中保持4个液池的液面水平.图4为1.0×10-4mol/L DA标准样品的电泳图谱,样品池中加入1.0×10-4mol/L DA,其他液池中均为电泳缓冲溶液,进样与分离电压分别为500 和1000 V,工作电极电位为0.6 V(vs. Ag/AgCl).迁移时间(tm)和半峰宽(W1/2)分别为71.0 和 9.0 s. 实验进行了一系列不同浓度的DA标准样品电泳分析,得到线性回归方程y=2×10-5x+3×10-11,电泳峰高与DA浓度成正相关,R2=0.9989,DA浓度在1×10-7~1×10-4mol/L范围内线性关系良好,采用该方法定量较为可靠.
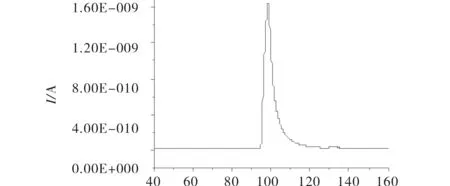
t/s
2.4 单细胞进样及分析
芯片通道依次用0.1 mol/L HCl,超纯水及电泳缓冲溶液浸泡处理,样品池中加入细胞悬液(120 μL),缓冲液池中加入含0.1 % SDS的Tris-HCl(pH 8.0)缓冲溶液,样品废液池及检测池中均加入Tris-HCl(pH 8.0)缓冲溶液,除样品池外,缓冲液池和样品废液池中分别加入100 μL溶液,检测池的液面高度与缓冲液池和样品废液池高度平行,实验发现,若细胞悬液中细胞密度过大,芯片通道口容易被细胞堵塞,若细胞悬液中细胞密度过小,细胞不易进入通道,当细胞密度调整为约5×104cells/mL时,在上述液面高度差的条件下,细胞能以大约2 s的时间间隔依次进入样品通道,细胞进样溶膜的过程见图5. 当细胞进入双T通道的瞬间施加1000 V分离电压,细胞在分离电场以及SDS的作用下迅速溶膜.

(a)单个细胞位于样品池 (b)进入样品通道 (c)出现在双T通道 (d)溶膜 (e)分离检测
图6为以纳米碳纤维电极作电化学检测器2次检测所得单个PC12细胞的单个电泳峰,实际样品和标准样品的测定采用同一根工作电极,工作电极的检测电位为0.6 V(vs. Ag/AgCl). 据报道PC12细胞中含有的主要电活性物质为DA[13,15],对比实际样品,与标准DA电泳图谱的迁移时间基本一致,可判断所检测到的信号为DA电泳峰.由于实验采用的芯片双T进样通道长250 μm,标准样品的进样量较单个细胞破膜液(直径约15 μm)的大,电泳峰宽也相应较大.根据标准DA样品的工作曲线计算出单个细胞中DA含量,得到5个单个PC12细胞中DA含量分别为0.73,0.64,0.95,1.28和0.42 fmol,单个PC12细胞中DA平均含量为0.80±0.33 fmol,尽管实验采用的为同一批细胞,由于细胞之间存在大小、生长状态等个体差异,导致单个PC12细胞中的DA含量有较大差异,结果与文献[15]相近,较文献[16]偏低,实验结果的差异可能基于细胞的来源不同所致.

t/s t/s
3 结语
采用自组装的微流控芯片检测系统安培法柱末检测模式,以纳米碳纤维电极为工作电极,实现了对4种儿茶酚胺类物质的基线分离检测,设计了一种在微流控芯片电泳中单个细胞连续进样和溶膜的控制方式,仅需一路高压控制即可实现.按照这一设计,在自行组装的微流控芯片电化学检测系统上实现了单个PC12细胞快速进样、溶膜及分析.
[1]Omiatek D M, Santillo M F, Heien M L. Hybrid capillary-microfluidic device for the separation, lysis, and electrochemical detection of vesicles [J]. Anal Chem, 2009, 81: 2294-2302.
[2]Xia F Q, Jin W R, Yin X F, et al. Single-cell analysis by electrochemical detection with a microfluidic device [J]. J Chromatogr A, 2005, 1063: 227-233.
[3]Lai C C J, Chen C H, Ko F H. In-channel dual-electrode amperometric detection in electrophoretic chips with a palladium film decoupler [J]. J Chromatogr A, 2004, 1023: 143-150.
[4]Lindström S, Andersson-Svahn H. Overview of single-cell analyses: microdevices and applications [J]. Lab Chip, 2010(10): 3363-3372.
[5]Roman G T, Chen Y L, Viberg P, et al. Single-cell manipulation and analysis using microfluidic devices [J]. Anal Bioanal Chem, 2007, 387: 9-12.
[6]Gao J, Yin X F, Fang Z L. Integration of single cell injection, cell lysis, separation and detection of intracellular constituents on a microfluidic chip [J]. Lab Chip, 2004(4): 47-52.
[7]Zhang X Y, Li Q L, Chen Z Z, et al. Electrokinetic gated injection-based microfluidic system for quantitative analysis of hydrogen peroxide in individual HepG2 cells [J]. Lab Chip, 2011(11): 1144-1150.
[8]Woolley A T, Lao K, Glazer A N, et al. Capillary electrophoresis chips with integrated electrochemical detection [J]. Anal Chem, 1998, 70: 684-688.
[9]Wang J, Tian B M, Sahlin E. Integrated electrophoresis chips/amperometric detection with sputtered gold working electrodes [J]. Anal Chem, 1999, 71: 3901-3904.
[10]Zamaleeva A I, Sharipova I R, Shamagsumova R V, et al. A whole-cell amperometric herbicide biosensor based on magnetically functionalised microalgae and screen-printed electrodes [J]. Anal Methods, 2011(3): 509-513.
[11]Cheng H, Huang W H, Chen R S, et al. Carbon fiber nanoelectrodes applied to microchip electrophoresis amperometric detection of neurotransmitter dopamine in rat pheochromocytoma (PC12)cells [J]. Electrophoresis, 2007, 28: 1579-1586.
[12]Shi B X, Huang W H, Cheng J K. Determination of neurotransmitters in PC12 cells by microchip electrophoresis with fluorescence detection [J]. Electrophoresis, 2007, 28: 1595-1600.
[13]Mir T A,Shinohara H,Shimizu Y. Enzyme-luminescence method:tool for evaluation of neuronal differentiation based on real-time monitoring of dopamine release response from PC12 cells [J]. Anal Methods,2011,3:837-841.
[14]Huang W H, Pang D W, Tong H, et al. A method for the fabrication of low-noise carbon fiber nanoelectrodes [J]. Anal Chem, 2001, 73: 1048-1052.
[15]Zhang L Y, Qv S F, Wang Z L, et al. Determination of dopamine in single rat pheochromocytoma cell by capillary electrophoresis with amperometric detection [J]. J Chromatogr B, 2003, 792: 381-385.
[16]Gilman S D, Ewing A G. Analysis of single cells by capillary electrophoresis with on-column derivatization and laser-induced fluorescence detection [J]. Anal Chem, 1995, 67: 58-64.

