综纤维素氢键模式的研究
吕惠琳 马邕文, 万金泉, 王 艳
(1.华南理工大学制浆造纸工程国家重点实验室,广东广州,510640;2.华南理工大学环境科学与工程学院,广东广州,510006)
近年来,关于纤维素大分子的聚集态结构的研究多集中在纤维素各种结晶变体间的转化上,广角X射线衍射(XRD)和红外光谱(FT-IR)是研究纤维素结构的有效手段。其中,XRD在确定纤维素晶型转化、纤维素结晶度、晶面指数和晶面尺寸等方面发挥了重要作用[1-3]。FT-IR是研究纤维素分子链中氢键结构的有效方法[4-5],氢键的形成使纤维素分子链的网络结构更为牢固,不利于纤维素的润胀和化学改性[6-8]。将XRD和FT-IR结合研究氢键类型间的转化可以作为研究各种工艺条件下纤维素晶体结构变化的一种新思路[9-11]。
纤维素的氢键包括分子间氢键和分子内氢键,氢键类型和其相对含量的分布影响纤维素晶型、润胀改性等物理化学性能。目前关于纤维素氢键的研究,国外学者多是有目的地设计物理化学工艺条件,并用XRD和FT-IR结合直接研究纤维素的不同结晶变体的转化,而在非预设的工艺条件下对氢键类型变化、晶型改变的微观机理的研究报道很少。基于当前木质纤维素水解是利用可再生资源的前提,及考虑到稀酸水解是非均相的局部水解过程(即主要作用于纤维素的无定形区)[12],本研究以硫酸盐桉木浆为原料,设计常温下稀酸水解无定形区的实验过程,结合XRD和FT-IR研究纤维素在稀酸水解条件下氢键模式的分布,以分析氢键类型对晶型变化的影响,为进一步研究木质纤维素化学改性的机理、提高植物纤维利用率提供理论依据。
1 实验
1.1 原料
广西贺县某造纸厂的桉木木片,水分11.49%。
1.2 实验方法
1.2.1 硫酸盐法蒸煮
工艺条件:用碱量17%,硫化度25%,液比1∶4,升温时间2h,保温时间2h,最高温度170℃。对所得的桉木浆的主要化学成分进行分析,其纤维素含量88.15%(硝酸法),半纤维素含量21.46%(GB/T745—1989),Klasson木素含量7.09%(GB/T747—1989)。
1.2.2 脱木素处理
脱木素采用亚氯酸钠法(GB/T2677.10—1995):称取2g绝干浆,装入综纤维测定仪,加入65mL蒸馏水、0.5mL冰醋酸、0.6g亚氯酸钠(按100%计),75℃恒温水浴1h,再加入0.5mL冰醋酸、0.6g亚氯酸钠,重复4次,直到试样变白为止。用G2玻璃滤器抽滤,蒸馏水洗至滤液不再呈酸性为止,最后用少量丙酮洗涤3次,一部分放入烘箱中105℃至质量恒定(测得综纤维素含量为84.32%),一部分接着进行下面的稀酸水解处理。
1.2.3 稀酸水解处理
将样品用0.1mol/L NaOH浸泡过夜,然后用去离子水洗至pH值4~5。此过程重复2次后,样品分别用2.5mol/L HCl、50%的H2SO4水解8h,最后再用去离子水将样品洗涤至pH值4~5,并进行自然风干。
1.3 测试方法
德国Bruker公司产的D8 ADVANCE型X射线衍射仪。测试条件:Ni滤波,Cu靶Kα射线,管压40kV,管流30mA,步长0.02°,扫描速率17.7s/步,扫描范围4°~60°。
美国Nicolet公司生产的NEXUS 670型傅里叶变换红外光谱仪,OMNIC7.3.0.94操作软件,扫描范围4000~400cm-1,仪器分辨率为4cm-1,扫描次数32次。
1.3.1 XRD谱图处理
纤维素I的XRD特征峰[13](101,10,002)在2θ为14.5°、16.5°、22.5°时,根据经验法计算结晶指数,即,其中I002为22.5°的衍射强度,Iam为18°的衍射强度,晶面尺寸采用谢利公式进行计算:
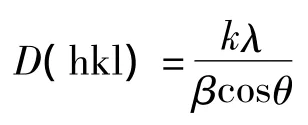
式中,k为谢利常数,λ为X射线波长,β为衍射峰半峰宽。
1.3.2 FT-IR谱图处理
红外二阶导数谱是红外光谱中常用的分辨出谱图中重叠峰的方法,采用萨维斯-高莱(Savitsky-Golay)最小二乘多项式来计算,可用13点二次函数[14]的表达式。
本文中红外谱图纵坐标采用的是吸光度,吸光度作为纵坐标时吸收峰所对应的是二阶导数谱的负峰值。另外,应用红外光谱仪自带的omnic软件进行傅里叶去卷积处理提高谱图的表观分辨率[15],并平滑处理。
对所得谱图3700cm-1~3000cm-1处的氢键曲线求二阶导数曲线,根据所得结果判断各子峰的峰位和峰宽。采用origin软件的曲线拟合功能手动设置峰位和峰宽进行Gaussian曲线拟合,多次拟合使方差达到最小。依据参考文献中的峰位确认分子内和分子间的氢键峰归属,计算各子峰面积,统计各种氢键的相对百分含量[16]。
2 结果与讨论
2.1 XRD谱图的分析
从图1可以看到,样品处理前后特征衍射峰的位置基本没变,说明晶型没有发生改变,仍然是纤维素I,但是衍射强度在不同处理条件下有明显变化,特别是纤维素002面的结晶峰,综纤维素、盐酸水解综纤维素和硫酸水解综纤维素的衍射强度分别为6140、3423和5500。

图1 纤维素I的XRD衍射图
2.2 纤维素的结晶度和晶面尺寸的变化
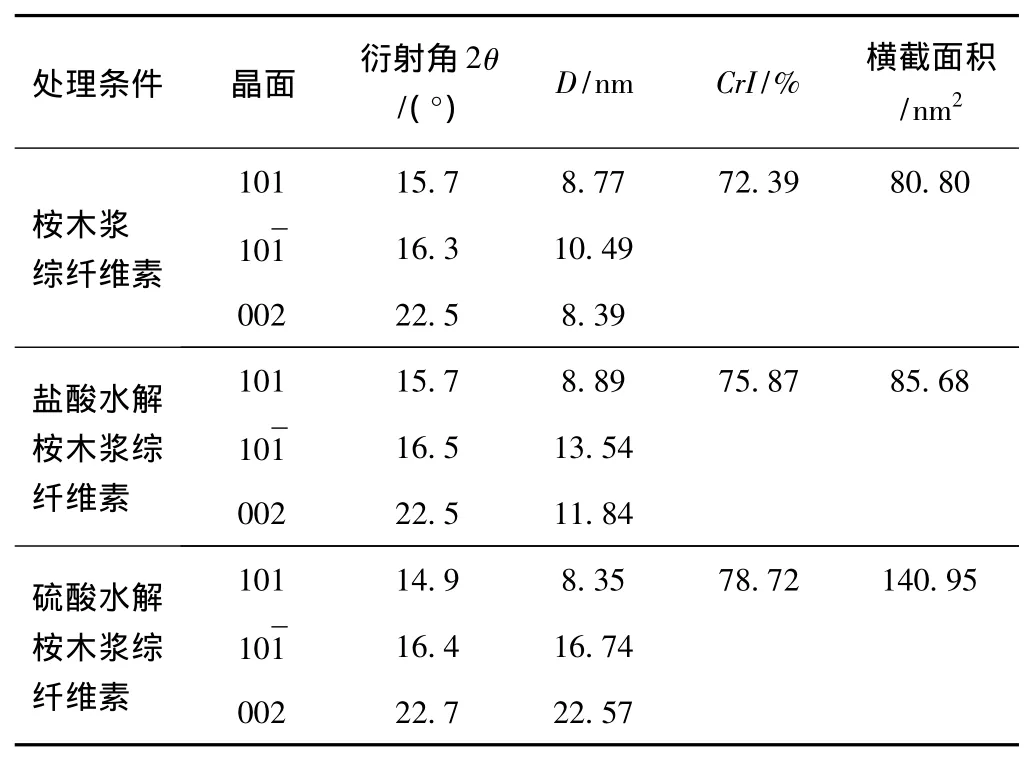
表1 不同处理过程纤维素结晶度和晶面尺寸的变化
表1是由XRD谱图得到的纤维素的结晶度和晶面尺寸的变化。对晶相纤维素的研究表明,纤维素I的XRD特征吸收峰(101,10,002)一般在2θ为14.5°、16.5°、22.5°时,由XRD叠加谱图可以看到002面位置基本没有改变,但垂直002面微晶体尺寸发生明显的变化,3种纤维样品的晶面尺寸经过计算分别为8.39、11.84、22.57nm。这说明不论是盐酸还是硫酸水解处理并没有改变纤维素原来的晶型,只是影响了晶面尺寸[17],这种变化在红外谱图上体现为纤维素链的不同氢键的比例发生了变化,另外,还发现3种纤维素样品的晶面横截面积也发生了明显变化,分别为80.80、85.68、140.95nm2,表明经过水解处理后,纤维素的晶面横截面积增大,使得晶区反应表面积减小,不利于各种化学反应[18]。
2.3 FT-IR分析
图2表明,3个样品的的红外谱图大体相同,没有新的吸收峰出现,说明并没有在纤维素大分子中引入新的基团;吸收峰强度存在的差异表明处理只是对原有基团的振动强度产生了影响。
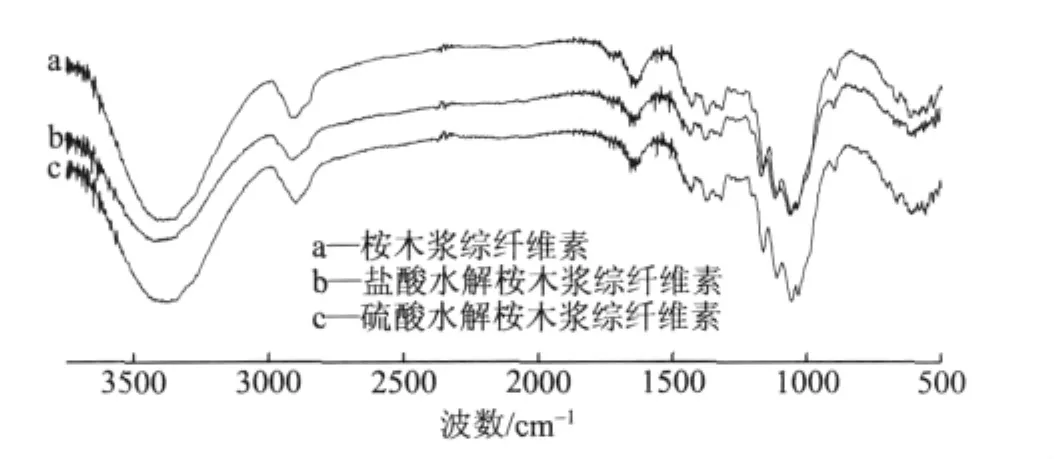
图2 不同结晶度的纤维素样品的红外谱图
随着稀酸水解的处理,代表氢键的3650~3000cm-1间的吸收峰宽化,向低波数方向偏移,可知“纤维-纤维”间氢键增强[19],红外结晶指数增大,分别为95.59%、97.40%、100.52%。
2.4 红外谱图的氢键拟合分析
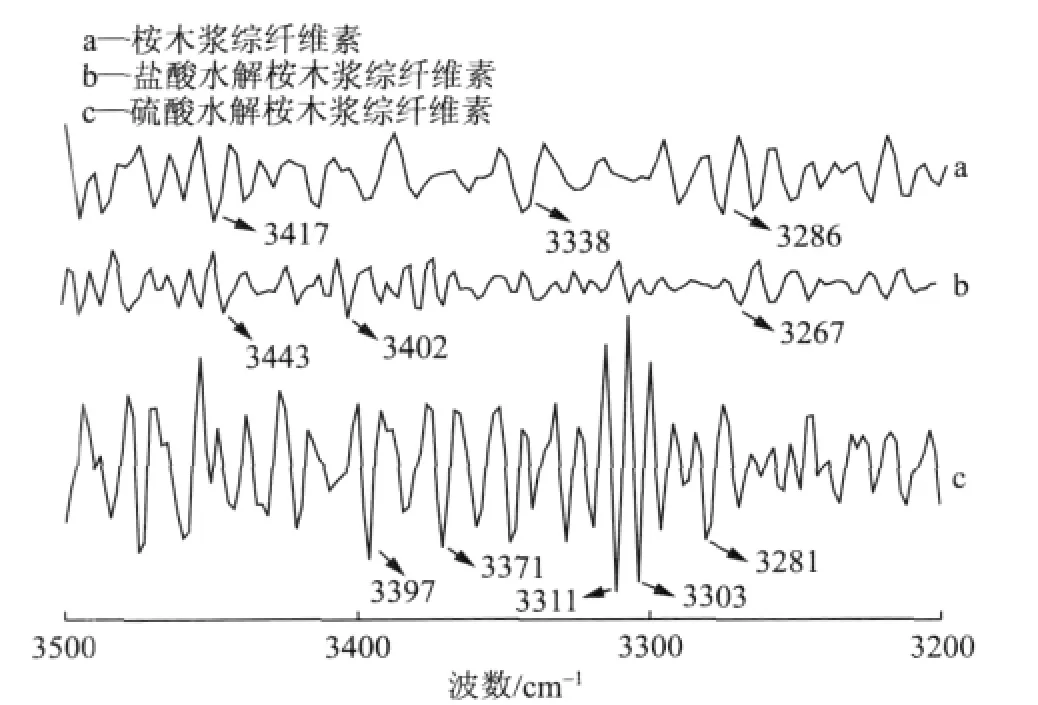
图3 不同样品的导数谱图
图3是二阶导数谱,帮助寻找分峰的位置。纤维素结晶区的羟基通过氢键产生作用,由于氢键分为分子内氢键和分子间氢键,表现在红外光谱的吸收波数上是不一样的。从样品的XRD谱图分析可知,稀酸水解前后纤维素仍然是I型,而据文献报道[20-21],纤维素I分子内氢键O(2)H...O(6)、O(3)H...O(5)和分子间氢键O(6)H...O(3’)的特征吸收波数分别在3455~3410cm-1、3375~3340cm-1、3310~3230cm-1,由此结合导数光谱进行高斯分峰拟合。图4显示了纤维素的红外图谱氢键区域拟合。表2列出了拟合结果和分峰的强度。
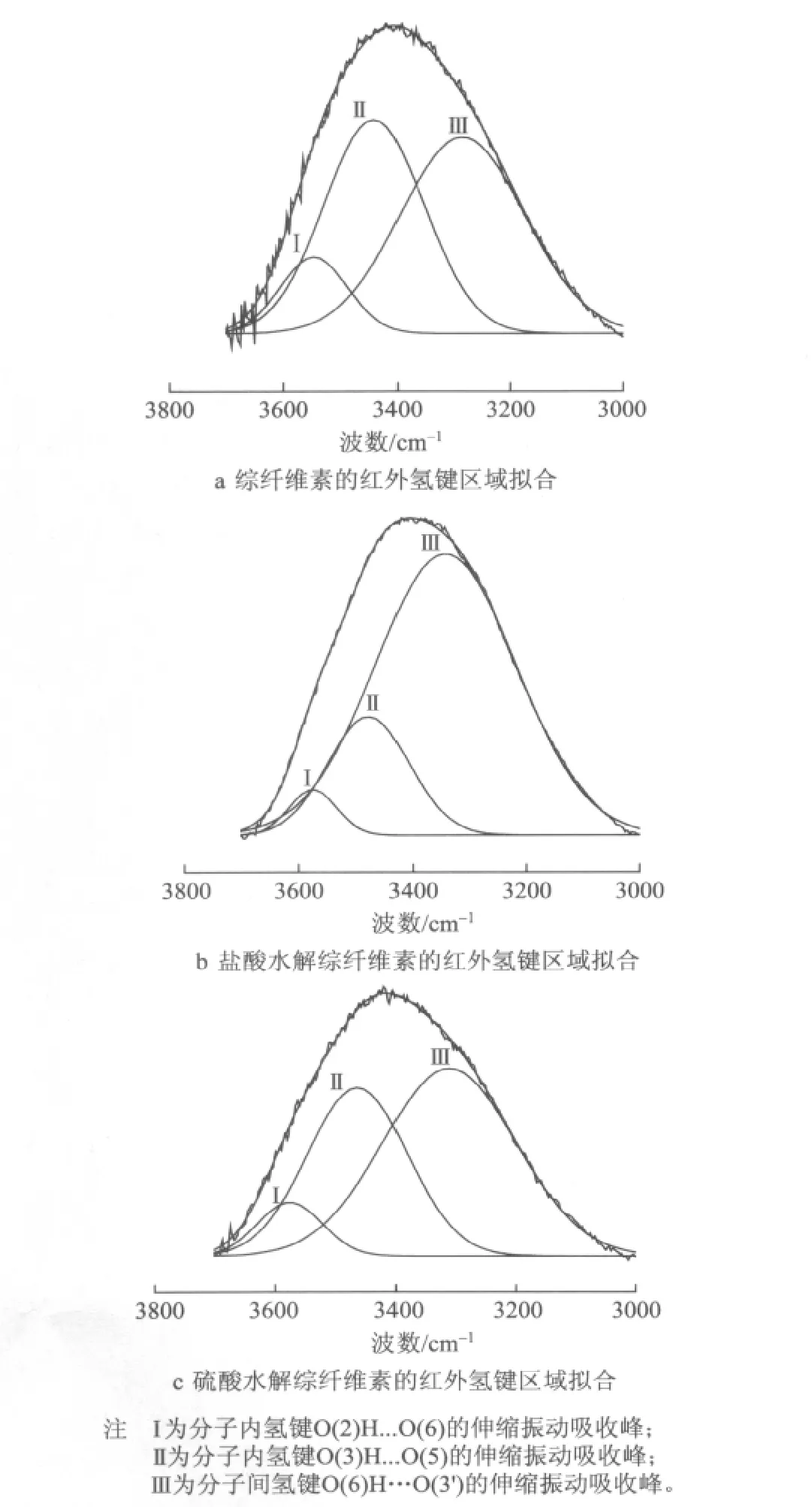
图4 不同浆样的红外图谱氢键区域拟合
对图3中的谱图做基线调整后,采用高斯拟合分出纤维素中的3种主要氢键形式,分别用图4中的谱带Ⅰ、Ⅱ、Ⅲ表示。随着样品结晶度的增加,比较a、b样品分子内氢键O(2)H...O(6)的强度从10.05%下降到4.19%,分子内氢键O(3)H....O(5)的强度从41.78%下降到18.74%,分子间氢键O(6)H...O(3’)的强度则从48.15%上升到77.07%。

表2 不同结晶度红外谱图氢键区域的拟合结果
用50%的硫酸水解去除无定形相时,比较Ⅰ、Ⅱ、Ⅲ样品发现,分子内氢键O(2)H...O(6)、O(3)H...O(5)强度较盐酸水解下降得少,分子间氢键强度上升的幅度则较之盐酸水解也小。分子内氢键O(2)H...O(6)的强度从10.05%下降到7.63%,分子内氢键O(3)H...O(5)的强度从41.78%下降到37.15%,分子间氢键O(6)H...O(3’)的强度则从48.15%上升到55.22%。
由b和c样品的各氢键强度的变化可知,盐酸水解能更快地破坏非结晶区的分子内氢键,增加纤维素分子间的氢键,使得无定形区的有序性增大,达到去除无定形相的目的。
另外,从a、b、c样品可以看到在经过处理得到的综纤维素中分子间氢键占据优势地位,纤维素链间主要靠分子间氢键结合在一起,稳定纤维素链,分子内氢键处于辅助地位,这也符合分子间氢键的键能大于分子内氢键的规律[22]。
从以上分析可知,盐酸或者硫酸水解无定形相达到了增大纤维素结晶度的目的,在此过程中,水解溶液对纤维素氢键的影响体现在几种氢键的类型间的相互转化,但是并没有改变纤维素I的基本晶型的组成,这一点在XRD谱图的分析中得到辅助证明。
3 结论
3.1 桉木浆综纤维素、盐酸水解桉木浆综纤维素和硫酸水解桉木浆综纤维素中分子间氢键的相对含量分别为48.15%、77.07%、55.22%,证实了纤维素链间主要靠分子间氢键结合在一起,稳定纤维素链,分子间氢键处于辅助地位,在盐酸或者硫酸水解时都是首先破坏纤维素无定形区的氢键。
3.2 XRD谱图分析表明,纤维素I的基本晶型组成没有发生变化,只是垂直于002面晶面尺寸发生明显变化,桉木浆综纤维素、盐酸水解桉木浆综纤维素和硫酸水解桉木浆综纤维素的纤维素晶面尺寸分别为8.39、11.84、22.57nm。这说明不论是盐酸还是硫酸水解处理并没有改变纤维素原来的晶型,只是影响了晶面尺寸,这种变化在红外谱图上表现为纤维素链的不同氢键的比例发生了变化,而其特征吸收峰并没有发生改变。
3.3 盐酸或者硫酸水解无定形相达到了增大纤维素结晶度的目的,在此过程中,稀酸水解液对纤维素氢键的影响体现在几种氢键的相互转化。
3.4 红外二阶导数谱图在重叠峰的分峰拟合上起到了关键作用,对于氢键区域谱图重叠严重的纤维素的红外光谱,二阶求导帮助得到分峰拟合的信息,通过分峰拟合分析纤维素的氢键类型和晶型之间的关系是探索纤维素晶型改变的又一有效手段。
[1]Nishiyama Yoshiharu,Sugiyama Junji,Chanzy Henri,et al.Crystal Structure and Hydrogen Bonding System in Cellulose Iαfrom Synchrotron X-ray and Neutron Fiber Diffraction[J].J Am Chem.Soc,2003,125(47):14300.
[2]Wada Masahisa,Nishiyama Yoshiharu,Langan Paul.X-ray Structure of Ammonia CelluloseI:New Insights into the Conversion of Cellulose I to Cellulose IIII[J].Macromolecules,2006,39:2947.
[3]Wada Masahisa,Heux Laurent,Nishiyama Yoshiharu,et al.X-ray Crystallographic,Scanning Microprobe X-ray Diffraction,And Cross-Polarized/Magic Angle Spinning13CNMR Studies of The Structure of CelluloseⅢⅡ[J].Biomacromolecules,2009,10:302.
[4]Focher B,Palma M T,Canetti M,et al.Structural differences between non-wood plant celluloses:Evidence from solid state NMR,vibrational spectmscopy and X-ray diffractometry[J].Industrial Crops Products,2001,13:193.
[5]Carmen-Mihaela Popescu,Ghita Singurel,Maria-Cristina Popescu,et al.Vibrational spectroscopy and X-ray diffraction methods to establish the differences between hard wood and softwood[J].Carbohydrate Polymers,2009,77:851.
[6]詹怀宇.纤维化学与物理[M].北京:科学出版社,2005:128.
[7]Ye Daiyong,Farriol X.Improving accessibility and reactivity of celluloses of annual plants fort theynthesis of methylcellulose[J].Cellulose,2005,12(5):507.
[8]Marechal Y,Chanzy H.The hydrogen bond network in Iβcellulose as observed by infrared spectrometry[J].Journal of Molecular Structure,2000,523:183.
[9]颜志勇,王华平,陈仕艳,等.细菌纤维素的晶体结构[J].材料导报,2008,22(8):127.
[10]Sugiyama Junji,Persson Jan,Chanzy Henri.Combined infrared and electron diffraction study of the polymorphism of native celluloses[J].Macromolecules,1991,24:2461.
[11]Kondo T,Sawatari C.A Fourier transform infra-red spectroscopic analysis of the character of hydrogen bonds in amorphous cellulose[J].Polymer,1996,37:393.
[12]张军伟.木质纤维素酸水解研究[D].无锡:江南大学化学工艺系,2008.
[13]杨淑蕙.植物纤维化学[M].北京:中国轻工业出版社,2001:180.
[14]邢本刚,梁 宏.FT-IR在蛋白质二级结构研究中的应用进展[J].广西师范大学学报:自然科学版,1997,15(3):45.
[15]刘志明,高闽光,徐 亮,等.去卷积和高斯拟合方法在FT-IR光谱处理中的应用[J].光谱实验室,2007,24(3):486.
[16]肖 青,万金泉.桉木浆半纤维素含量对再生纤维超分子结构及成纸性能的影响[J].纸和造纸,2009,28(7):30.
[17]张景强.微晶纤维素和麦草纤维素解结晶过程和机理[D].广州:华南理工大学,2009.
[18]Wan Jinquan,WangYan,Xiao Qing.Effects of Hemicelluloses Removal on Cellulose Fiber Structure and Recycling Characteristics of EucalyptusPulp[J].Bioresource Technology,2010,101(12):4577.
[19]Chen Yangmei,Wang Yan,Ma Yongwen,et al.Crystal and pore structure of wheat straw cellulose fiber during recycling[J].Cellulose,2010,17(2):329.
[20]Schwanninger M,Rodrigues J C,Pereirac H,et al.Effects of shorttime vibratory ball milling on the shape of FT-IR spectra of wood and cellulose[J].Vibrational Spectroscopy,2004,36:23.
[21]SangYounOh,Dong Il Yoo,Younsook Shinet,et al.Crystallines tructure analysis of cellulose treated with sodium Hydroxide and carbondioxide by means of X-ray diffraction and FT-IR spectroscopy[J].Carbohydrate Research,2005,340:2376.
[22]Struszczyk H.Modification of lignins.Ⅲ.Reaction of lignosulfonates with chlorophosphazenes[J].Journal of Macromolecular Science A,1986,23:973.

