碳酸氢钠浸提-钼锑抗分光光度法测定土壤中的有效磷
沈志群,张 琪,刘琳娟,邱 燕
(南通市环境监测中心站,江苏 南通 226006)
·监测技术·
碳酸氢钠浸提-钼锑抗分光光度法测定土壤中的有效磷
沈志群,张 琪,刘琳娟,邱 燕
(南通市环境监测中心站,江苏 南通 226006)
用0.50 mol/L碳酸氢钠溶液浸提中性和石灰性土壤中的有效磷。碳酸氢钠可以抑制溶液中Ca2+的活度,使某些活性较大的磷酸钙盐被浸提出来,同时也可使活性磷酸铁、铝盐水解而被浸出。浸提液与钼锑抗显色剂反应生成磷钼蓝,在波长880 nm处测量吸光度。当取样量为2.50 g时,使用50 mL碳酸氢钠溶液浸提,使用1 cm比色皿,检出限为0.4 mg/kg,测定下限为1.6 mg/kg,满足了土壤有效磷的监测要求。
土壤;有效磷;碳酸氢钠浸提;分光光度法
土壤有效磷并不是指土壤中某一特定形态的磷,也不具有真正“数量”的概念,应用不同的测定方法在同一土壤样品中可以得到不同的数量,因此土壤有效磷水平只是一个相对指标。它可以相对地说明土壤的供磷水平,可以作为一个指标判断施用磷肥是否必要,亦可作为施肥(磷)的一个推荐方法[1]。近年来,由于连续大量施用磷肥导致磷矿资源的加速耗竭,农田土壤磷素作为非点源污染源造成的地表水富营养化和地下水污染,环境保护工作也越来越重视科学、合理地施用磷肥,因而对于土壤有效磷的测定方法也提出了新的要求,不仅需要准确测出土壤中的植物有效磷水平,而且应能够反映出土壤磷对环境的潜在影响程度[2]。笔者通过试验,建立了碳酸氢钠浸提-钼锑抗分光光度法测定中性和石灰性土壤中有效磷的方法,该方法的检出限、精密度、准确度均较好,满足了土壤有效磷测定的要求。
1 试验
1.1 主要仪器和试剂
土壤样品粉碎设备;分光光度计;恒温往复振荡器,频率为50~500次/min;一般实验室常用仪器和设备。
氢氧化钠溶液:ω(NaOH)=10%;浓硫酸:ρ(H2SO4)=1.84 g/mL;浓硝酸:ρ(HNO3)=1.51 g/mL;碳酸氢钠(NaHCO3);钼酸铵[(NH4)6Mo7O24·4H2O];抗坏血酸(C6H8O6):左旋,比旋光度+21°~ +22°;浸提剂:C(NaHCO3)=0.50 mol/L,pH=8.5;酒石酸氧锑钾溶液:ρ(KSbOC4H4O6)=5 g/L;钼锑贮备液;抗坏血酸溶液:ω(C6H8O6)=10%;磷标准使用液:ρ(P)=5mg/L,用浸提剂稀释至刻度;指示剂:2,4-二硝基酚或2,6-二硝基酚,称取0.2 g 2,4-二硝基酚或2,6-二硝基酚溶于100 mL水中。
1.2 采样及样品制备
按照文献[3]中有关规定进行土壤样品的采集和保存。
将采集好的样品置于风干盘中,摊成2~3 cm的薄层,适当地压碎、翻动,拣出碎石、沙砾、植物残体。用木棒研压,然后去杂物,粉碎,充分混匀,通过1 mm土壤筛,装入磨口瓶中备用,并进行干物质的测量。
1.3 实验步骤
1.3.1 标准曲线的绘制
分别量取 0,1.00,2.00,3.00,4.00,5.00,6.00 mL磷标准使用液于50 mL容量瓶中,用浸提剂补足至10 mL。分别加水至15~20 mL左右,再加入1滴2,4-二硝基酚指示剂,然后逐滴加入硫酸溶液调至溶液近无色,加入0.75 mL抗坏血酸溶液,混匀,30 s后加5 mL钼锑贮备液,并用水定容至50 mL,混匀。此标准系列溶液中磷质量浓度依次为 0,0.1,0.2,0.3,0.4,0.5,0.6 mg/L。(注:上述操作过程中,会有CO2气泡产生,应缓慢摇动容量瓶,勿使气泡溢出瓶口。)
将上述容量瓶置于室温高于15℃处,放置30 min(若室温低于15℃,可在20~30℃水浴显色30 min)。用1 cm比色皿在880 nm波长处比色,以空白溶液为参比,分别测量吸光度。以吸光度为纵坐标,对应的磷浓度为横坐标,绘制校准曲线。
1.3.2 试样预处理
称取通过1 mm孔径筛的风干土样2.50 g,置于干燥的150 mL锥形瓶中,加入50.0 mL浸提剂,用橡皮塞塞紧,置于恒温往复振荡机上,在(25±1)℃下以170 r/min的振荡频率振荡(30±1)min,立即用无磷滤纸过滤入干燥的150 mL锥形瓶中。滤液必须当天分析。1.3.3 试样的测定
量取10.0 mL经过预处理的样品于干燥的50 mL容量瓶中,然后按照与校准曲线相同的操作步骤进行显色和测量。不加土壤样品,按上述步骤测定全过程空白,以下操作同标准曲线。校准曲线测定数据见表1。
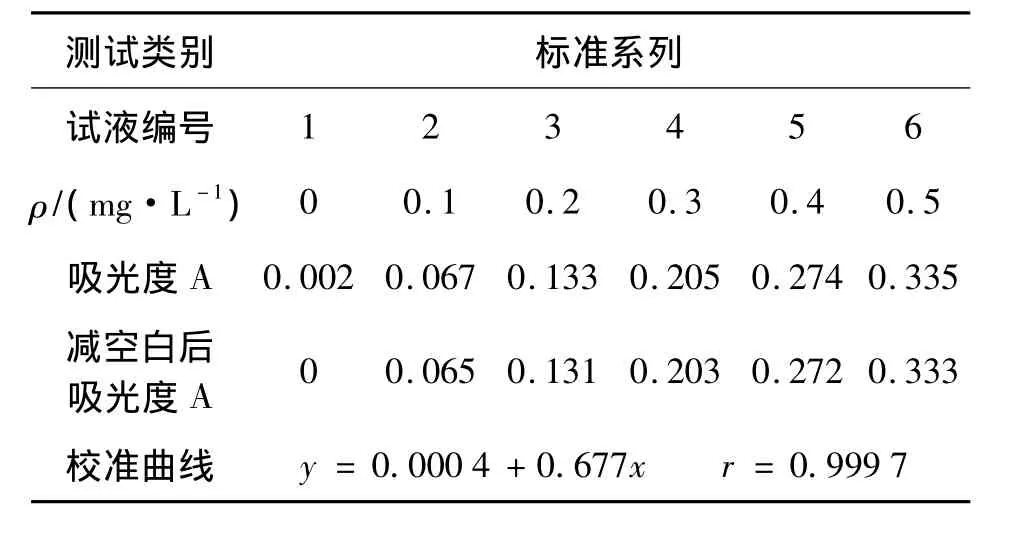
表1 校准曲线测定数据
2 结果与讨论
2.1 浸提剂pH值的控制
NaHCO3的pH往往随放置时间的延长而上升[4,5],将配置好的浸提剂放置3,5,8 和 12 d 后分别进行pH值测定,其结果见表2。
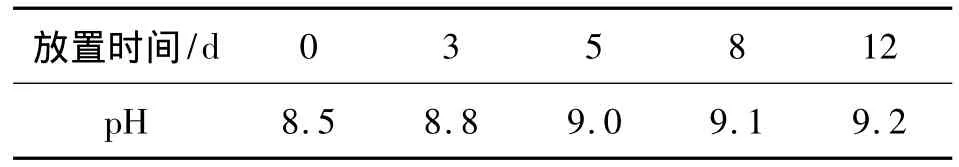
表2 浸提剂pH值的变化
从表2可知,0.5 mol/L NaHCO3存放3 d,pH值上升0.3,存放12 d,pH上升0.7。而有效磷的测定值会随浸提剂pH的上升而增大,增大幅度取决于土壤类型,因此,浸提剂pH的变化是不可忽视的。NaHCO3应临用现配,浸提前一定要将浸提剂的pH值调至8.5。
2.2 振荡时间的选择
对同一个土壤样品进行不同时间的浸提,结果见表3。
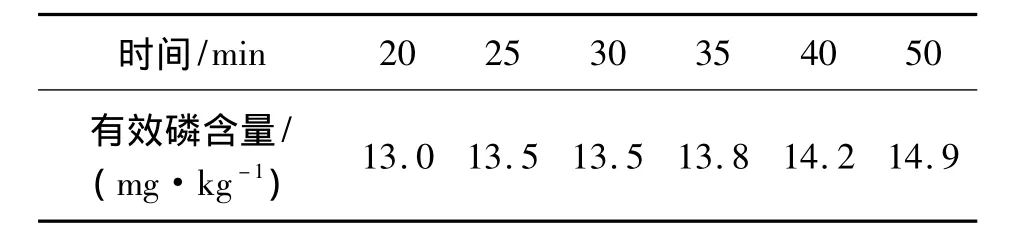
表3 不同浸提时间对同一土壤有效磷含量的影响
固相磷的溶解作用和交换作用都与作用时间有关,振荡时间愈长,浸提出来的养分愈多。因此,参照文献[4]和[5]中的规定,把振荡时间30 min改为25~30 min更加容易控制。
2.3 振荡频率的选择
对(13.8±2.3)mg/kg土壤有证样品,分别使用100,130,150,170,200,250 r/min 的振荡频率进行处理,结果见表4。

表4 不同振荡频率对同一土壤有效磷含量的影响
由表4可知,振荡频率越快,浸提效率越高。但是,频率过快会导致液体溅出,设备损坏,也超出了土壤样品标准值。因此,振荡频率选择170 r/min为宜。
2.4 浸提液适宜土壤的选择
(1)1945年,BRAY和KURTZ提出用0.025 mol/L HCl+0.03 mol/L NH4F浸提土壤,可以方便地测定酸溶性磷和吸附磷,包括大部分磷酸钙和一部分磷酸铝和磷酸铁,此方法为目前国际通用的测定酸性土壤有效磷的方法[6]。1954年,OLSEN等人提出用0.5 mol/L NaHCO3(pH=8.5)浸提,测定石灰性土壤和中性土壤中的有效磷[7]。
用本方法分别测定酸性土壤和碱性土壤有效磷含量,结果如表5所示。

表5 浸提液对不同性质的土壤有效磷含量的影响
由表5可知,用该浸提方式测定酸性土壤中的有效磷,结果偏低,这是因为碳酸氢钠溶液与土壤中的酸中和,导致浸提剂pH值降低而使结果偏低,因此,本方法适宜中性和石灰性土壤。
2.5 温度的选择
2.5.1 浸提温度
OLSEN曾指出:在20~30℃提取温度范围内,以(25±1)℃为标准,温度每升高1℃,土壤速效磷含量增加0.43 mg/kg[7]。笔者在实验中发现,振荡温度在25℃时较为合理。温度低于25℃,PO34-提取缓慢;温度超过25℃,实际操作中比较困难,而且还将会增加非有效磷的溶解。因此,本方法采用《森林土壤有效磷的测定》(LY/T 1233—1999)中的浸提温度。具体控制时,可采用恒温振荡器,保证浸提温度为25℃。
2.5.2 显色温度
参照《森林土壤有效磷的测定》(LY/T 1233—1999)和《土壤质量 磷的测定 光谱法测定碳酸氢钠溶液中可溶磷》(ISO 11263—1994)中的显色温度。温度为15~25℃。实际样品分析时,在恒温振荡机上进行提取,显色温度较易控制。
2.6 显色剂的酸度的选择
钼蓝显色是在适宜的试剂浓度下进行的,磷钼杂多酸需在一定酸度条件下生成,过酸与不足均会影响结果。因此,在磷的钼蓝比色测定中,酸度的控制最为重要。使用不同酸度的显色剂对磷的曲线和土壤的浸提液进行比色测定,其结果见表6。
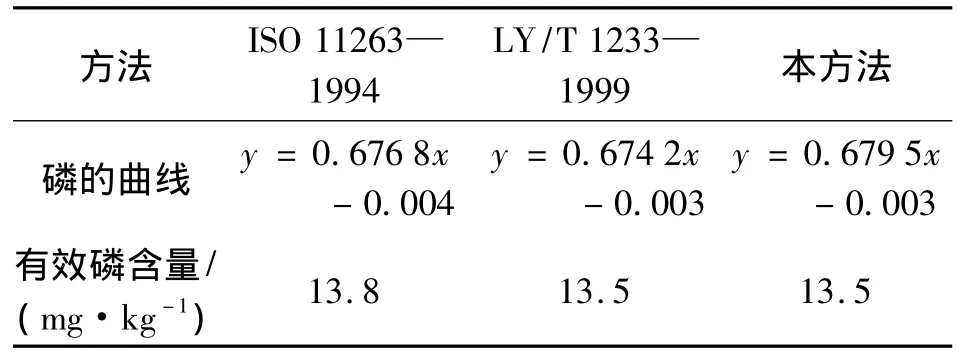
表6 不同方法的显色剂对磷的曲线和土壤有效磷的影响
从表6可知,不同方法测定的标准曲线的吸光度没有显著差异。但是,对于浸提出来的土壤样品,用不同方法的显色剂,其吸光度差异很大,这主要与土壤本身的酸度有关。因此,在加入显色剂前,需调节浸提液的pH值,即加1滴2,4-二硝基酚指示剂,用硫酸溶液调节pH至溶液呈现微黄色。
2.7 检出限的测定
按照样品分析的全部步骤,重复n(n≥7)次空白试验,将各测定结果换算为样品中的浓度,计算n次平行测定的标准偏差,按下列公式计算方法检出限[8]:

式中:n——样品的平行测定次数;t——自由度为n-1,置信度为0.99时的t分布(单侧),当n=7时,t=3.143;S——n次平行测定的标准偏差。以4倍检出限作为方法测定下限,检出限为0.4 mg/kg,检出下限为1.6 mg/kg。
2.8 精密度的测定
实验室采用高[含量为(23.3±1.4)mg/kg的有证标准样品]、中[含量为(13.8±2.3)mg/kg的有证标准样品]、低(含量为4.59 mg/kg的实际土壤)3种不同含量水平的土壤样品,每个样品平行测定6次,分别计算不同含量样品的平均值、标准偏差、相对标准偏差等各项参数(表7)。
2.9 准确度的确定
使用2个不同含量水平的有证标准样品进行测定。有证物质1的编号为GBW 07414,浓度为13.8 mg/kg;有证物质2的编号为ASA-2a,浓度为23.3 mg/kg。每个有证标准样品平行测定6次,分别计算不同含量水平有证标准样品的平均值、相对误差等各项参数,结果见表8。
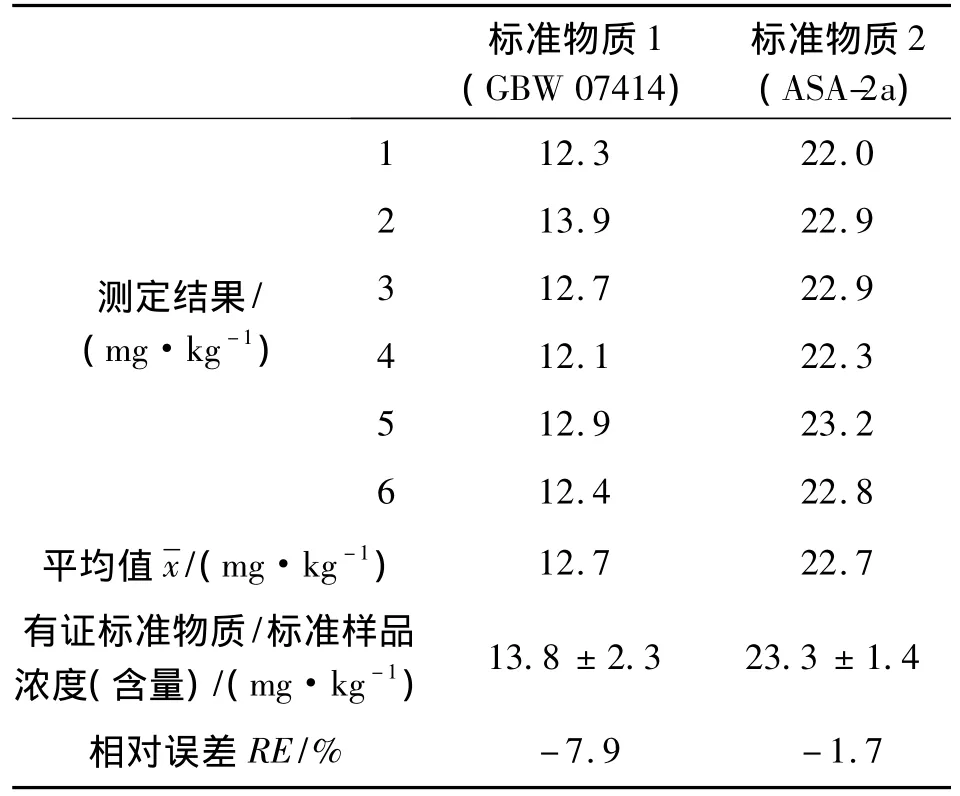
表8 有证标准物质/标准样品测试数据
2.10 其他影响因素
所有的采样仪器和设备、分析仪器和设备经处理后都不应含磷。试验中使用的玻璃器皿可用(1+5)盐酸溶液(盐酸与蒸馏水体积比为1∶5)浸泡2 h,或用不含磷的洗涤剂清洗。比色皿用后应以稀硝酸或铬酸洗液浸泡片刻,以除去吸附的钼蓝有色物质。
由于浸提出来的养分受浸提液浓度、水土比例、振荡时间、温度等影响,因此要严格控制好实验室的温度。浸提温度和显色温度要严格控制在(25±1)℃,否则试验误差较大。
3 结语
采用碳酸氢钠浸提-钼锑抗分光光度法测定中性及石灰性土壤中有效磷,该方法干扰少,显色范围宽,实际土壤样品测定RSD为1.92% ~5.04%,标准土壤样品相对误差分别为1.7%和7.9%,精密度和准确度均满足要求。
[1] 鲁如坤.土壤农业化学分析[M].北京:中国农业科技出版社,1999:179-181.
[2] 卜玉山,杨凤仙,韩明正.土壤生物有效磷测定方法的发展及其在美国的研究动态[J].山西农业大学学报,2001,21(2):184-187.
[3] HJ/T 166 土壤环境监测技术规范[S].
[4] LY/T 1233—1999 森林土壤有效磷的测定[S].
[5] ISO 11263:1994 土壤质量 磷的测定 光谱法测定碳酸氢钠溶液中可溶磷[S].
[6] BRAY R H,KURTZ L T.Determination of total,organic and available forms of phosphorus in soils[J].Soil Science,1945,59:39-45.
[7] OLSEN S R,COLE C V,WATANABE F S,et al.Estimation of available phosphorus in soils by extraction with sodium bicarbonate[R].1954.
[8] HJ 168—2010 环境监测分析方法标准制修订技术导则[S].
Determination of Available Phosphorus in Soil by Sodium Bicarbonate Extraction Mo-Sb Anti-spectrophotometry Method
SHEN Zhi-qun,ZHANG Qi,LIU Lin-juan,QIU Yan
(Nantong Environmental Monitoring Central Station,Nantong ,Jiangsu 226006,China)
Theavailable phosphorus was extracted by 0.50 mol/L sodium bicarbonate solutionin neutral and calcareous soil.Sodium bicarbonate solution can inhibit the activity of Ca2+,so that the calcium phosphate of large activity were extracted;meanwhile active iron phosphate and aluminum salt was leached by hydrolysis.Molybdenum Blue reaction occurred by mixing elution and Mo-Sb anti-chromogenic reagent and the absorbance was measured at a wavelength of 880 nm.In this study,the method of measuring concentrations of available phosphorus in soil was developed.The sample volume was 2.50 g and sodium bicarbonate solution was 50 mL.The detection limit of this method was 0.4 mg/kg and lower limit was 1.6 mg/kg when 1 cm cuvette was used.
soil;available phosphorus;sodium bicarbonate extraction;spectrophotometery
X833
B
1674-6732(2011)-05-0012-04
10.3969/j.issn.1674-6732.2011.05.004
2011-06-09;
2011-07-13
2008年度环境保护标准制修订项目(1013)。
沈志群(1963—),女,高级工程师,本科,从事环境监测与管理工作。

