超声辅助复合酶法提取桑黄多糖
尹秀莲 游庆红,2
(1.淮阴工学院生命科学与化学工程学院,江苏 淮安 223001;2.南京工业大学食品与轻工学院,江苏 南京 210009)
超声辅助复合酶法提取桑黄多糖
尹秀莲1游庆红1,2
(1.淮阴工学院生命科学与化学工程学院,江苏 淮安 223001;2.南京工业大学食品与轻工学院,江苏 南京 210009)
探索超声辅助复合酶法提取桑黄多糖的最佳工艺。以多糖提取收率为指标,对超声时间、复合酶用量、作用时间、酶解温度及pH进行单因素试验研究。结果表明:超声辅助复合酶法提取桑黄多糖的最佳条件为超声时间300s、固定pH 4.0,应用2.0%的木瓜蛋白酶、果胶酶和纤维素酶50℃酶解90min后,多糖得率可达1.46%。该提取工艺多糖提取收率高,可应用于实际生产。
超声;复合酶法;桑黄;多糖;单因素试验
桑黄 (phellinus linteus)是一种珍贵的药用真菌[1],主要寄生在桑树、杨树、栎树等树干上。研究[2-5]发现,桑黄具有极高的药用价值,如抗癌、抗氧化、抗纤维化、增强免疫力、抗血管增生、降血糖等。药理学研究[6]表明,三萜、多糖和黄酮类物质是其活性成分,其中以多糖为主。目前,常用的桑黄多糖提取方法有热水提取法[7]和超声辅助提取法[8],这两类方法操作简单,但时间长,提取率较低。超声辅助复合酶提取法是现代中药有效成分提取的新方法[9],其中超声辅助提取能够缩短提取时间、提高提取效率[10];复合酶提取由于反应温和、操作时间短、成本较低等优势而逐渐被应用到多糖的提取研究中[11,12],但应用超声辅助复合酶法提取桑黄多糖目前鲜见报道。
本试验在对桑黄超声处理的基础上,应用复合酶法高效提取桑黄多糖,优化最佳提取工艺,提高多糖得率,以期为桑黄多糖的研究开发提供科学依据。
1 材料与方法
1.1 材料与试剂
桑黄:长白山野生,吉林博苑长白山特产科技有限公司提供;
乙醇、浓硫酸、氯仿、正丁醇、磷酸氢二钠、柠檬酸,苯酚等:分析纯,国药集团化学试剂有限公司;
纤维素酶:上海伯奥生物科技有限公司;
木瓜蛋白酶、果胶酶:杰辉生物技术有限公司。
1.2 主要仪器
超声波细胞粉碎仪:JY92-Ⅱ,宁波新芝生物科技公司。
1.3 试验方法
1.3.1 多糖含量的测定 采用苯酚-硫酸法[13]。
1.3.2 蛋白质含量的测定 采用考马斯亮蓝法[14]。
1.3.3 脱蛋白 采用Sevag法[15]。
1.3.4 多糖得率的测定 多糖得率按式(1)计算:

1.3.5 提取方法 将桑黄用蒸馏水洗净,切片,置50℃烘箱干燥12h,取出后充分研磨成粉,备用。取一定量处理样品,加适量蒸馏水,常温下超声处理一定时间后,加入pH 4.0的磷酸氢二钠-柠檬酸缓冲液适量,调节适当温度,加入一定量纤维素酶、木瓜蛋白酶和果胶酶,酶解适当时间,98℃灭酶活,10 000r/min离心5min,上清液抽滤,活性炭脱色,减压浓缩,Sevag试剂除蛋白,滤液调节乙醇浓度至80%,静置冷藏12h,5 000r/min离心10min,去上清液,取固形物,干燥得桑黄多糖。
1.3.6 超声时间的优化 取5g桑黄粉末,共5份,各加100mL蒸馏水,400W超声波功率分别超声处理150,200,250,300,350s后,加入pH 4.0的磷酸氢二钠-柠檬酸缓冲液200mL,加纤维素酶、果胶酶和木瓜蛋白酶各1.5%,酶解60min,调 节 pH 为 4.2、温 度 为 60 ℃,提 取 7h,10 000r/min离心5min,上清液抽滤,活性炭脱色,减压浓缩,Sevag试剂除尽蛋白,滤液调节乙醇浓度至80%,静止冷藏12h,5 000r/min离心10min,去上清液,取固形物,干燥,计算桑黄多糖得率。
1.3.7 复合酶水解条件的单因素优化
(1)复合酶作用温度的选择:精密称取6份桑黄粉末5.0g,按1.3.6超声处理后各加入pH 4.0的磷酸氢二钠-柠檬酸缓冲液200mL,依次加入木瓜蛋白酶、果胶酶和纤维素酶各2.0%,分别在30,40,50,60,70,80℃下酶解60min后按1.3.5提取多糖,以多糖得率为指标,优化复合酶作用的温度。
(2)复合酶用量的选择:以1.3.7(1)优化结果为基础,分别加入木瓜蛋白酶、果胶酶和纤维素酶各0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,酶解60min后按1.3.5提取多糖,以多糖得率为指标,优化复合酶的用量。
(3)复合酶作用pH 值的选择:以1.3.7(2)优化结果为基础,分别控制pH 值2.5,3.0,3.5,4.0,4.5,5.0酶解,以多糖得率为指标,优化复合酶作用的最佳pH值。
(4)复合酶作用时间的选择:以1.3.7(3)优化结果为基础,应用复合酶分别酶解50,70,90,110,130,150min,以多糖得率为指标,优化复合酶作用时间。
2 结果与分析
2.1 超声时间的优化
超声时间对多糖提取率有较大影响。本试验考察了超声时间对多糖得率的影响,数据均为3次试验结果的平均值,见表1。
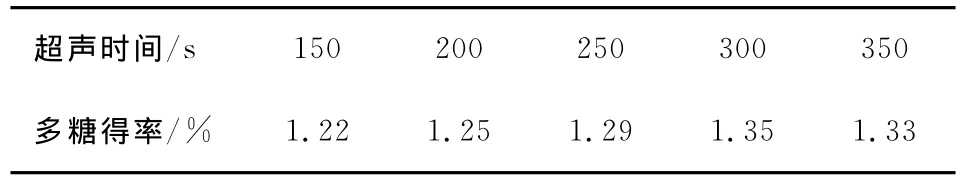
表1 超声时间对多糖得率的影响Table 1 Effect of final ultrasound time on polysaccharide yield
由表1可知,随着超声时间的增加,多糖得率随之增加,但当超声时间达300s后,多糖得率反而有所下降。这可能是由于超声波在300s内对细胞的破碎作用较大,多糖溶出较多,得率相应也高;但超声作用时间太长,其可能会破坏提取物的多糖,同时随着超声时间的延长,空穴效应的作用递减,从而使桑黄表面对多糖的吸附力增强。据此,本试验选择超声作用时间300s。
2.2 酶水解条件的单因素研究
2.2.1 酶作用温度对多糖得率的影响 由图1可知,当酶解温度低于50℃时,多糖得率随温度升高而急剧增加;当温度高于50℃时,多糖得率随温度升高而快速减少。这是由于酶活力与温度密切相关,当温度低于50℃时,酶活随温度升高而增大,多糖得率增加;而后随着温度的进一步升高,造成酶失活,酶活力降低,多糖得率因而减少。

图1 复合酶作用温度对多糖得率的影响Figure 1 The effect of reaction combine enzyme temperature on the polysaccharide yield
2.2.2 复合酶用量对多糖得率的影响 由图2可知,复合酶用量对多糖得率有显著影响,当复合酶用量低于2%时,随着酶用量的增加,多糖得率快速增加;此后继续加大酶用量时,多糖得率几乎不变,甚至有所下降。这可能是由于随着酶用量的增加部分多糖可能产生了降解作用,从而导致多糖得率略有降低。因此,确定复合酶用量为2%,此时多糖得率为1.4%。
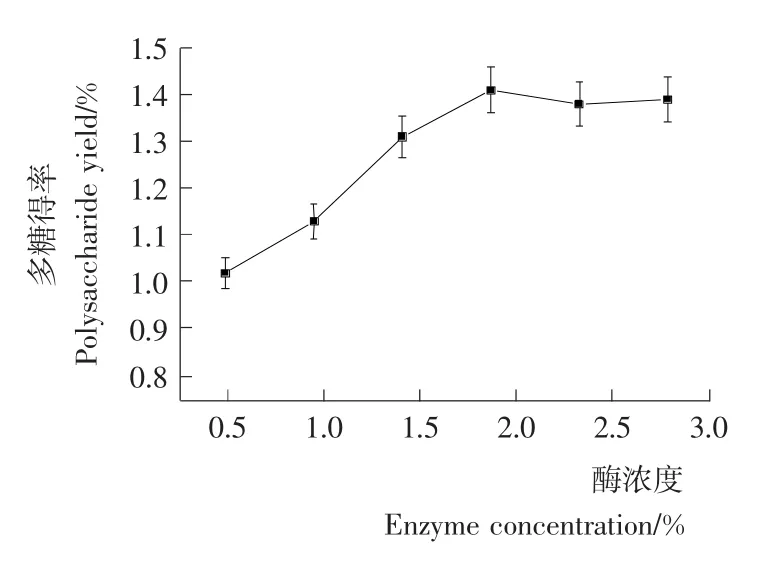
图2 复合酶用量对多糖得率的影响Figure 2 The effect of combine enzyme level on the polysaccharide yield
2.2.3 酶作用pH值对多糖得率的影响 由图3可知,pH值对多糖得率有较大影响;当pH为4.0时,多糖得率最大为1.42%;这可能是由于过酸或过碱的条件下,酶的空间结构会受到破坏,进而引起酶构象及酶活的变化,影响其与底物的结合,从而使多糖得率下降。
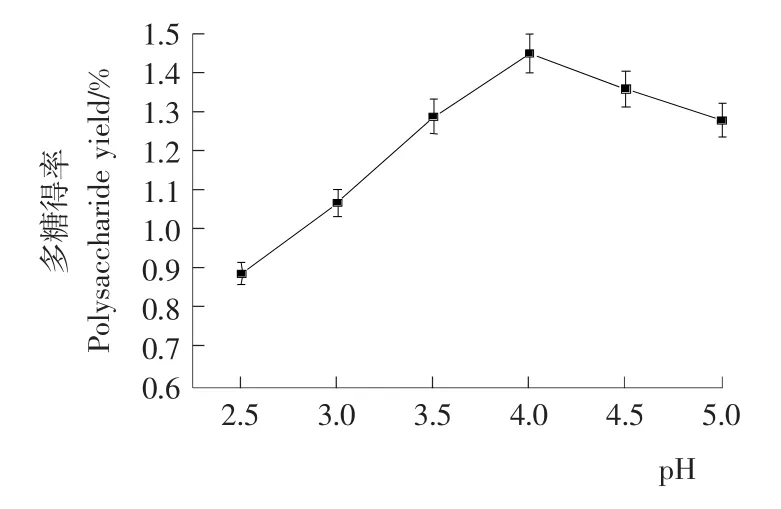
图3 不同酶作用pH值对多糖得率的影响Figure 3 The effect of pH value on the polysaccharide yield
2.2.4 酶作用时间对多糖得率的影响 由图4可知,复合酶作用时间对多糖得率有较大影响,当酶作用时间为90min时,多糖得率达最大,这是由于随着酶解时间的延长,酶解越来越完全,使得多糖得率逐步提高;之后增加酶作用时间,多糖得率基本不再增加,这是由于此时酶解已基本完全,增加酶解时间不能有效提高多糖得率,说明复合酶作用时间存在最佳值(约90min),此时多糖得率为1.46%。
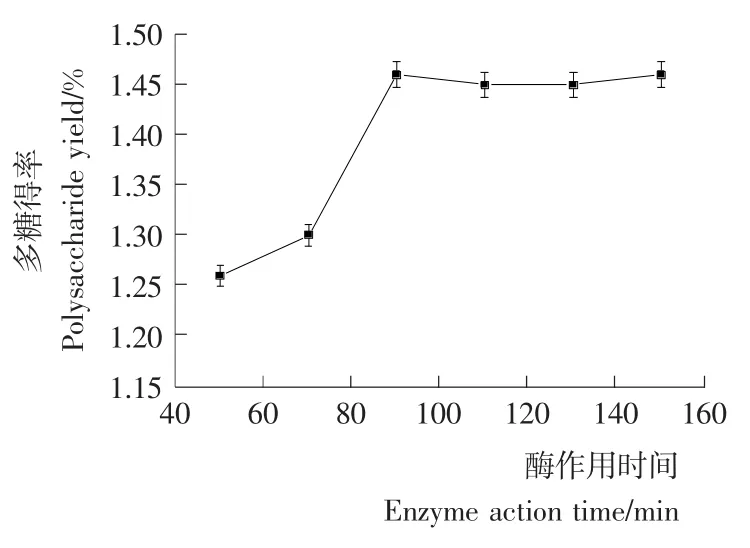
图4 不同酶作用时间对多糖得率的影响Figure 4 The effect of complex enzyme reaction time on the polysaccharide yield
3 结论
(1)本试验以野生桑黄为原料,应用超声辅助复合酶法提取桑黄多糖,经单因素试验得出最佳工艺:超声300s、固定pH 4.0,应用2.0%的木瓜蛋白酶、果胶酶和纤维素酶50℃酶解90min后,多糖得率可达1.46%,而同等条件下以热水浸提法[7]提取桑黄多糖,其多糖提取率仅为1.133%。
(2)超声辅助复合酶提取桑黄多糖,其中超声、复合酶对多糖得率影响都很大,通过超声波和复合酶的共同作用,大大促进了桑黄多糖成分的溶出。其原因可能是超声波能产生较大剪切力,再加上复合酶的酶解作用,从而使得桑黄细胞壁破裂,加速活性成分多糖的溶出,故超声辅助复合酶提取桑黄多糖得率高于热水浸提法。由此本试验将超声法和复合酶法结合起来进行多糖提取,试验结果表明,该方法切实可行;该方法也能应用于其它真菌多糖的提取;同时,采用该方法所需温度较热水浸提法低(因超声本身有一定的致热作用),故可节约能源,但超声辅助复合酶法由于复合酶的使用导致成本相对热水浸提法较高,且操作较为繁琐。
(3)由于超声和复合酶联合作用可能会对提取多糖的结构产生一定的破坏作用,从而影响多糖的一级结构、高级结构及其生物活性等;因此,有必要对不同提取方法提取多糖的结构及生物活性进行比较,以得出超声、复合酶作用到底对多糖的结构产生了何种作用。
1 王英辉,许泓瑜,敖宗华,等.桑黄发酵菌粉与桑黄子实体成分分析比较[J].食品与发酵工业,2008,34(2):126~129.
2 秦俊哲,刘华,王雪莲.桑黄子实体多糖抗癌活性的研究[J].食品科技,2009,34(3):204~207.
3 郑立军,沈业寿,季俊虬,等.桑黄胞外多糖药理活性的初步研究[J].食品科学,2007,28(1):318~321.
4 贾建波,李相前,杨文,等.桑黄多糖分离纯化及其结构初步鉴定[J].食品科学,2006,27(12):446~450.
5 戈延茹,曹恒杰,张晓兰,等.桑黄多糖的提取工艺[J].食品研究与开发,2009,30(12):57~60.
6 吕英华,王建芳,李玉平,等.药用真菌桑黄的研究进展[J].蚕业科学,2009,35(1):204~210.
7 游庆红,尹秀莲.响应面法优化桑黄多糖提取工艺研究[J].中国酿造,2010(5):67~69.
8 逯家辉,董媛,张益波,等.响应面法优化桑黄菌丝体多糖超声波提取工艺的研究[J].林产化学与工业,2009,29(2):63~68.
9 周林,李元波,曾英.超声复合酶法提取三七皂苷的研究[J].中成药,2006,28(5):6 422~6 451.
10 郭希娟,马萍,张桂芳.响应面法在南瓜多糖超声提取中的应用[J].粮油加工,2010(8):143~146.
11 马春,董秀萍,朱蓓薇.复合酶法提取姬松茸胞内多糖[J].大连轻工业学院学报,2005(3):195~198.
12 李妍,曾玩芸.酶法辅助提取巴戟天多糖的工艺研究[J].食品与机械,2010,26(1):95~97,136.
13 何新益,刘仲华.苦瓜多糖的改良苯酚-硫酸法测定和提取工艺[J].食品与机械,2007,23(8):72~75.
14 王文平,郭祀远,李琳,等.考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J].食品研究与开发,2008,29(1):115~117.
15 郑必胜,何禄英.广东虫草多糖脱蛋白及凝胶渗透色谱法表征其分子量分布的研究[J].现代食品科技,2009,25(6):707~710.
Extraction technology of polysaccharides fromphellin us lin teusby ultrasonic-assisted complex enzymatic method
YIN Xiu-lian1YOU Qing-hong1,2
(1.College of Life Sciences and Chemical Engineering,Huaiyin Institute of Technology,Huaian,Jiangsu223001,China;2.College of Food Science and Light Industry,Nanjing University of Technology,Nanjing,Jiangsu210009,China)
Ultrasonic-assisted complex enzymatic method was used to optimize the extraction conditions of polysaccharides fromphellinus linteus.Using the extraction yield of total polysaccharides as target,the process was optimized by investigating the influence of ultrasonic time,complex enzyme dosage,enzymolysis time,enzymolysis temperature and pH value.Results:Results showed that the optimal extraction conditions for polysaccharides fromphellinus linteusby ultrasonic-assisted complex enzymatic method were:ultrasonic time 300s,2.0%caroid,2.0%pectinase plus 2.0%cellulase,extraction temperature 50℃,extraction time 90min and pH 4.0,and in this condition,the polysaccharide yield could reach 1.46%.
ultrasound; complex enzymatic method;phellinus linteus;polysaccharides;single factor experiment
10.3969/j.issn.1003-5788.2011.04.015
淮阴工学院大学生科技创新重点项目(编号:312409004)
尹秀莲(1978-),女,淮阴工学院讲师,在读博士。E-mial:yinxiulian@163.com
2011-04-20

