甲磺酸伊马替尼的合成
陈灵娟,周和平,黄文峰,闫 明,姚 军
(1.重庆莱美药业股份有限公司研发中心,重庆 401120;2.河北科技大学化学与制药工程学院,河北石家庄 050018)
甲磺酸伊马替尼的合成
陈灵娟1,2,周和平1,黄文峰1,闫 明2,姚 军2
(1.重庆莱美药业股份有限公司研发中心,重庆 401120;2.河北科技大学化学与制药工程学院,河北石家庄 050018)
为研究和改进甲磺酸伊马替尼的合成工艺,以2-甲基-5-硝基苯胺为原料,先后经历加成、环合、还原、酰化等反应制备甲磺酸伊马替尼,并对其中的加成、环合、还原、酰化等反应与工艺过程进行了改进。采用经改进的工艺制备甲磺酸伊马替尼,反应总收率为41.9%,产品纯度可达99.75%(高效液相色谱法)。
甲磺酸伊马替尼;2-甲基-5-硝基苯胺;合成
甲磺酸伊马替尼由 Novartis公司开发,其化学名称为4-[(4-甲基-1-哌嗪基)甲基]-N-[4-甲基-3-[4-(3-吡啶基)-2-嘧啶基]氨基]-苯基]苯甲酰胺甲磺酸盐。伊马替尼作为一个酪氨酸激酶抑制剂选择性抑制靶点蛋白参与细胞的增殖活化,用于慢性髓细胞样白血病、费城染色体阳性白血病以及恶性胃肠道间质瘤的慢性期和加速期的治疗[1]。甲磺酸伊马替尼已在美国、欧盟和日本等国获得孤稀药物地位,并于2001-05-10获得美国食品与药品管理局(FDA)的批准。伊马替尼入市后起步较快,在高昂药价的驱动下,早已成为销售达亿元以上的抗癌药物。由于伊马替尼是信号传导抑制物的第1个新型抗增殖剂,所以显示出空前的治疗效果。由于新适应症的不断发现,该品将保持连续且稳定的增长态势,在市场运作下,其效果也远远超出了预期。有关甲磺酸伊马替尼的专利将在2013年到期,所以,对于其研究迫在眉睫。
关于甲磺酸伊马替尼(化合物1)的合成,文献中报道的方法很多[2-8],但是主要有2条合成路线,见图1和图2。第Ⅰ条合成路线是以化合物2为起始原料,先与单氰胺反应生成胍(化合物3);然后与化合物4进行环合反应,生成化合物5;再将硝基还原成氨基,生成化合物6;接着与化合物7进行缩合反应再与甲磺酸反应制得伊马替尼[2-4]。第Ⅱ条合成路线是以化合物9与化合物10反应得到化合物11,经还原得到化合物12,再与单氰胺等成胍制得化合物13,然后与化合物4环合,最后与甲磺酸成盐制得甲磺酸伊马替尼。2条路线的最主要的区别是合成的顺序不同。
笔者重复路线Ⅱ时,发现反应时间长,后处理过程复杂。所以以路线Ⅰ的合成方法为基础合成目标化合物,并对其中一些收率较低、反应条件苛刻、后处理繁琐的工艺过程进行了优化与改进。具体包含以下几个工艺过程。文献[2]中介绍了以2-甲基-5-硝基苯胺和单氰胺反应,再滴加浓盐酸成为2-甲基-5-硝基苯基硝酸胍盐酸盐,然后滴加浓硝酸,最后转变为硝酸盐。笔者直接生成盐酸盐,然后加入氢氧化钠溶液调节溶液的p H值,使化合物3直接以游离碱的形式析出,不但可以提高产物的纯度,同时可以避免下一步反应中加入氢氧化钠来中和其中的酸,使环合反应在近中性条件下进行,可以避免更多副反应的发生。在合成化合物5时,改昂贵的钯/碳催化剂为FeCl3·6H2O/活性炭,降低了成本,而收率和纯度并没有下降。最后合成伊马替尼时,采用“一锅煮”的方法,节约了成本,提高了收率[5]。化合物5在热的异丙醇中与甲磺酸成盐,降温后直接从溶剂中析出。

图1 甲磺酸伊马替尼的合成路线ⅠFig.1 Synthetic routes of imatinib mesylateⅠ
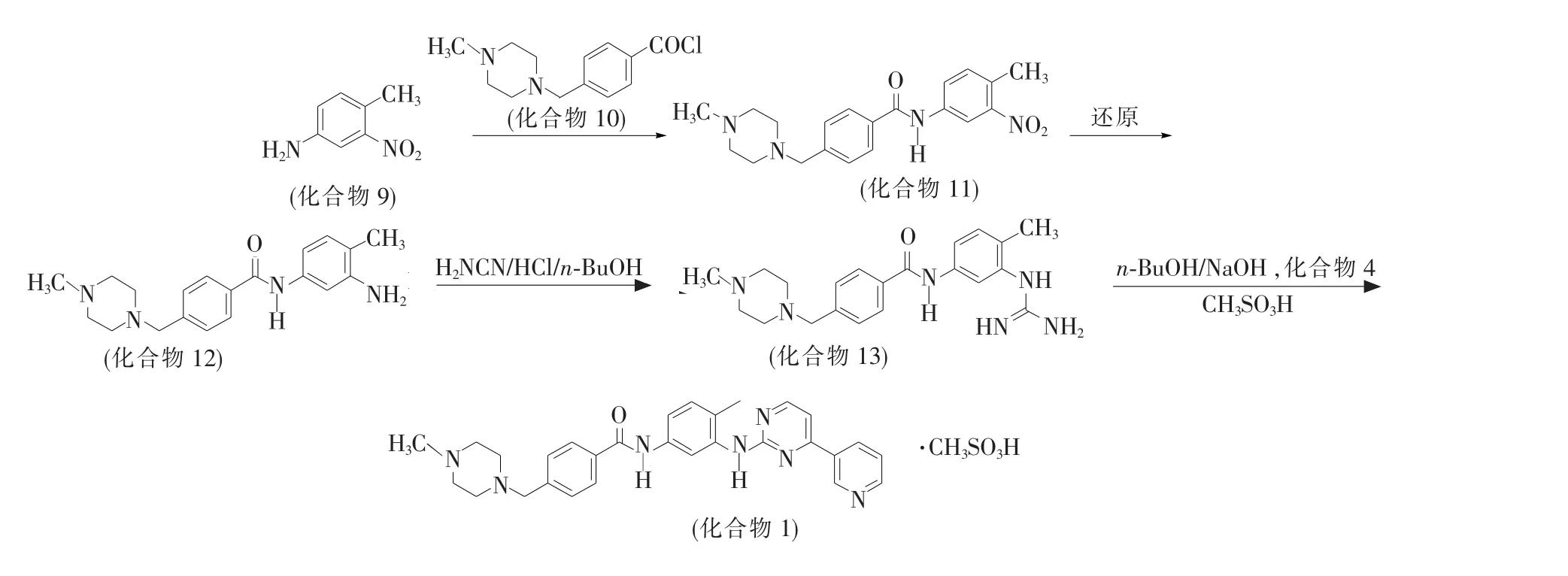
图2 甲磺酸伊马替尼的合成路线ⅡFig.2 Synthetic routes of imatinib mesylateⅡ
1 实验部分
1.1 试剂和仪器
所用试剂均为分析纯。
岛津LC-2010A,KROMASIL C18柱(0.46 cm×25 cm);SGWX-4显微熔点仪;NMR Bruker AV500核磁共振谱仪;液质联用岛津LC-MS2010EV。
1.2 实验方法与步骤
1.2.1 2-甲基-5-硝基苯基硝酸胍(化合物3)
将2-甲基-5-硝基苯胺(10 g,0.066 mol)、体积分数为50%的单氰胺(10.6 m L,0.132 mol)及40 m L异丙醇加入到反应瓶中,经机械搅拌、加热至回流,然后在10 min内滴加9.2 m L浓盐酸,继续反应1 h,停止反应,将反应液浓缩,加水稀释后,用10%(质量分数)的NaOH溶液调节p H值到9。经冰浴冷却、过滤、水洗、干燥,得到亮黄色晶体化合物3(11.26 g,收率为88.0%)。HPLC检测值为94.79%,熔点为146.2~147.0℃,在147.0℃分解(文献[2]报道合成其硝酸盐的收率为81.1%,熔点为203~206℃)。
1.2.2 3-二甲氨基-1-(3-吡啶基)-2-丙烯-1-酮(化合物4)
将3-乙酰吡啶(216 g,2.066 mol)和 N,N-二甲基甲酰胺二缩甲醇(320.4 g,2.781 mol)在100℃下反应至无甲醇蒸出,将反应液减压浓缩后加入甲苯-正己烷混合溶剂(二者体积比为1∶1),经冰浴冷却1 h,再经过滤、洗涤、干燥,得到棕黄色固体化合物4(271.98 g,收率为86.5%)。HPLC检测值为96.67%,熔点为69.5~71.2℃(文献[7]中熔点为65~67℃,收率为80.4%)。
1.2.3 N-(2-甲基-5-硝基苯基)-4-(3-吡啶基)嘧啶-2-胺(化合物5)
将化合物3(7.3 g,0.036 7 mol)溶于80 m L正丁醇中,加入化合物4(6.66 g,0.036 5 mol),加热回流12 h,停止反应。当温度降至60℃时,加入100 m L甲醇,继续搅拌2 h,经冰浴冷却1 h后过滤,再经洗涤、干燥,得到黄色固体化合物5(7.78 g,收率为69.1%)。HPLC检测值为98.71%,熔点为194.8~195.7℃(文献[6]中熔点为193~198℃,文献[3]中收率为50%)。1H NMR (DMSO-d6):9.26(s,1H),9.23(s,1 H),8.80(s,1 H),8.72(d d,J=5.0 Hz,1H),8.62(d d,J=5.0 Hz,1 H),8.45~8.49(m,1 H),7.90(m,1 H),7.51~7.59(m,3H),2.43(s,3H)。
1.2.4 N-(2-甲基-5-氨基苯基)-4-(3-吡啶基)嘧啶-2-胺(化合物6)
将化合物5(5 g,0.016 3 mol)悬浮于50 m L无水乙醇中,加入12.2 m L水合肼(体积分数为80%),0.5 g的FeCl3·6 H2O和0.5 g活性炭,加热回流至反应完全,停止反应,趁热过滤,将滤液旋干,得到淡黄色固体化合物6(3.9 g,收率为86.5%)。HPLC检测值为99.40%,熔点为141.8~142.9℃(文献[6]中熔点为141~144℃,收率为61.5%)。1H NMR (DMSO-d6):9.42(s,1 H),8.69(d d,J=6.0 Hz,1 H),8.66(s,1H),8.46(dd,J=5.0 Hz,1H),8.39~8.41(m,1H),7.52~7.54(m,1H),7.36(dd,J=5.5 Hz,1 H),6.86(d,J=8.5 Hz,1 H),6.78(s,1H),6.33(m,1 H),4.84(s,2 H,Ph—NH2),2.06(s,3H,Ph—CH3)。
1.2.5 4-[(4-甲基-1-哌嗪基)甲基]-N-[4-甲基-3-[4-(3-吡啶基)-2-嘧啶基]氨基]-苯基]苯甲酰胺(化合物8)
将4-[(4-甲基-1-哌嗪基)甲基]苯甲酸二盐酸盐(5.0 g,0.016 3 mol)溶于25 m L吡啶中,在2 min内滴加1.6 m L的SOCl2,然后加热至45℃反应1 h。冰浴冷却至0℃,在0℃下加入化合物6(3.47 g,0.012 5 mol),然后在30℃下反应3 h,加入15 m L水,加入50 m L质量分数为10%的氢氧化钠溶液,将p H值调节至10~11。然后加入150 m L水,室温析晶,经过滤、洗涤、干燥,得到类白色粉末化合物7(5.6 g,收率为90.61%)。HPLC检测值为99.23%,熔点为200.4~201.3℃(文献[6]中熔点为202~206℃,文献[5]中收率为90.0%)。1H NMR (DMSO-d6):10.15(s,1 H,Ph—NH—COPh),9.27(s,1 H),8.95(s,1 H),8.68(dd,J=6.5 Hz,1H),8.51(dd,J=8.5 Hz,1H),8.46~8.48(m,1H),8.07(s,1H),7.90(d d,J=8.5 Hz,2 H),7.42~7.53(m,5 H),7.20(d d,J=8.5 Hz,1 H),3.52(s,2 H,Ph—CH2—N),2.36~2.50(m,8H,4CH2),2.22(s,3H,Ph—CH3),2.15(s,3H,N—CH3)。
1.2.6 甲磺酸伊马替尼(化合物1)
将化合物8(2 g,0.004 mol)悬浮于25 m L异丙醇中,加热至回流,滴加甲磺酸的异丙醇溶液(0.26 m L,0.004 mol),继续回流反应30 min,停止加热,冷却至45℃,经过滤、洗涤、干燥,即得化合物1(2.10 g,收率为87.87%)。HPLC检测值为99.75%,文献[8]中的收率为71.0%。
2 结果与讨论
1)在合成化合物3时,用沸点较高的异丙醇为溶剂,适当提高反应温度,不但可以缩短反应时间,还可以提高反应收率。此外,反应没有采取文献中在高温下加入浓硝酸使产品以硝酸盐的形式析出。而是在反应后处理时调节反应液的p H值,使产物以游离碱的形式直接析出。这不但可以提高产物的纯度,同时可以避免下一步环合反应中加入氢氧化钠中和其中的硝酸,使环合反应在近中性条件下进行,可以避免更多副反应的发生。
2)在合成化合物5时,用FeCl3·6H2O/活性炭体系还原硝基替代昂贵的金属钯/碳,极大降低了生产成本,同时减少了生产过程中的危险性。
3)在合成甲磺酸伊马替尼时,采取“一锅煮”的方法,简化了许多繁琐的操作与分离过程,减少了损失,从而提高了收率,节约了成本。
4)采用经过改进与优化的合成工艺制备甲磺酸伊马替尼,反应中所使用的溶剂原料价廉易得,反应过程及后处理都十分简单,反应的总收率较文献[7]报道的33.54%要高,为41.9%以上,且纯度可达99.75%(HPLC)。
[1] HUANG A,LIU X,MAZKERET-BATIA L Z,et al.Process for Preparing Imatinib[P].US:7507821,2009-03-24.
[2] WOJCIECH S,WOJCIECH L,LUKASZ K,et al.A Process for Preparation of Imatinib Base[P].WO:2006071130,2005-03-12.
[3] ZIMMERMANN J D,GIVEN N N.Pyrimidine Derivatives and Process for Their Preparation[P].EP:0564409,1993-10-07.
[4] RAJENDRA N K,DHARMARAJ R R.A Process of Preparation Imatinib and Imatinib Prepared Thereby[P].WO:2004074502,2004-02-09.
[5] GENTILINO P M,BALERNA P R.Process for the Preparation of Imatinib[P].US:20080103305,2008-05-01.
[6] AMALA K,ADIBHATLA B R,NANNAPANENI V C.Process for the Preparation of the Anti-cancer Drug Imatinib and Its Analogues[P].WO:2004108699,2004-12-16.
[7] 李铭东,李 东,吉 民.甲磺酸伊马替尼的合成[J].中国药学杂志(Chinese Pharmaceutical Journal),2008,43(3):228-229.
[8] AMALA K K,BHUJANGA R A,KHADGAPATHI P,et al.Polymorphic Forms of Imatinib Mesylate[P].WO:200605431,2006-05-26.
[9] 安 静,李雪艳.头孢美唑合成方法研究[J].河北科技大学学报(Journal of Hebei University of Science and Technology),2006,27(4):288-293.
[10] 姚 军,张 显,王颖明,等.手性药物富马酸比索洛尔的合成研究[J].河北科技大学学报(Journal of Hebei University of Science and Technology),2010,31(3):317-320.
Synthesis of imatinib mesylate
CHEN Ling-juan1,2,ZHOU He-ping1,HUANG Wen-feng1,YAN Ming2,YAO Jun2
(1.Research and Development Center,Chongqing Lummy Pharmaceutical Company Limited,Chongqing 401120,China;2.College of Chemical and Pharmaceutical Engineering,Hebei University of Science and Technology,Shijiazhuang Hebei 050018,China)
Imatinib mesylate is prepared through addition,cyclization,reduction and acylation,with 2-methyl-5-nitroaniline as the starting material.The processes are improved.The total yield is 41.9%and the purity of the final product reaches 99.75%(by HPLC).
imatinib mesylate;2-methyl-5-nitroaniline;synthesis
R914.5
A
1008-1542(2011)05-0492-04
2011-06-17;
2011-09-06;责任编辑:张士莹
陈灵娟(1985-),女,河北保定人,硕士研究生,主要从事药物及中间体工艺方面的研究。
姚 军教授。E-mail:twobrght@163.com

