远海梭子蟹胚胎发育观察
廖永岩, 李 锋, 董学兴
(1. 广东海洋大学 水产学院, 广东 湛江 524025; 2. 盐城工学院, 江苏 盐城 224003)
远海梭子蟹胚胎发育观察
廖永岩1,*, 李 锋1, 董学兴2
(1.广东海洋大学 水产学院,广东 湛江524025; 2.盐城工学院,江苏 盐城224003)
在水温25~26 ℃、盐度30和 pH 7.8~8.4条件下, 观察远海梭子蟹胚胎发育全过程, 其结果发现, 远海梭子蟹胚胎发育经历卵裂、囊胚、原肠胚、无节幼体、后无节幼体和原溞状幼体等六个阶段。远海梭子蟹卵排出约28 h开始表面卵裂,约40 h,形成囊胚,约60 h,预定内胚层细胞出现, 并与集中在其周围的细胞一起内陷,形成原肠胚。约90 h, 3对附肢的无节幼体出现,约110 h,5对附肢的后无节幼体出现,约140 h, 7对附肢的原溞状幼体出现。复眼、心跳、色素形成均在原溞状幼体阶段完成。原溞状幼体孵出时(约300 h), 颚足长出羽状刚毛, 变为溞状幼体。整个胚胎发育过程约300 h。
远海梭子蟹; 胚胎发育; 形态学
蟹类的胚胎发育是蟹类生活史中最复杂的阶段(Sánchez et al, 2005), 因而是蟹类研究的重要领域之一(Sánchez et al, 2005; Petersen & Anger, 1997; Giménez, 2002; Webb et al, 2006)。胚胎发育的形态学观察, 是研究蟹类胚胎发育过程中组织、器官和系统形成的基础。有关青蟹(Scylla serrata)(Wei & Luo, 1986)、中华绒螯蟹(Eriocheir sinensis)(Du et al, 1992)、三疣梭子蟹(Portunus trituberculatus)(Xue et al, 1998; Xue et al, 2001a; Xue et al, 2003)、地中海溪蟹(Potamon edulis)(Pace et al, 1976)、毛刺蟹属的Pilumnus novaezealandiae和P. lumpinus(Wear, 1967)等蟹类的胚胎, 均有详细的形态描述。远海梭子蟹(Portunus pelagicus)隶属于节肢动物门(Arthropoda),甲壳亚门(Crustacea)软甲纲(Malacostraca)(Liu &Zheng, 2009)十足目(Decapoda)腹胚亚目(Pleocyemata)梭子蟹科(Portunidae)梭子蟹属(Portunus) (Li et al, 2007)。此蟹俗称花蟹、蓝蟹、沙蟹, 分布于西太平洋−印度洋海域;个体大、生长快, 是重要的食用经济蟹类(Bryars, 2006; Liao, 2011), 也是西太平洋−印度洋最适于养殖的四大重要经济蟹类之一(Williams & Primavera, 2001);但是,有关远海梭子蟹胚胎方面的研究, 除报道过抗真菌药对远海梭子蟹胚胎的影响外(Liao & Zhao, 2001),其胚胎发育的形态观察方面尚未有报道。本实验详细观察了远海梭子蟹的胚胎发育过程, 可为远海梭子蟹的人工繁育提供理论依据, 并可为蟹类胚胎发育的进一步研究提供基础资料。
1 材料与方法
1.1 材料
1.1.1 亲蟹 亲蟹购自湛江东风市场。体重80~120 g, 附肢齐全, 活力强, 无病, 无寄生生物, 性腺发育良好。亲蟹带水、充气运至实验室。
1.1.2 海水 海水取自湛江海域, 沙滤后再经400目纱绢网过滤, 用曝气自来水和海水晶调盐度至30待用, pH 7.8~8.4。
1.1.3 培养池及材料 培养池为试验室内铺瓷砖水泥池, 规格为1×1×0.8 m3。培养池用水清洗后, 再用20 mg/L高锰酸钾浸泡消毒6 h, 冲洗干净备用。池底铺细沙, 粒径0.1~0.2 mm, 先用水浸泡, 浮选出杂质, 再用20 mg/L高锰酸钾浸泡消毒, 洗净备用。自动控温采用HQ908加热棒, 功率为300 W。气泵采用山本-6500型。
1.1.4 饵料 购自湛江东风市场的新鲜牡蛎肉作为亲蟹培育用饵料。
1.2 方法
1.2.1 亲蟹的培育 培养池底部铺沙约5 cm, 占整个面积的80%, 出水口用砖挡住留为空档, 加海水约30 cm, 2支加热棒控温, 气泵连续充气, 溶解氧4 mg/L。挑选10只性腺发育良好的雌蟹放入池中进行培育, 水温初时为12 ℃, 缓缓加温,半个月后, 加温至目标温度(25~26 ℃)。亲蟹培育温度为(25.5±0.5) ℃。1天投饵2次, 分别为8:00—9:00和20:00—21:00。投饵量为亲蟹体重5%~10%, 8:00—9:00投饵,占总饵量20%~30%;20:00—21:00投饵量,占总饵量70%~80%。视水质情况决定换水与否。换水时先预热水温, 使其温差小于1 ℃。
1.2.2 亲蟹及抱卵蟹的观察 检查亲蟹的产卵情况, 检查次数视蟹行为而定, 无产卵行为时每天检查2次, 有产卵行为出现时, 每小时检查1次。
1.2.3 胚胎发育的观察 进行胚胎发育观察时, 用镊子取少量卵, 于解剖镜或显微镜下观察其胚胎发育情况, 受精卵卵裂前期、卵裂期4 h观察一次, 囊胚期以后8 h观察一次。将观察到的胚胎形态, 利用描绘镜绘出模式图。
2 结 果
2.1 亲蟹及抱卵蟹培育
经约20 d的培养, 相继有6只亲蟹抱卵, 抱卵率达60%。亲蟹约在凌晨4:00—6:00产卵。亲蟹产卵时, 不再卧于池底或钻入沙内, 而趋于沙少较硬的底质, 排出的卵附着在腹肢刚毛上。卵团颜色随发育期而变(表1)。

表1 远海梭子蟹受精卵和胚胎发育过程中抱卵蟹卵团的颜色变化Tab. 1 The color variation of egg mass during the fertilized eggs and embryonic developmental stages of Portunus pelagicus
2.2 远海梭子蟹胚胎发育观察
雌蟹产卵时, 受精卵借次级卵膜固着在腹肢刚毛上, 结集成葡萄状卵团。卵刚产出时为均质状,数小时后发生变化, 卵黄颗粒逐渐变大。受精卵产出后并不立即进行卵裂, 而存在一个约28 h的卵裂前期(水温25~26 ℃)。
2.2.1 卵裂(cleavage) 当水温25~26 ℃时, 卵产出约28 h后, 受精卵行第一次卵裂。远海梭子蟹的卵为富含卵黄的中黄卵, 其受精卵的卵裂方式为不完全卵裂中的表面卵裂。第一次卵裂沟偏向一极,卵裂沟为不规则曲线状(图1:1), 第一次卵裂在外表上将受精卵分成不相等的两部分, 其中植物极部分卵黄颗粒清晰, 颜色较亮; 动物极颜色较灰暗。第二次卵裂发生在第一次卵裂后约2 h(图1:2)。至16细胞期, 卵表面呈足球状(图1:3)。卵产出约40 h,卵裂进入256细胞期(图1:4), 胚胎发育至囊胚期。
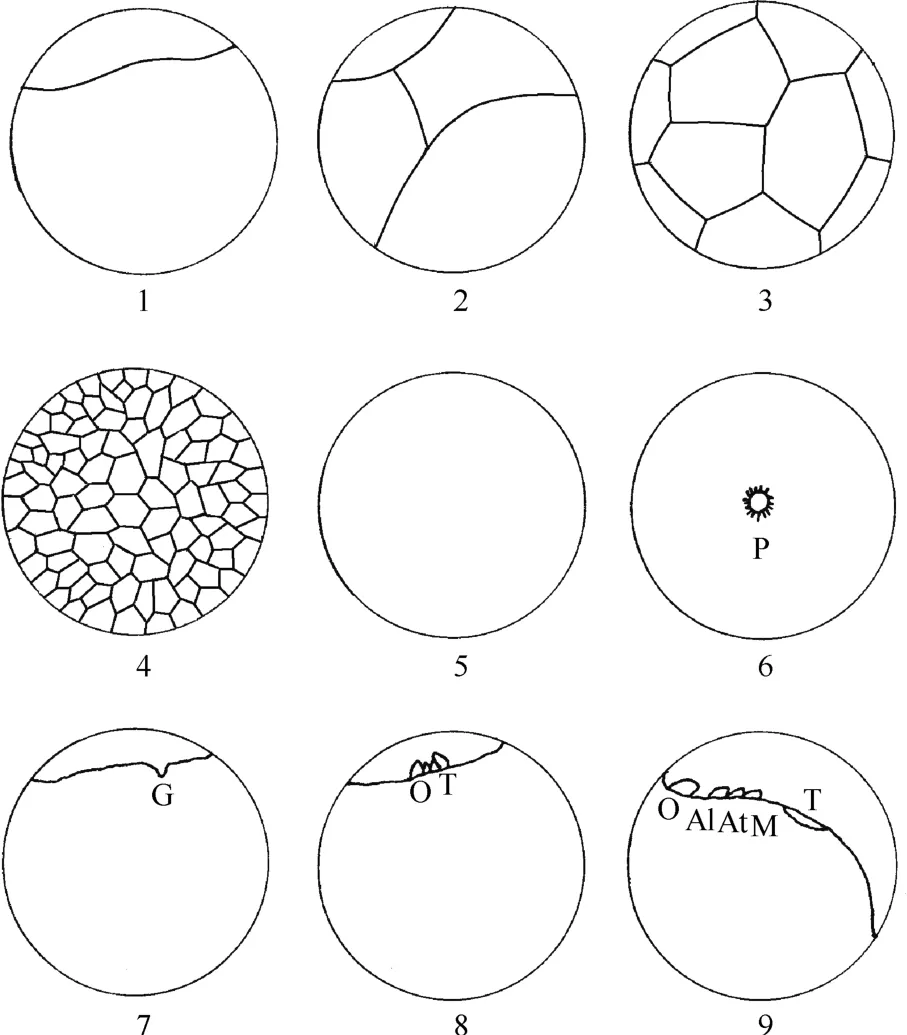
图1 远海梭子蟹卵裂到无节幼体模式图Fig. 1 Embryonic development of Portunus pelagicus from the cleavage to nauplius stage
2.2.2 囊胚(Blastula) 囊胚期卵表面呈均匀、致密状态, 卵裂沟及卵裂块消失, 看不出任何块状结构(图1:5)。卵裂产生的细胞排列在胚胎周围, 组成一层薄的囊胚层, 而囊胚层下的囊胚腔则全被卵黄颗粒所填充, 后构成卵黄囊。边围的囊胚层和居中的卵黄共同构成边围囊胚(或叫表裂囊胚)。囊胚后期, 出现独立、完整的细胞。整个囊胚期持续约20 h。
2.2.3 原肠胚(Gastrula) 当水温25~26 ℃时, 受精卵排出体外约60 h后, 卵的一端的卵黄被吸收,出现一呈透明状区域, 卵黄颗粒不明显, 胚胎进入原肠胚期。呈透明状的原肠作用部位, 周围具数个锥状突起, 即预定内胚层细胞(presumptive endoderm), 预定内胚层细胞排成一圈呈倒喇叭状(图1:6), 其它部位的细胞逐渐向此处集中。
预定内胚层细胞与集中过来的细胞一起内陷形成原肠和原口(图1:7)。原肠的形成, 确立胚胎发育的纵轴。随胚胎的发育, 胚区细胞不断地分裂,产生4个相距较近的细胞团突起, 即上部的2个视叶原基和近原口处的2个胸腹原基(图1:8)。在头部附肢原基发生前, 1对胸腹原基逐渐愈合, 形成胸腹突。随着胚胎的发育, 胸腹突逐渐增大使得卵黄囊形态似马鞍状。在视叶与胸腹突之间, 大颚原基首先发生, 随后, 大触角原基在大颚原基与视叶原基之间出现。至此, 胚胎外观突起共有4对原基:1对视叶原基、1对大触角原基、1对小触角原基、1对大颚原基及愈合的胸腹突。随着小触角原基在大触角原基与视叶原基间发生, 胚胎进入无节幼体期(图1:9)。
2.2.4 无节幼体(nauplius) 当水温25~26 ℃时,受精卵排出后约90 h, 小触角原基在大触角原基与视叶原基间形成。小触角、大触角及大颚3对附肢原基形成, 标志着胚胎发育进入无节幼体阶段(图1:9)。视叶原基、小触角原基、大触角原基及大颚原基随细胞分裂不断增大, 分别形成视叶、小触角、大触角及大颚。
2.2.5 后无节幼体(metanauplius) 当水温25~26 ℃时, 胚胎发育约110 h, 进入后无节幼体阶段。大颚之后, 胸腹原基前部外侧先后出现2 对附肢原基, 不久即发育为2 对小颚的肢芽, 即第一小颚和第二小颚; 此时胚胎共形成了5 对附肢, 透明区明显增大; 后无节幼体后期(约136 h), 胚前开始出现一整块明亮区, 此处大量卵黄物质被快速吸收转化(图2:10)。又一轮大规模的物质和能量转化已经完成, 预示着胚胎(特别是前部)紧接着将进行一段更为复杂的发育过程。
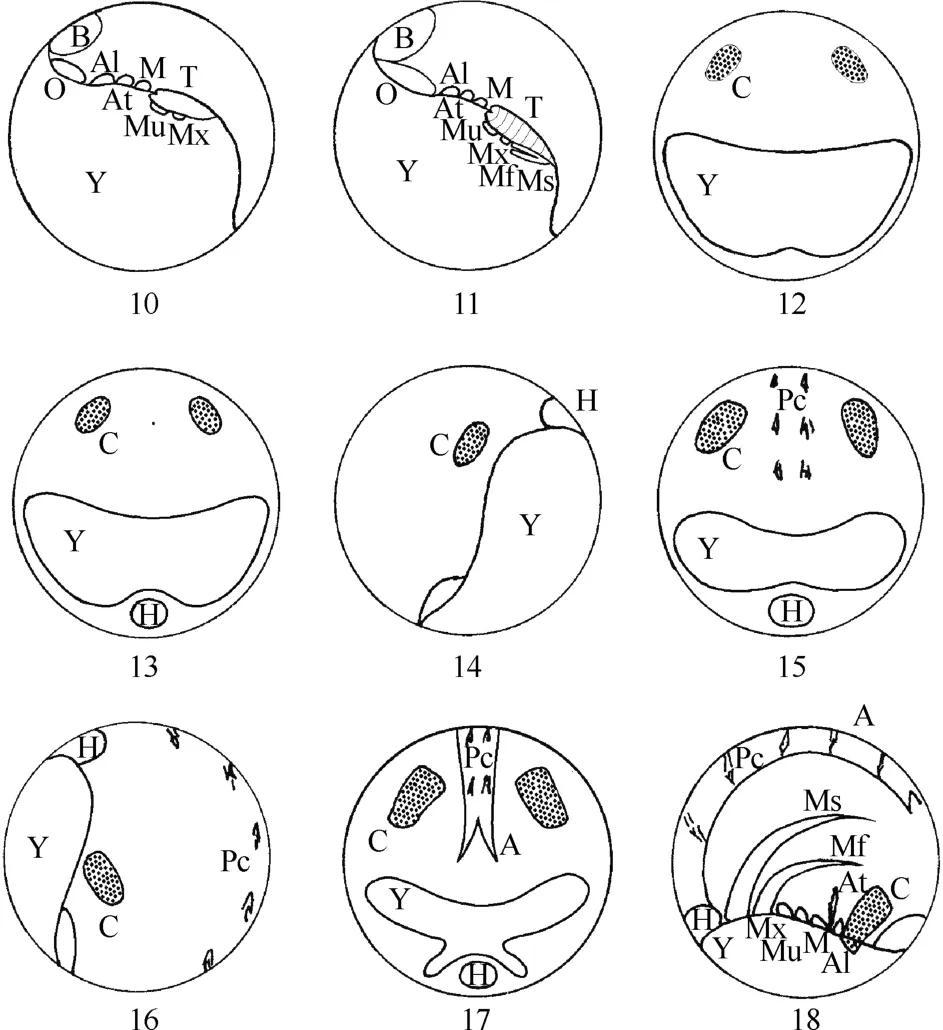
图2 远海梭子蟹后无节幼体及原溞状幼体模式图Fig. 2 Embryonic development of Portunus pelagicus from the metanauplius to protozoea stage
2.2.6 原溞状幼体(protozoea) 当水温25~26 ℃时, 胚胎发育约140 h, 进入原溞状幼体阶段。2 对小颚后面, 胸腹原基后部外侧又先后长出2 对颚足肢芽, 内侧为第二颚足, 外侧为第一颚足; 此时胚胎共形成了7 对附肢, 身体明显可见分节(图2:11)。腹部已很明显, 长而分节, 包括尾节在内, 明显地分6节。头胸甲原基不断生长, 左右相连, 成为头胸甲。复眼刚出现时为排列成弧形的数列短棒状结构(图2:12), 随着胚胎发育逐渐演变成椭圆形(图2:13), 在孵化前呈斜楔形(图2:18), 颜色也由淡红、紫红逐渐转变为紫黑色。胚胎发育经过180 h后, 开始形成囊状心脏(图2:13,14), 随后出现心跳。最初的心跳不稳定且没有规律, 表现为连续跳动几下后间歇一段长的时间, 或是间歇不等的博动,频率约为20~30 次/min。在心跳形成10 h后, 色素细胞开始形成(图2:15,16)。到色素细胞形成时胚胎心跳也明显加快, 为80次/ min。胚胎心跳到孵化前达150~180 次/min。随着胚胎的发育, 卵黄逐渐被吸收, 至后期, 卵黄囊呈蝴蝶状(图2:17), 卵黄颗粒大而清晰。至孵化前各部分相当清楚, 卵黄囊被分割成三团。附肢7对, 为小触角、大触角、大颚、第一小颚、第二小颚、第一颚足、第二颚足(图2:18)。孵化前的卵径为原卵径的1.5倍。原溞状幼体经过一次蜕皮(孵化)后, 2 对颚足上分别长出4根长羽状刚毛, 形成(第一期)溞状幼体孵出。
远海梭子蟹受精卵排出体外后, 经过约300 h [水温(25.5±0.5) ℃, 盐度30, pH 7.8~8.4], 孵出第一期溞状幼体, 胚胎发育过程中各项时间见表2。
3 讨 论
3.1 蟹类胚胎发育的分期
已有的资料对蟹类胚胎发育的分期不统一, 毛刺蟹胚胎发育分为3期(Wear, 1967); 地中海溪蟹胚胎发育分为4期(Pace et al, 1976); 三疣梭子蟹胚胎发育分为6期(Xue et al, 1998)或9期(Xue et al, 1998; Xue et al, 2001b); 中华绒螯蟹的胚胎发育分为6期(Du et al, 1992); 青蟹(Scylla serrata)的胚胎发育分为8期(Wei & Luo, 1986); 牧人魁蟹(Chionoecetes opilio)的胚胎发育则被分为10期以上(Moriyasu & Lanteigne 1998)。由于分期杂, 标准不统一, 导致很多研究者在进行蟹类胚胎研究时无所适从, 只能将蟹类的胚胎简单地分为胚胎早期和胚胎晚期(Sánchez et al, 2005); 或粗略的根据蟹胚胎表面颜色变化, 将其分为亮橙色期(light orange)、暗橙色期(dark orange)、黑色期(black)和孵化期(hatched egg stage)等4期(Moriyasu & Lanteigne,1998)。

表2 远海梭子蟹在25~26℃胚胎发育各期所需时间Tab. 2 The comparison of embryonic development time of Portunus pelagicus under 25−26℃ condition
十足目甲壳动物的胚胎或胚后期, 常出现无节幼体、后无节幼体、原溞状幼体、溞状幼体、糠虾幼体或后溞状幼体、十足幼体等幼体期(Du, 1987; Schram , 1986; Anderson, 1982)。这说明, 无节幼体、后无节幼体、原溞状幼体、溞状幼体等幼体期, 分别代表着一种重要的甲壳动物幼体阶段。加上学术界公认的卵裂、囊胚、原肠胚等胚胎发育期, 比较合理的蟹类胚胎发育过程应包括卵裂(cleavage)、囊胚(blastula)、原肠胚(gastrula)、无节幼体(nauplius)、后无节幼体(metanauplius)、原溞状幼体(protozoea)等6个发育期。本文的远海梭子蟹胚胎发育, 按以上6个阶段进行分期。
3.2 蟹类胚胎发育过程中的颜色变化及识别
蟹类的胚胎发育过程中, 随着胚胎的不断发育,其色素也发生相应的变化。刚产出的卵裂前的受精卵, 颜色较浅, 较为鲜艳, 为橙黄色(卵裂前的受精卵状态)。一旦受精卵卵裂, 胚胎从外观上看颜色转暗, 其在附肢出现前, 大多为土黄色(卵裂-原肠胚)。胚胎发育至附肢分化期(无节幼体-后无节幼期),颜色转灰。当胚胎发育至原溞状幼体, 由于眼色素的出现, 使整个胚胎发育转深灰或黑, 心跳出现并逐渐加快, 表示蟹胚胎将要孵化(表1)。所以, 当条件限制, 没有相关设备, 不能准确区分蟹胚胎发育期时, 根据胚胎的外部颜色变化, 也可对蟹类的胚胎发育期进行粗略识别(Moriyasu & Lanteigne, 1998)。
3.3 梭子蟹科重要蟹类胚胎发育的比较
远海梭子蟹、三疣梭子蟹和锯缘青蟹同属梭子蟹科(Portunidae), 其中远海梭子蟹和三疣梭子蟹同属梭子蟹属(Portunus), 其胚胎发育过程基本相似,但由于种、属区别, 其胚胎发育过程也存在差异。其具体情况如表3。

表3 梭子蟹科三种蟹胚胎发育差异比较特征Tab. 3 Characteristic comparison in embryonic development among three species Portuniade
从表3的结果可以看出, 梭子蟹科这三种蟹除胚胎发育分期差别较大外, 胚胎发育本身差别不大,只存在一些种、属间的区别。三疣梭子蟹为温水性蟹类, 锯缘青蟹、远海梭子蟹为暖水性蟹类, 其胚胎发育在水温适应性上有其各自的范围。
Anderson DT 1982.Embryology[C]//Abele LG. eds. The biology of crustacea: Vol. 2. Embryology, Morphology and Genetics. New York: Academic Press, 1-41.
Bryars SR, Havenhand JN. 2006. Effects of constant and varying temperatures on the development of blue swimmer crab (Portunus pelagicus) larvae: Laboratory observations and field predictions for temperate coastal waters [J]. J Exp Mar Biol Ecol,329(2): 218-229.
Du NS. 1987. Carcinology [M]. Beijing: Science Press. 1-945. [堵南山. 1987.甲壳动物学[M].北京:科学出版社, 1-945.]
Du NS, Zhao YL, Lai W. 1992. A study on the embryonic development of the Chinese mitten-handed crab, Eriocheir sinensis (Crustacea: Decapoda) [C]//Transactions of the Chinese Crustacean Society : No. 3. Qingdao: Qidao Ocean University Press. 128-135. [堵南山,赵云龙,赖伟. 1992.中华绒螯蟹胚胎发育的研究[C]//甲壳动物学论文集(第三辑),青岛:青岛海洋大学出版社, 128-135.]
Giménez L. 2002. Effects of prehatching salinity and initial larval biomass on survival and duration of development in the zoea 1 of the estuarine crab, Chasmagnathus granulata, under nutritional stress [J]. J Exp Mar Biol Ecol,270(1): 93-110
Liao YY, Wang HH, Lin ZG. 2011. Effect of ammonia and nitrite on vigour, survival rate, moulting rate of the blue swimming crab Portunus pelagicus zoea[J]. Aquacul Int,19(2): 339-350.
Liao YY, Zhao LM. 2001. Hatching and larval culture of in vitro embryo of Portunus pelagicus under anti-fungus [J]. J Oceanogr Taiwan Strait, 2001,20(3): 363-370. [廖永岩,赵丽梅. 2001.抗真菌药物对远海梭子蟹离体胚胎(卵)孵化及幼体培育的影响.台湾海峡,20(3): 363-370.]
Liu LY, Zheng GM. 2009. Zoology [M]. 4 ed. Beijing: Higher EducationPress. 69-302. [刘凌云,郑光美. 2009.普通动物学[M]. 4版.北京:高等教育出版社, 69-302.]
Li XZ, Liu RY, Liang XQ. 2007. Fauna Sinica--Invertebrates: volume 14, Subphylum Crustacea, Decapoda, Palaemonoidea [M]. Beijing: Science Press, 1-381. [李新正,刘瑞玉,梁象秋. 2007.中国动物志——无脊椎动物:第四十四卷,甲壳动物亚门,十足目,长臂虾总科[M].北京:科学出版社. 1-381.]
Moriyasu M, Lanteigne C. 1998. Embryo development and reproductive cycle in the snow crab, Chionoecetes opilio (Crustacea: Majidae), in the southern Gulf of St. Lawrence, Canada [J]. Can J Zool,76(11): 2040-2048.
Pace F, Harris RR, Jaccarini V. 1976. The embryonic development of the Mediterranean freshwater crab, Potamon edulis (P. fluviatile) (Crustacea, Decapoda, Potamonidce) [J]. J Zool,180(1): 93-106.
Petersen S, Anger K. 1997. Chemical and physiological changes during the embryonic development of the spider crab, Hyas araneus L. (Decapoda: Majidae) [J]. Comp Biochem Physiol,117B(2): 299–306
Sánchez MV, Cahansky AV, Greco LSL, Rodríguez EM 2005. Toxicity of mercury during the embryonic development of Chasmagnathus granulatus (Brachyura, Varunidae) [J]. Environ Res,99(1): 72-78
Wear RG. 1967. Life-history studies on New Zealand Brachyura 1. Embryonic and post-embryonic development of Pilumnus novaezealandiae Filhol, 1886, and of P. Lumpinus Bennett, 1964 (Xanthidae, Pilumninae) [J]. New Zeal J Mar Fresh Res,1(4): 482-535.
Webb JB, Eckert GL, Shirley TC, Tamone SL. 2006. Changes in zoeae ofthe snow crab, Chionoecetes opilio, with variation in incubation temperature [J]. J Exp Mar Biol Ecol,339(1): 96–103
Wei SQ, Luo YY. 1986. A study of the embryonic development of Scylla serrata (Forskal) [J]. J Trop Oceanogr,5(3): 57-62. [韦受庆,罗远裕. 1986.青蟹胚胎发育的研究.热带海洋,5(3):57-62.]
Williams MJ, Primavera JH. 2001. Choosing tropical Portunid species for culture, domestication and stock enhancement in the Indo-Pacific[J]. Asian Fish Sci,14(2): 121-142
Xue JZ, Du NS, Lai W. 1998. Studies on the embryonic development of Portunus trituberculatus [J]. Chn J Zool,33(6): 45-48. [薛俊增,堵南山,赖伟. 1998.三疣梭子蟹活体胚胎发育的观察.动物学杂志,33(6): 45-48.]
Xue JZ, Du NS, Lai W. 2001a. Studies on the histology of early embryonic development of Portunus trituberculatus [J]. Zool Res,22(1): 69-73. [薛俊增,堵南山,赖伟. 2001.三疣梭子蟹胚胎发育早期的组织学研究.动物学研究,22(1): 69-73.]
Xue JZ, Du NS, Lai W. 2001b. Morphology of egg larvae of swimming crab (Portunus trituberculatus) during embryonic development [J]. Acta Zool Sin,47(4): 447-452. [薛俊增,堵南山,赖伟. 2001.三疣梭子蟹胚胎发育过程中卵内幼体形态.动物学报,47(4): 447-452.]
Xue JZ, Wu HX, Fang LH. 2003. Morphology of gonad in embryos of swimming crabs, Portunus trituberculatus [J]. Zool Res,24(4): 319-320. [薛俊增,吴惠仙,方李宏. 2003.三疣梭子蟹胚胎发育过程中生殖腺的形态.动物学研究,24(4): 319-320.]
External morphological characteristics during the embryonic development ofPortunus pelagicus
LIAO Yong-Yan1,*, LI Feng1, DONG Xue-Xing2
(1. College of Fisheries, Guangdong ocean university, Zhanjiang 524025, China; 2. Yancheng Institute of Technology, Yancheng 224003, China)
The embryonic development ofPortunus pelagicuswas studied under laboratory conditions at a water temperature of 25−26 ℃, salinity of 30, and pH of 7.8−8.4. The embryogenesis ofPortunus pelagicuswas divided into six stages: cleavage, blastula, gastrula, nauplius, metanauplius, and protozoea. Embryogenesis lasted about 300 h post spawning. Eggs began superficial cleavage about 28 h after spawning when the nucleus appeared at the surface of the egg till the egg divided into 16 cells. The blastula stage was observed about 40 h post spawning and gastrula stage appeared when the presumptive endoderm and other cells near them invaginated. The fourth-stage of embryogenesis, nauplius, was characterized by three pairs of appendages appearing about 90 h post spawning, while metanauplius, the fifth-stage of embryogenesis, was characterized by five pairs of appendages, which appeared about 110 h post spawning. The sixth stage of embryogenesis was protozoea, which was characterized by seven pairs of appendages appearing about 140 h post spawning. The compound eye, heart and pigment cells were also found in the protozoea stage. After the natatory seta formed on the top of maxilliped, the protozoea developed into the zoea at the time of hatching (about 300 h post spawning).
Portunus pelagicus; Embryonic development; Morphological character
Q959.223.630.4;Q133
A
0254-5853-(2011)06-0657-06
2011-07-04;接受日期:2011-08-05
广东省教育厅重点学科建设项目(0709162)
∗通讯作者(Corresponding author),E-mail: rock6783@126.com
廖永岩(1965-),男,副教授,研究方向:西太平洋-印度洋经济蟹类和鲎生物、生态学
10.3724/SP.J.1141.2011.06657
- Zoological Research的其它文章
- A phylogeny of the Tylototriton asperrimus group (Caudata: Salamandridae) based on a mitochondrial study: suggestions for a taxonomic revision
- 体细胞核移植生产绵羊转hALR基因囊胚
- 上海市南汇东滩围垦后海岸带湿地冬春季水鸟生境选择
- 杭州湾及钱塘江河口水鸟群落组成、季节动态及种间相关性分析
- 云南新平哀牢山西黑冠长臂猿分布与群体数量
- Histological and immunocytochemical study of deferens ducts in the Chinese rat snake (Zaocys dhumnades)

