野生兰科植物菌根内生真菌分离及鉴定
吴剑丙,朱江敏,白 坚,李玉婷,张克铭,王慧中
(杭州师范大学生命与环境科学学院,浙江杭州 310036)
野生兰科植物菌根内生真菌分离及鉴定
吴剑丙,朱江敏,白 坚,李玉婷,张克铭,王慧中*
(杭州师范大学生命与环境科学学院,浙江杭州 310036)
利用石蜡切片技术对实验室收集保存的25种野生兰科植物的菌根结构进行显微观察,并采用常规分离方法,对内生真菌进行分离及菌落形态和分子生物学鉴定.结果表明:实验室保存的兰科植物具有典型的菌根形态;从菌根中共分离获得82株真菌菌株,分属于镰孢属(FusariumLink)、毛壳属(ChaetomiumKunze ex Fr.)和木霉属(TrichodermaPersoon)等11属,其中镰孢属真菌占70.7%.
兰科植物;菌根;内生真菌;分离鉴定
兰科(Orchidaceae)是仅次于菊科的第二大科,广泛分布于全球各地,约有700属2万余种.我国有171属1 247种,包括许多著名的药用植物和珍贵花卉,如天麻、铁皮石斛、密花石斛、蕙兰、墨兰和蝴蝶兰等[1].其中,石斛属(Dendrobium)植物是目前临床应用和药理研究的重要材料,受到医学和生物学领域的密切关注[2].随着需求量的日益增加和天然资源的过度采挖,部分珍贵兰科种类已濒临灭绝.因此,研究推广兰科植物的人工栽培扩繁技术,对于保护珍稀品种、提高兰科植物产量具有重要意义.
目前,珍稀兰科植物的人工扩繁多采用实验室组织培养技术来进行.然而,组培苗温室移栽后又面临诸如移栽苗成活率低、生长发育速度缓慢、开花结果率低于原生态条件下的兰科植物等[3-9]新问题.究其原因,主要是由于兰科为菌根植物,在自然条件下与真菌形成共生关系[10].其中,菌根真菌能促进兰科植物种子萌发、提高植株对矿质元素的吸收能力、缩短生长周期、增强抗逆性,在兰科植物的生长和生命活动中起重要作用[11-13].同时,兰科植物为真菌的生存提供必要的环境和营养条件.而人工条件下进行兰科植物大规模扩繁,往往因缺少适宜共生菌根真菌的参与,致使种子萌发率极低、幼苗生长速度缓慢.因此,分离鉴定野生兰科植物菌根真菌,寻找有益真菌,将有助于提高珍稀兰科植物的人工栽培技术.该研究采用常规的平板分离方法,对实验室收集保存的25种野生兰科植物进行菌根内生真菌的分离、鉴定和种类研究,为兰科植物的快速繁殖和快速生长技术提供可靠的理论依据和有益的菌根真菌.
1 材料和方法
1.1 供试材料
25种野生兰科植物为杭州师范大学生命与环境科学学院生物化学与分子生物学杭州市重点实验室采集保存.
1.2 兰科植物菌根结构观察
取新鲜的兰科植物根若干段,采用石蜡切片法制片,番红固绿双重染色,中性树胶封片后,显微镜观察结构并拍照.
1.3 内生真菌的分离和纯化
取多年生老根及新鲜营养根根尖(4~5cm),表面泥沙经自来水冲洗干净后,用75%乙醇消毒60s.弃乙醇,加入0.1%升汞,灭菌5min后取出根尖,用无菌水冲洗3次.随后,在无菌条件下用解剖刀将材料横切成3~5mm的薄片,置于含链霉素(50μg/mL)的马铃薯葡萄糖琼脂培养基(PDA)上,切面朝向培养基.每个平板放置组织4~5块,25℃恒温避光培养.
待菌丝体从组织块中长出,形成一定大小的菌落,从其边缘挑取菌丝体转移至新鲜PDA平板,重复至获得纯培养物后,PDA斜面保存.
1.4 菌根内生真菌分子鉴定
1.4.1 总DNA提取与电泳检测
从平板上刮取约0.1g菌丝体置于研钵中,加入1mL裂解缓冲液(100mmol/L Tris-HCl、100mmol/L EDTA、400mmol/L NaCl和2%SDS)与少许石英砂,将菌丝充分研磨.液体转移至1.5mL离心管,并加入等体积氯仿/异戊醇(体积比为24∶1)抽提.高速离心后取上清液,加入2μL RNase(10mg/mL),37℃水浴保温30min.随后,用2倍体积无水乙醇沉淀DNA,并用70%乙醇洗涤2次,自然风干后溶于适量TE溶液,贮存于-20℃备用.
取3μL DNA样品用0.8%琼脂糖凝胶在1×TAE电泳缓冲液中进行电泳(100V,30min),溴化乙啶染色后,紫外灯下观察拍照.
1.4.2 PCR扩增
利用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增内生真菌rDNA ITS区段.
PCR反应体系为:10×Ex Taq Buffer(含Mg2+)2.5μL、模板DNA 2.0μL、dNTP(2.5mmol/L)1.5μL、ITS1(10μmol/L)1.5μL、ITS4(10μmol/L)1.5μL、Taq酶(2U/μL)0.2μL、灭菌ddH2O 15.8μL.
扩增程序为:96℃预变性2min;94℃变性45s、55℃退火45s、72℃延伸50s,35个反应循环;72℃延伸5min.
1.4.3 ITS序列测定
PCR扩增产物用DNA片段回收试剂盒(Axygen公司)回收后,连接到pMD18-T载体(TAKARA公司),转化感受态细胞E.coliDH-5α,选取阳性克隆进行序列测定(上海华大基因公司).
1.4.4 ITS序列数据分析
菌根内生真菌rDNA ITS1和ITS4序列的起止范围通过Blast比对并参照GenBank中已有兰科植物菌根真菌的ITS范围确定.
系统树的构建使用DNAMAN程序(Verion 5.2.2,Lynnon Biosoft,Quebe Canada)的邻接法(Neighbor-joining)进行,步差值为1 000次.系统树的水平距离与序列之间的距离成正比,垂直距离是任意的.
用于DNA序列比较的真菌ITS序列来自于GenBank,以Blast比较后同源性最高的序列为参考.序列(用分离物编号表示,括号内是该分离物的登录号)包括:JZ1(HQ113948),ED-3(HM043738),cy144(AM419074),HKU-543(DQ535186),F.S.0613(HM064429),GD507(DQ810187),ARSEF 1905(AF108467),Dis326h(DQ379015),IU-FSC(AB520295),UOA/HCPF 9860(GQ376100),S6A3(AJ509865),LH129(HQ832813),SS1(AF203451),02AB1a(DQ767599)和GMG PPb7(FJ439593).
同源性比较采用DNAStar分析软件(Version 7.0,Madison,Wis.,USA)的Clustal W方法进行.
2 结果与分析
2.1 兰科植物菌根结构分析
兰科植物的根由根被、皮层和中柱3部分组成.根被位于根的最外层,细胞排列紧密,纵切面为长柱形.皮层位于根被之内,由多层薄壁细胞组成,分为外皮层、皮层薄壁组织和内皮层.内皮层位于皮层最内侧,细胞排列整齐.中柱部分含有维管束,中央具髓.
受真菌侵入的兰科植物菌根外部能观察到明显的菌丝体(图1a).新鲜菌根外部(图1b)及根被部(图1c)有菌丝存在.而老根几乎100%被感染,根被破坏严重,菌丝深入中柱层(图1d),在整个根细胞中都布满菌丝团或消解的菌丝结.
2.2 真菌菌株分离结果
从25个兰花品种中分离获得内生真菌优势菌株,采用形态学方法,鉴定得到82株(见表1).不同兰科植株中分离到的部分内生真菌平板菌落形态见图2.
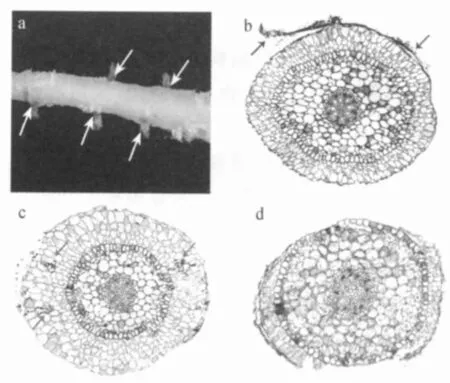
图1 野生兰科植物菌根形态显微结构Fig.1 Microstructure of wild orichid mycorrhiza

表1 不同种类兰科植物菌根分离获得菌株情况Tab.1 List of fungi isolated from orchid mycorrhiza

图2 菌落形态(a:F5;b:F7;c:F8;d:F30)Fig.2 Colony characteristics(a:F5;b:F7;c:F8;d:F30)
2.3 真菌ITS序列分析
转录间隔区ITS常用于系统发育分析,在进化上有一定的种属特异性.利用ITS序列特异性引物扩增得到内生真菌ITS rDNA部分片段,大小约为650~750bp.经序列测定后,提交Gen-Bank进行同源性比对,发现分离到的82个菌株分别属于镰孢属(FusariumLink)、柱孢属(CylindrocarponWollenw.)、轮枝孢属(VerticilliumNees.)、丛赤壳属(NectriaFr.)、木霉属(TrichodermaPersoon)、毛壳属(ChaetomiumKunze ex Fr.)、青霉属(PenicilliumLink)、链格孢属(AlternariaNees)、曲霉属(AspergillusLink)、棘壳属(Pyrenochaetade Not.)、匍柄霉属(StemphyliumWallr.)及未知真菌(表1).其中大部分菌株属于镰孢属,占全部真菌的70.7%.
选择几个形态特征明显的真菌的ITS序列进行进化分析,构建系统树,发现它们分别属于不同真菌.同源性比较发现,这部分真菌的ITS序列与相应参考序列的同源性均高于95.5%(图3).

图3 基于真菌ITS核苷酸序列构建的系统关系树及同源性比较Fig.3 Dendrograms showing the phylogenetic relationship among fungi based on multiple alignments of ITS sequences,and the percentage nucleotide sequence identities
3 讨 论
兰科植物既是观赏植物,又是珍贵的药用植物.浙江是兰花种植大省,其中石斛的开发和利用已走在全国前列.目前,有关兰科植物,特别是石斛的组培技术已经较为成熟,但如何提高组培苗的出瓶成活率,加强组培苗的环境适应性,尤其是加速幼苗生长、提高药效成分含量等问题仍值得关注.菌根是兰科植物与内生真菌形成的共生联合体,真菌在兰科植物的生长和生命活动中具有重要的作用.加强菌根中内生真菌的分离鉴定,筛选出有效菌株,对促进植株的保护、提高兰科植物人工栽培技术都具有重要作用.
该研究结果表明野生兰科植物根部细胞内存在大量真菌,形成典型的兰科菌根结构.通过真菌分离、菌落形态和分子生物学鉴定发现,实验室收集保存的兰科植物中的内生真菌来自不同的属,其中大多数真菌属于镰孢属.同时,分析发现,不同植物上分离到的真菌种类和数量不一致.在此基础上,笔者将进一步研究内生真菌及其不同组合对兰科植物组培苗生长的作用,以期筛选获得有益菌株,对兰科植物菌根真菌资源进行有效利用.
[1]吴应祥.中国兰花[M].北京:中国林业出版社,1993:5-10.
[2]马国祥,徐国钧,徐珞珊,等.商品石斛的调查与鉴定[J].中草药,1995,26(7):370-371.
[3]Martin K P,Madassery J.Rapid in vitro propagation ofDendrobiumhybridsthrough direct shoot formation from foliar explants and protocorm-like bodies[J].Scientia Horticulturae,2006,108(1):95-99.
[4]丁长春.齿瓣石斛的胚培养技术及其快速繁殖研究[J].热带农业科技,2004,27(3):10-11.
[5]陈之林,曾宋君,段俊.独角石斛的离体繁殖[J].植物生理学通讯,2004,40(3):342.
[6]傅玉兰,谷凤,胡传明,等.霍山石斛组培快繁技术研究[J].安徽农业科学,2004,32(3):522-523.
[7]詹忠根,徐程,张铭,等.铁皮石斛离体根尖经体细胞胚再生植株研究[J].浙江大学学报:农业与生命科学版,2005,31(5):579-580.
[8]谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1991:360-380.
[9]付志惠,李洪林,杨波.广东石斛的组织培养[J].植物生理学通讯,2005,41(4):491.
[10]Dearnaley J D W.Further advances in orchid mycorrhizal research[J].Mycorrhiza,2007,17(6):475-486.
[11]杨友联,刘作易.兰科菌根真菌在兰科植物生长发育中的作用与应用[J].种子,2005,24(5):55-59.
[12]潘超美,贺红,林群英,等.真菌诱导子对铁皮石斛组培物生长的影响[J].中医药学刊,2004,22(1):54-55.
[13]郭顺星,徐锦堂.真菌在罗河石斛和铁皮石斛种子萌发中的作用[J].中国医学科学院学报,1991,13(1):46-49.
Isolation and Identification of Endophytic Fungi in Wild Orchid Mycorrhiza
WU Jian-bing,ZHU Jiang-min,BAI Jian,LI Yu-ting,ZHANG Ke-ming,WANG Hui-zhong
(College of Life and Environmental Sciences,Hangzhou Normal University,Hangzhou 310036,China)
Using the way of paraffin section,the experiment observed the microstructures of mycorrhizas of 25kinds of wild orchids,which were collected and kept in the lab,and isolated the endophytic fungi,indentified colonial morphology by conventional isolation method.The results show that the orchids kept in the lab are the typical mycorrhizal plants.82 isolated fungi strains belong to 11genera,such asFusarium,Chaetomium,Trichoderma,etc,and about 70.7%of them belong toFusarium.
orchids;mycorhiza;endophytic fungus;isolation and identification
Q939.5
A
1674-232X(2011)03-0228-05
10.3969/j.issn.1674-232X.2011.03.008
2010-01-22
国家自然科学基金项目(30870180,31070298);浙江省重大科技专门项目(2008C12081);杭州市科技计划项目(20080432T06,20101032B25).
吴剑丙(1980—),女,浙江桐乡人,助理研究员,博士(后),主要从事植物与微生物互作机理研究.
*通信作者:王慧中(1962—),男,浙江义乌人,教授,博士,主要从事植物系统生物学研究.E-mail:whz62@163.com

