外来种加拿大一枝黄花与土著种芦苇根际土壤线虫群落比较
许湘琴,陆 强,林植华,陈慧丽
(杭州师范大学动物适应与进化杭州市重点实验室,浙江杭州 310036)
外来种加拿大一枝黄花与土著种芦苇根际土壤线虫群落比较
许湘琴,陆 强,林植华,陈慧丽*
(杭州师范大学动物适应与进化杭州市重点实验室,浙江杭州 310036)
为比较外来入侵种加拿大一枝黄花(SolidagocanadensisL.)与土著种芦苇(Phragmitesaustralis)根际土壤线虫多样性和群落结构的差异,笔者分别于2009年4月(出苗期)、9月(开花期)和12月(枯萎期)对杭州下沙加拿大一枝黄花群落及相邻芦苇群落的根际土壤线虫进行调查.结果显示:两种植物根际土壤线虫群落存在差异,并且这种差异与采样时间(植物生长阶段)有关.加拿大一枝黄花根际土壤的线虫数量、属丰富度和多样性在出苗期和开花期与芦苇根际没有显著差异,而在枯萎期则显著高于芦苇.加拿大一枝黄花根际土壤线虫营养多样性在三个生长阶段均显著高于芦苇.在出苗期和开花期加拿大一枝黄花根际植食性线虫比例明显低于芦苇根际,食真菌线虫比例则明显高于后者;在枯萎期,加拿大一枝黄花根际土壤线虫的食真菌线虫比例明显高于芦苇根际土壤,而食细菌线虫比例趋于降低.非参数多变量排序(MDS)表明,加拿大一枝黄花根际土壤线虫群落结构与芦苇在其三个生长阶段均差异明显,其中枯萎期差异最大.上述结果表明外来植物入侵在一定程度上改变了土壤线虫多样性、功能多样性和营养结构,这种改变可能导致土壤生态系统中营养源流向和路径发生变化,并促进外来植物进一步入侵.
植物入侵;加拿大一枝黄花;线虫;多样性;营养结构
外来植物入侵会影响土著生物群落的组成,从而使生态系统中的养分循环和能量流动发生变化[1-2],进而影响生态系统功能[3-4].加拿大一枝黄花(SolidagocanadensisL.)属菊科(Asteraceae)一枝黄花属(Solidago L.),原产于北美,于20世纪70年代作为花卉植物引入中国,最初栽培于上海、南京一带,后逸生野外[5],20世纪80年代蔓延到浙江.加拿大一枝黄花的繁殖和生存能力极强,极易成为优势种与其他物种竞争土壤、养分、水分和空间,逸生之处,从而引起其他物种退出以至消亡.目前国内外对于加拿大一枝黄花的研究主要针对其形态特征、生物学特性、生态学特性、化感作用、对地上植物群落的危害及其防治方式[6-7],关于其入侵对地下生物造成影响方面的研究很少.
随着对生态系统地下部分重要性认识的深入[8-9],越来越多的科学家开始重视了解外来植物入侵对土壤生物多样性及生态系统过程的影响[10-13].而线虫作为地下生物多样性中最丰富的后生动物,其研究应引起特别重视.这主要因为:线虫是土壤中的优势类群,种类繁多,数量巨大[14];线虫是碎屑食物网的重要组成部分,其食性多样,对于反映生态系统功能具有独特的优势[15];它们与植被关系密切,其多样性受到地上植物群落改变的直接影响[16-17],且被入侵地入侵植物和土著植物根际土壤中植食性线虫比例的变化有助于了解其成功入侵的机制[18].然而,目前有关植物入侵对线虫群落影响的研究还处于起步阶段,已有的报道也结论不一.因此,有必要对更多的植物入侵案例进行研究,以揭示植物入侵对地下生物多样性的影响规律.
该研究选取加拿大一枝黄花入侵严重的杭州下沙为研究地点.芦苇是该地区分布最广的土著优势植物之一,具有调节气候、净化污水、促淤防蚀、抑制藻类、防洪固堤、维持生物多样性等生态功能[19].笔者分别于出苗期、开花期和枯萎期比较土著优势芦苇(Phragmitesaustralis)群落和入侵种加拿大一枝黄花群落中的土壤线虫数量、多样性、营养类群组成和群落结构,探讨以下问题:(1)加拿大一枝黄花入侵是否对根际土壤线虫群落产生影响?(2)在加拿大一枝黄花不同生长阶段,其入侵对根际土壤线虫群落的影响是否存在差异?
1 材料与方法
1.1 研究地点
杭州下沙位于钱塘江下游北岸,自20世纪80年代以来该地区的芦苇优势群落逐渐被外来物种加拿大一枝黄花所入侵.加拿大一枝黄花的繁殖和生存能力极强,生长势旺,极易与芦苇等土著植物竞争土壤、养分、水分和空间,并发展成以一枝黄花为优势种的植物群落.该研究选取东经:120°22.551,北纬:30°16.789为采样点,在该采样点存在大片相邻正在发生竞争的加拿大一枝黄花群落和芦苇群落.
1.2 样品采集
于2009年4月下旬(出苗期),9月上旬(开花期)和12月下旬(枯萎期),在加拿大一枝黄花群落或芦苇群落中各设置4条长度为9m的样线,样线起点随机.在每条样线上,每隔1m在加拿大一枝黄花或者芦苇的主根旁边取一个土样(深10cm,直径2cm),然后把10个取自同一样线上的土柱混合均匀成为一个复合的样本,以减少土壤空间异质性对根际土壤线虫群落的影响.由此,在每个植物群落中获得4个混合土样,作为4个重复.混合土样经充分混匀后,分成3份:150g土样固定在4%的福尔马林中,用于线虫群落分析;80g土壤80℃烘干,以估算土壤含水量.在植物生长旺盛的9月,调查两种植物群落的植株密度、高度及生物量.调查时在每条线虫样线附近随机选取一个50×50cm的样方,计算样方内植物密度,随机选择6株加拿大一枝黄花或芦苇测量其高度,收割样方内植物的茎叶和收集地面凋落物,清洗后65℃烘干,以估算地上生物量和凋落物生物量.
1.3 线虫样品处理和分析
用LUDODX悬浮法分离得到线虫,并在解剖镜下对线虫进行计数,每个样品随机挑取100多条线虫在显微镜下进行分类鉴定到属水平.依据Yeates等[20]将线虫划分为食藻类线虫、植食性线虫、食细菌线虫、食真菌线虫、捕食性线虫和杂食性线虫6个食性类群.在属水平上计算线虫群落多样性指数(Shannon-Wiener diversity index,H’):H’=-∑PilnPi,式中Pi为属i的个体数占总个体的比例.在食性类群水平上计算营养多样性指数(Trophic diversity,TD):TD=1/∑Pi2,式中Pi为各营养类群在线虫群落中所占的比例.
1.4 数据分析与统计
该研究采用Statistica统计软件包(version 6.0,StatSoft Inc,Tulsa OK 74104USA)对环境参数及线虫群落特征进行双因子方差分析(two-way ANOVA),以检验植物类型和采样时间对土壤特性、植物群落特征、线虫数量、线虫多样性及各营养类群的影响,后续比较采用Tuckey多重比较检验.
对土壤线虫群落结构的分析采用非参数多变量分析方法[21].用双因子交叉相似性分析(two-way crossed,ANOSIM)和非参数多变量排序(non-metric multidimensional scaling,MDS)检验时间和植物群落类型对土壤线虫群落结构的影响.上述分析都由Primer软件(version 5.2)完成.
2 结 果
2.1 植物密度、高度和生物量
两种植物群落的植被特征与生物量如表1所示.加拿大一枝黄花的株高和植株密度均显著高于芦苇.加拿大一枝黄花群落单位面积生物量高达726g m-2,是芦苇群落的4倍以上.
2.2 土壤线虫的数量、组成和多样性
该研究共发现杭州下沙根际土壤线虫50属,隶属于6目35科,其中23个属为食细菌线虫属.双因子方差分析结果显示,植物类型显著影响线虫属丰富度和线虫多样性指数(表1).采样时间对根际土壤线虫属丰富度、线虫密度和线虫香农多样性指数均有着显著影响(表1).植物类型与时间的交互作用对线虫属丰富度、线虫密度有着显著影响,而对线虫香农多样性指数不存在显著影响(见表1).加拿大一枝黄花根际土壤的线虫数量、属丰富度和香农多样性在4月和9月与芦苇根际没有显著差异,而在12月则显著高于芦苇(图1a,1b,1c).
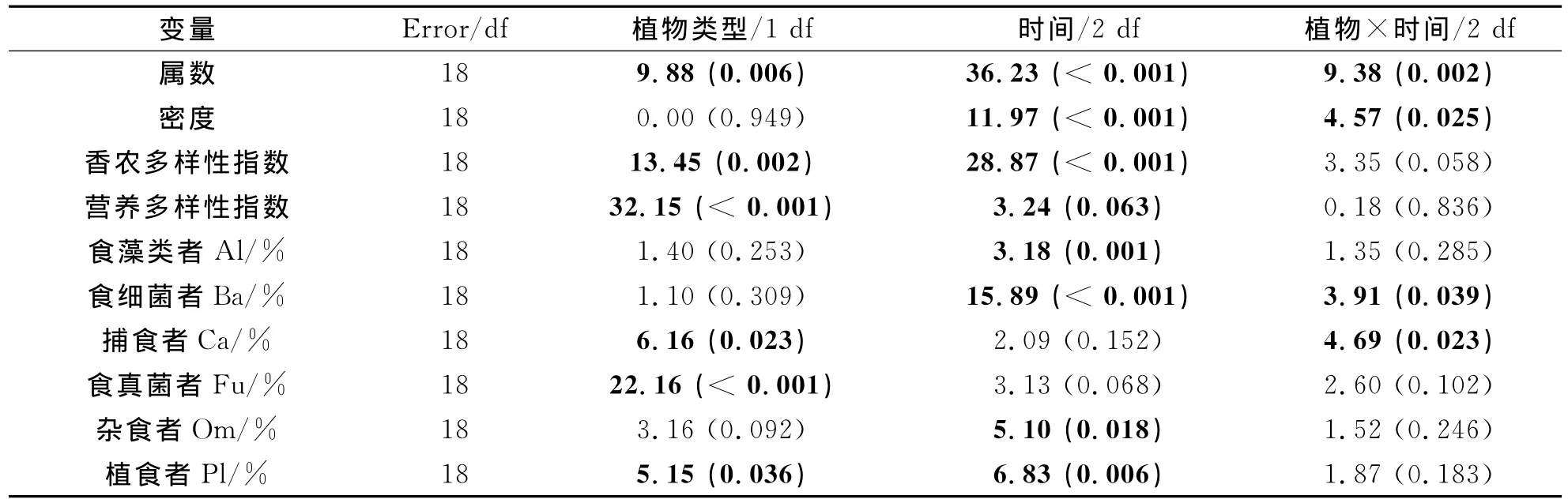
表1 土壤线虫的属数、密度、多样性指数及各营养类群百分比的双因子(植物种类和时间)方差分析结果Tab.1 Summary of two-way ANOVA for testing the effects of plant type and sampling time on soil nematode genus number,density,diversity indices and trophic group proportions
2.3 线虫的营养多样性和营养结构
植物类型和采样时间对线虫营养多样性均存在显著影响(p<0.05)(表1).在各采集时间,加拿大一枝黄花根际土壤线虫营养多样性均显著高于芦苇(图1d).植物类型对捕食性线虫、食真菌线虫和植食性线虫占根际土壤线虫总数量的比例存在显著影响,而对其它各线虫食性类群比例不存在显著影响(表1).采样时间对食藻类线虫、食细菌线虫、杂食性线虫和植食性线虫占根际土壤线虫总数量的比例存在显著影响,而对其它各线虫食性类群比例不存在显著影响(表1).各季节加拿大一枝黄花和芦苇典型植物群落中根际土壤线虫营养类群组成见图2.结果显示,无论在加拿大一枝黄花还是芦苇典型群落土壤中,植食性线虫和食细菌线虫都是根际土壤线虫群落的优势营养类群.芦苇根际植食性线虫比例在4月和9月明显高于加拿大一枝黄花,在12月差异不明显.两种植物间食细菌线虫比例在4月和9月差异不明显,但在12月芦苇根际土壤中食细菌线虫比例明显高于加拿大一枝黄花.在加拿大一枝黄花根际土壤中的食真菌线虫比例在各采样季节均高于芦苇根际.
2.4 线虫的群落结构
MDS排序结果(图3)同样显示来自加拿大一枝黄花群落中的线虫群落与来自芦苇群落的能完全区分.而枯萎期(12月)加拿大一枝黄花群落与芦苇群落之间的根际土壤线虫群落结构差异最大.
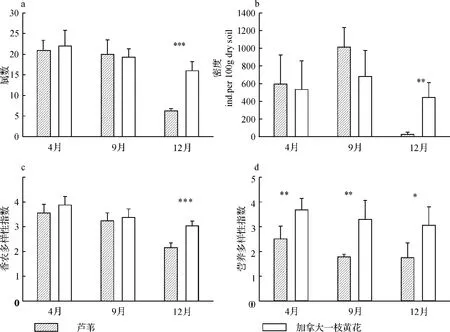
图1 加拿大一枝黄花和芦苇两种植物根际土壤线虫的属数(a)、密度(b)、Shannon-Weaver多样性(c)及营养多样性(d)Fig.1 Soil nematode genus number,density and Shannon-Weaver diversity index,trophic diversity index in the two plant communities dominated respectively by Solidagocanadensis L.and Phragmitesaustralis
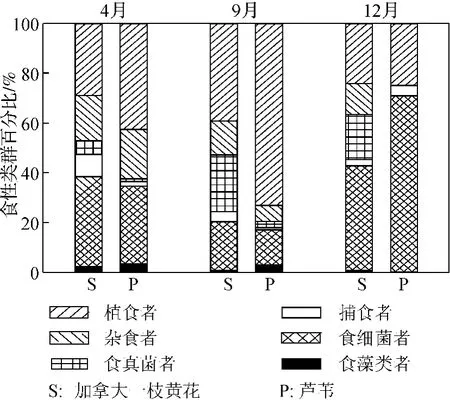
图2 加拿大一枝黄花和芦苇两种植物根际线虫的营养类群组成Fig.2 Proportional composition of nematode feeding groups in Solidagocanadensis L.and Phragmitesaustralis at each sampling time
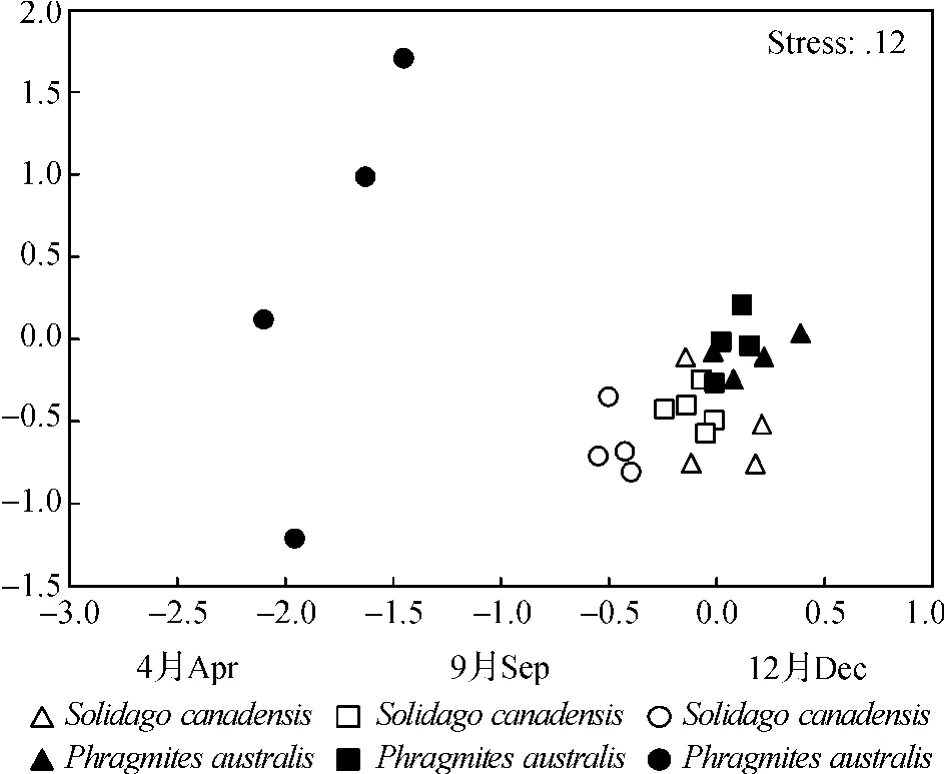
图3 两种植物根际土壤线虫群落结构的非参数多变量排序图(MDS)Fig.3 Non-metric multidimensional scaling(MDS)ordination of soil nematode communities associated with two plant species
3 讨 论
在该研究中,双因子方差分析显示植物类型对根际土壤线虫密度不存在显著影响,表明加拿大一枝黄花入侵芦苇群落对土壤线虫总数量没有影响.此前,Posey等[22]亦观察到大型动物数量在入侵美国东海岸的芦苇群落与土著植物互花米草群落的土壤间没有显著差异.此外,笔者发现植物类型显著影响根际土壤线虫属的丰富度和香农多样性.这与Samways等[23]的研究结果相一致,他们研究了入侵南非的6种杂草对地表无脊椎动物的影响,发现这6种入侵性杂草影响土壤中无脊椎动物的丰富度和多样性.刘志磊等[24]的研究也显示了紫茎泽兰(Eupatoriumadenophorum)入侵昆明西山森林公园降低土壤动物群落Shannon-Weaver多样性和均匀度.Chen等[25]发现互花米草入侵长江口芦苇盐沼将导致根际土壤线虫丰富度和多样性下降.
在该研究中,采样时间对根际土壤线虫属数、密度、香农多样性均有显著影响,表明植物不同生长阶段其根际土壤线虫数量和多样性存在差异.各季节加拿大一枝黄花与芦苇根际土壤线虫数量和多样性的比较分析表明,在4月(出苗期)和9月(开花期)加拿大一枝黄花根际土壤线虫属丰富度、数量和多样性与芦苇均没有显著差异,而在12月(枯萎期)加拿大一枝黄花根际土壤线虫的数量和多样性明显高于后者,表明加拿大一枝黄花入侵芦苇群落对线虫数量和多样性的影响与植物的生长阶段相关.许多研究已经证实采样时间在评价植物入侵对土壤或底栖动物的影响中有一定的作用[26].如,Osgood等[27]发现在5月,大型底栖动物属的丰富度和密度、小长臂虾的密度在入侵种互花米草群落中显著高于土著种芦苇群落,而7月和9月则不是.Angradi等[28]研究发现在新泽西州南部沼泽上,大型底栖动物的密度仅在8月和11月在芦苇群落中低于互花米草群落,在4月和6月则不是.
Gratton和Denno[29]曾报道入侵植物芦苇取代土著植物互花米草后将导致节肢动物群落的营养结构发生改变,这种改变主要表现为植食性、食碎屑和捕食性类群的变化.该研究显示,在各生长阶段外来植物加拿大一枝黄花根际土壤中的线虫营养多样性均显著高于土著植物芦苇的根际土壤.在出苗期和开花期,加拿大一枝黄花根际土壤中植食性线虫比例明显低于芦苇根际土壤,表明加拿大一枝黄花抗寄生线虫感染的能力比土著植物强,这可能是其成功入侵的机制之一.加拿大一枝黄花群落土壤中食真菌线虫比例高于芦苇根际土壤,而食细菌线虫比例在枯萎期明显低于后者,表明外来植物加拿大一枝黄花群落土壤中物质和能量流动更多地依赖真菌途径.金樑[30]的研究发现加拿大一枝黄花是一种高度菌根依赖性植物,笔者推测这可能是加拿大一枝黄花群落土壤食真菌线虫趋于增加的重要原因之一.
当外来植物入侵时,可以改变地上群落和地下群落之间的联系,包括改变地上植物对土壤群落提供资源的时间、质量、数量和空间格局,进而影响土壤生物的组成和功能[31-32].如陈中义等[33]通过研究中指出,互花米草入侵我国长江河口湿地将导致入侵地植物群落的密度、高度、盖度和生物量发生变化,进而造成土壤无脊椎动物群落结构的改变.更高的加拿大一枝黄花群落单位面积的地上生物量可能是造成两种植物根际土壤线虫群落存在差异的原因之一.如该研究显示在各生长阶段外来植物加拿大一枝黄花根际土壤中的线虫营养多样性均显著高于土著植物芦苇,表明加拿大一枝黄花群落的地下资源更为丰富,食物网结构更为复杂.通常认为更高的地上生物量意味着生态系统地上部分向地下部分输入资源总量的增加,该研究显示加拿大一枝黄花群落单位面积的地上生物量显著高于芦苇,由此推测外来植物入侵将导致入侵地地上生物量的增加,进而改变土壤生物的营养多样性,加速生态系统的养分循环.
综上所述,加拿大一枝黄花入侵在多样性和营养功能群水平上均对土壤线虫产生影响,即外来植物入侵改变了土壤生物的多样性、功能多样性和食物网结构,这种改变可能进一步影响土壤生态系统的养分循环和能量流动,并导致外来植物的进一步入侵.基于该研究结果,今后可从以下几个方面开展进一步研究:进行加拿大一枝黄花在原产地和入侵地之间的比较研究;在预测和评价加拿大一枝黄花对土壤线虫群落的影响时,要考虑多方面的因素,并整合不同尺度、不同生态系统的研究结果;对加拿大一枝黄花影响土壤线虫机制进一步深入研究.
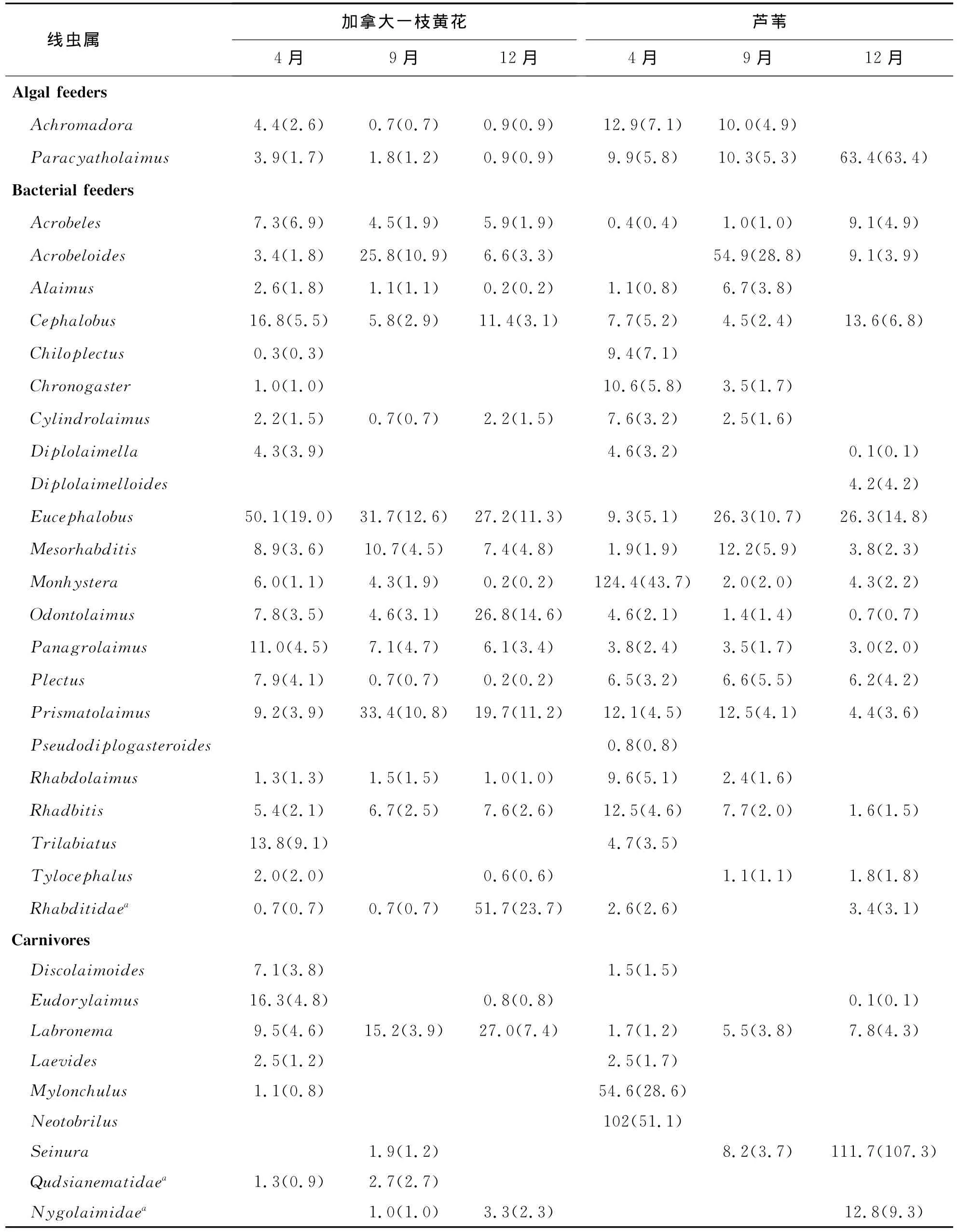
附表1 入侵种加拿大一枝黄花与土著种芦苇两种植物根际土壤线虫属的组成及丰度(条/100g土壤)Appendix table 1 Soil nematodes in the two plant communities dominated respectively by Solidagocanadensis L.and Phragmitesaustralis in April,September and December 2009

续表
[1]Ehrenfeld J G.A potential novel source of information for screening and monitoring the impact of exotic plants on ecosystems[J].Biological Invasions,2006,8(7):1511-1521.
[2]Van der Putten WH,van Dijk C,Peters BAM.Host-specific soil-borne diseases contribute to succession in foredune vegetation[J].Nature,1993,362:53-56.
[3]Bever J D.Feedback between plants and their soil communities in an old field community[J].Ecology,1994,75(7):1965-1977.
[4]董梅,陆建忠,张文驹,等.加拿大一枝黄花——一种正在迅速扩张的外来入侵植物[J].植物分类学报,2006,44(1):72-85.
[5]Zheng Chaozong.Flora of Zhejiang[M].Hangzhou:Zhejiang Science and Technology,1993:225-226.
[6]印丽萍,谭永彬,沈国辉,等.加拿大一枝黄花(SolidagocanadensisL.)的研究进展[J].杂草科学,2004,(4):8-11.
[7]陈芳.加拿大一枝黄花研究进展[J].草原与草坪,2006,(4):9-11.
[8]Johnson D,Vandenkoornhuyse P J,Leake J R,etal.Ecological linkages between aboveground and belowground biota[J].Science,2004,304(5677):1629-1633.
[9]He Jinsheng,Wang Zhengquan,Fang Jingyun.Issues and prospects of belowground ecology with special reference to global climatechange[J].Chinese Science Bulletin,2004,49(18):1226-1233.
[10]Belnap J,Phillips S L.Soil biota in an ungrazed grassland:response to annual grass(Bromustectorum)invasion[J].Ecological Appli-cations,2001,11(5):1261-1275.
[11]Kourtev P S,Ehrenfeld J G,Haggblom M.Exotic plant species alter the microbial community structure and function in the soil[J].E-cology,2002,83(11):3152-3166.
[12]Ehrenfeld J G.Effect of exotic plant invasions on soil nutrient cycling processes[J].Ecosystems,2003,6(6):503-523.
[13]Rice S K,Westerman B,Federici R.Impacts of the exotic,nitrogen-fixing black locust(Robiniapseudoacacia)on nitrogen-cycling in apine-oak ecosystem[J].Plant Ecology,2004,174(1):97-107.
[14]Lorenzen S.Phylogenetic systematics of freeliving nematodes[M].London:The Ray Society,1994.
[15]Moore J C,de Ruiter P C.temporal and spatial heterogeneityof trophic interactions within below-ground foodwebs[J].Age Ecosyst Environ,1991,34(1-4):371-397.
[16]Ingham R E,Trofymow J A,Ingham E R,etal.Interactions of bacteria,fungi,and their nematode grazers:effect on nutrient cycling and plant growth[J].Ecological Monographs,1985,55(1):119-140.
[17]Yeates G W,Bongers T.Nematode diversity in agroecosystems[J].Agriculture,Ecosystems &Environment,1999,74(1-3):113-135.
[18]van der Putten W H,Yeates G W,Duyts H,etal.Invasive plants and their escape from root herbivory:a worldwide comparison of the root-feeding nematode communities of the dune grassAmmophilaarenariain natural and introduced ranges[J].Biological Invasions,2005,7(4):733-746.
[19]李建国,李贵宝,崔慧敏,等.白洋淀芦苇湿地退化及其保护研究[J].南水北调与水利科技,2004,2(3):35-38.
[20]Yeates G W,Bongers T,De Goede RGM,etal.Feeding habitats in soil nematode families and genera-an outline for soil ecologists[J].Journal of Nematology,1993,25(3):315-331.
[21]Clarke K R,Warwick R M.Change in marine communities:an approach to statistical analysis and interpretation[M].Plymouth:Plymouth Marine Laboratory,1994.
[22]Posey M H,Alphin T D,Meyer D L,etal.Benthic communities of common reedPhragmitesaustralisand marsh cordgrassSpartina alternifloramarshes in Chesapeake Bay[J].Marine Ecology-Progress Series,2003,261:51-61.
[23]Samways M J,Caldwell P M,Osborn R.Ground-living invertebrate assemblages in native,planted and invasive vegetation in South Africa[J].Agriculture Ecosystems and Environment,1996,59(1-2):19-32.
[24]刘志磊,徐海根,丁晖.外来入侵植物紫茎泽兰对昆明地区土壤动物群落的影响[J].生态与农村环境学报,2006,22(2):31-35.
[25]Chen Huili,Li Bo,Fang Changming,etal.Exotic plant influences soil nematode communities through litter input[J].Soil Biology and Biochemistry,2007,39(7):1782-1793.
[26]Sarda R,Foreman K,Valiela I.Macroinfauna of a southern New England salt marsh:seasonal dynamics and production[J].Marine Biology Berlin,121(3):431-445.
[27]Osgood D T,Yozzo D J,Chambers R M,etal.Tidal hydrology and habitat utilization by resident nekton inPhragmitesandnon-Phragmitesmarshes[J].Estuaries,2003,26(2):522-533.
[28]Angradi T R,Hagan S M,Able K W.Vegetation type and the intertidal macroinvertebrate fauna of a brackish marsh:Phragmitesvs.Spartina[J].Wetlands,2001,21(1):75-92.
[29]Gratton C,Denno R F.Restoration of arthropod assemblages in a Spartina salt marsh following removal of the invasive plantPhragmitesaustralis[J].Restoration Ecology,2005,13(2):358-1372.
[30]金樑.外来入侵种加拿大一枝黄花的菌根生态学研究[D].上海:复旦大学,2005.
[31]Bever J D,Morton J B,Antonovics J,etal.Host-dependent sporulation and species diversity of arbuscular mycorrhizal fungi in a mown grassland[J].Journal of Ecology,1996,84(1):71-82.
[32]Westover K M,Kennedy A C,Kelley S E.Patterns of rhizosphere microbial community structure associated with co-occurring plant species[J].Journal of Ecology,1997,85(6):863-873.
[33]陈中义,傅萃长,王海毅,等.互花米草入侵东滩盐沼对大型底栖无脊椎动物群落的影响[J].湿地科学,2005,3(1):1-7.
Abstract:plant invasion;SolidagocanadensisL.;nematodes;diversity;trophic structure
Soil Nematode Communities Associated with ExoticSolidagoCanadensisL.and NativePhragmitesAustralis
XU Xiang-qin,LU Qiang,LIN Zhi-hua,CHEN Hui-li*
(Hangzhou Key Laboratory for Animal Adaptation and Evolution,Hangzhou Normal University,Hangzhou 310036,China)
To compare the diversity and community structure of soil nematodes between exoticSolidagocanadensisL.and nativePhragmitesaustralis,the experiment investigated the soil nematodes in two plant communities at Xiasha Hangzhou in April(emergence period),September(flowering period)and December(withering period)2009.The results show that there exist dissimilarities in nematode communities between exoticS.canadensisL.and nativeP.australisassociated with plant growth stage.There are no significant difference in density,genus richness and diversity of soil nematode communities betweenS.canadensisandP.australisin emergence and flowering period.In withering period,the density,genus richness and diversity of soil nematode are higher in the soil colonized byS.canadensisL.than in the soil underP.australis.The trophic diversity of nematode community is significantly higher in the soil colonized byS.canadensisL.than in the soil underP.australisin all three growth stages.Nematodes in the soil colonized byS.canadensisL.have higher proportion of fungivores and lower proportion of herbivores in emergence and flowering period compared to the soil ofP.australis.Significant increase in the proportion of fungivores and significant decrease in the proportion of bacterivores are detected in the soil colonized byS.canadensisL.compared to the soil underP.australisin withering period.The results of MDS show the dissimilarities in nematode communities between exoticS.canadensisL.and nativeP.australisin all three growth stages,and the greatest dissimilarities are found in withering period.The results suggest that the invasion of the exotic plant has changed the diversity,trophic diversity and trophic structure of soil nematode,which may change the direction and path of nutrition sources of soil ecosystem,and promote exotic plant further invaded.
Q959.171
A
1674-232X(2011)05-0435-09
10.3969/j.issn.1674-232X.2011.05.010
2011-04-21
浙江省教育厅科研基金项目(Y200907936);杭州师范大学科技创新基金项目(2009XJ009).
许湘琴(1986—),女,浙江金华人,生态学专业硕士研究生,主要从事土壤线虫生态学研究.
*通信作者:陈慧丽(1979—),女,浙江浦江人,副教授,博士,主要从事土壤生态学、线虫学研究.E-mail:huilichen@hznu.edu.cn

