柑橘皮渣生物转化燃料乙醇的研究进展*
陈海桂,顾楠,刘美艳,赵国华,2
1(西南大学食品科学学院,重庆,400715) 2(重庆市农产品加工技术重点实验室,重庆,400715)
柑橘皮渣生物转化燃料乙醇的研究进展*
陈海桂1,顾楠1,刘美艳1,赵国华1,2
1(西南大学食品科学学院,重庆,400715) 2(重庆市农产品加工技术重点实验室,重庆,400715)
利 用柑橘皮渣生物转化燃料乙醇是一种生产乙醇的安全可再生的方法。以柑橘皮渣为原料,通过酶或酸进行水解成可发酵糖液,利用糖酵解途径发酵乙醇的微生物将其转化为乙醇,提取脱水到99.5%浓度即得到燃料乙醇。这旨在解决柑橘产业大量副产物皮渣造成的环境污染资源浪费,同时生产乙醇作为枯竭的石油能源替代品。柑橘皮渣转化乙醇中,D-柠檬烯严重抑制微生物发酵,但合理控制各种影响因素可达到较高的乙醇产量。文中对柑橘皮渣生物转化燃料乙醇的过程及影响因素等进行了综述。
柑 橘皮渣,生物转化,燃料乙醇
近几年,乙醇作为替代石油的新能源前景堪好,生产方式有化学合成和生物转化2种。化学合成即乙烯水合法,因乙烯价格上涨使用减少。生物转化是以农产品、农林废弃物为原料,经水解转化成微生物可利用的糖发酵乙醇,因原料可再生、经济效益高而被广泛采用。生物乙醇是使用最广泛的生物燃料,多数欧洲国家的生物燃料乙醇占燃料替代品的15%,目前全球乙醇年产量达到了510亿L[1],乙醇作为新能源是未来发展趋势。我国生物转化燃料乙醇使用的原料约80%来自于谷物,燃料乙醇生产量大幅度提高,原料供应不足将彰显突出,非粮原料如农林废弃物等才可为乙醇生产提供保障。
2008年我国柑橘产量达到2 331万t。柑橘在鲜食或者加工中产生的柑橘皮渣占果实的40%~60%,高达1 000多万t,发酵沼气和制取乙醇最好的原料[2]。本文在论述生物转化燃料乙醇原理的基础上,详细介绍了生物转化的过程及影响因素,以期为柑橘皮渣的利用和燃料乙醇的生产提供参考。
1 生物转化燃料乙醇的原理
微生物利用糖发酵产生乙醇,其可在自身酶系统作用下,通过糖酵解途径将可发酵糖转化成乙醇和二氧化碳。如酵母菌在无氧条件下,将葡萄糖和果糖转化为丙酮酸后降解,通过脱羧作用生成乙醛,乙醛还原得到乙醇。
酵母菌乙醇发酵可分为前发酵期、主发酵期和后发酵期。在前发酵期,接种酵母后,酵母自身进行生长繁殖;主发酵期,糖液中的可发酵糖快速分解,乙醇大量形成,发酵时间一般在24 h,发酵时间延长到48~72 h后,乙醇含量增加幅度小,乙醇产量已基本固定;后发酵期,酵母和固形物下沉,反应逐渐停止。
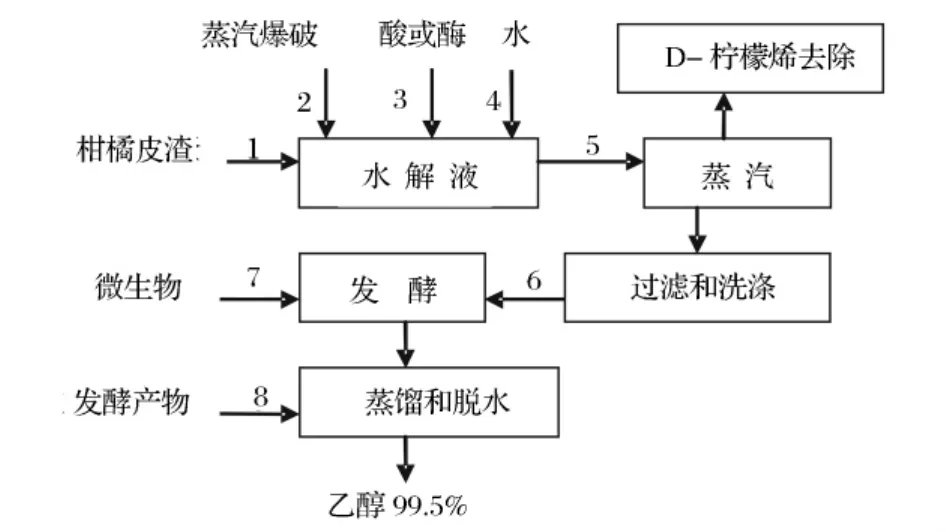
图1 柑橘皮渣生物转化燃料乙醇发酵过程
2 生物转化燃料乙醇的发酵过程
柑橘皮渣生物转化燃料乙醇的过程如下图1所示。预处理后用酸或酶水解并进行发酵作用,可以分步进行或者同时糖化发酵转化为乙醇。一般采用同时糖化发酵作用,即水解与微生物发酵在同一容器内同时进行。
2.1 柑橘皮渣预处理
2.1.1 柑橘皮渣蒸汽爆破
柑橘皮渣中D-柠檬烯的含量为8~16 mL/kg,进行蒸汽爆破主要作用在于去除D-柠檬烯,因其对酿酒酵母等微生物的发酵产生抑制作用。柠檬烯蒸汽压超过100℃,使用蒸汽爆破去除效果较好。处理时采取130~170℃,通过不断加热加压达到预定温度后释放压力,皮渣细胞壁在压力骤减时破裂,外果皮中的D-柠檬烯被蒸汽带出,皮渣中D-柠檬烯含量下降到0.1%以下,对微生物发酵抑制作用减弱。Widmer等[3]研究发现较高温度和较长处理时间,去除D-柠檬烯含量较多。在160℃蒸汽爆破处理4 min,D-柠檬烯含量下降到0.08%。预处理后进行酶水解48 h,水解液中糖含量从未预处理时的76%增长到94%。
同时,蒸汽爆破预处理能够使水解酶进入细胞纤维素壁,增大酸或酶与柑橘皮渣的接触面积,使糖化作用更完全,因而对柑橘皮渣蒸汽预处理能显著降低对酶水解的要求[4]。但有实验表明爆破可能会引起纤维素降解、部分纤维素解聚以及木质纤维素改性[5],导致糖液量下降。
2.1.2 柑橘皮渣水解处理
柑橘皮渣主要成分碳水化合物多聚糖,经过酸或酶水解后成分是葡萄糖、半乳糖醛酸、果糖、蔗糖、阿拉伯糖、半乳糖、木糖等,其中葡萄糖、果糖、蔗糖等约占80%,以上糖均可被微生物利用发酵乙醇。
酸水解时,用蒸馏水稀释蒸汽爆破后的柑橘皮渣,使固形物含量在15%左右。一定温度下用稀H2SO4水解,控制在10 min以内,水解后使用CaCO3调节pH。通过酸水解可精确测定纤维素和半纤维转化为糖的量[6]。Grohmann 等[7]研究发现过滤柑橘皮渣酸水解液可去除部分D-柠檬烯顺利进行发酵。Pourbafrani等[8]实验得出最优条件是在150℃下用稀H2SO4水解6 min,糖产量达到0.41 g/g柑橘皮渣干重。
柑橘皮渣酶水解时,常使用果胶酶、纤维素酶和半乳糖醛酸酶混合进行处理。使用果胶酶处理柑橘皮渣能够得到高浓度的糖液,而纤维素酶只对不可溶物有分解作用。果胶酶和纤维素酶结合使用是水解柑橘皮渣中碳水化合物多聚物的最有效方法[9]。糖化作用在柑橘皮渣含量高达22%~23%时仍能进行,但得到的葡萄糖、果糖和蔗糖等可溶物含量降低,糖化作用速度下降2~3倍。非发酵糖和剩余的固体聚合物,干燥之后可以作为牛养饲料。Grohman等[10]研究发现热H2SO4水解可溶性糖以及半纤维效果更好,同时酸水解明显促进之后使用纤维素酶和果胶酶水解柑橘皮渣的效率。
2.2 发酵乙醇的菌种筛选
发酵乙醇的菌种要具增值能力大、乙醇耐受性强并且产率高、稳定性好等特点。目前应用较多的有酿酒酵母、驯养的古巴Ⅱ号菌、克鲁维酵母、多变发酵单胞菌以及基因重组后能产乙醇的大肠杆菌KO11等,其中多变发酵单胞菌与大肠杆菌KO11对D-柠檬烯最低抑制浓度一致,为0.05%(v/v),但多变发酵单胞菌乙醇产量明显要高。克鲁维酵母是耐高温菌,Widmer等[11]对其在37~45℃进行同时糖化发酵作用发现,克鲁维酵母接种量大时性能较好,并且在42℃和45℃时也能产生乙醇,但乙醇量显著下降到18%~38%。酿酒酵母在温度高于37℃时性能不佳,但克鲁维酵母能够适应高温发酵乙醇。非酵母菌运动发酵单胞菌比酿酒酵母和其他酵母乙醇产量更高,甚至产量可多达5倍[12]。
另外,Plessas等[13]使用一种商业酿酒酵母,使其固定在柑橘皮上用来发酵生产乙醇。研究发现,发酵时间约5~15 h,比常规方法24 h要短,同时乙醇产量能达到1 506 g/L。Bai等[14]提出若使用固定酵母,固定酵母的费用,酵母细胞难以从固定体系中分离,以及增加了微生物污染的控制难度使固定酵母不能广泛应用。
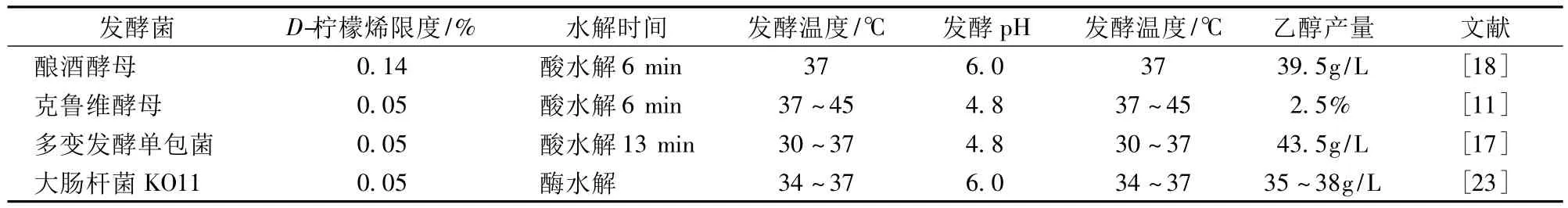
表1 主要发酵菌生物转化乙醇的情况
3 影响柑橘皮渣生物转化燃料乙醇的因素
3.1 D-柠檬烯
柑橘皮渣富含橘皮油,其主要成分为D-柠檬烯,对酵母的发酵具较强抑制作用,并且随着发酵温度和时间不同,最低抑制量也不同。David等[15]研究证实可通过加热柑橘皮渣水解液除去D-柠檬烯,另一种方法是在酶水解后用离心法去除。Gerow[16]研究去除D-柠檬烯的最经济的方案以及最优化温度为蒸汽爆破温度在110~132℃。但柑橘皮渣中D-柠檬烯在细胞内以及皮渣的固形物中,所以去除的最适温度应该稍高些。
Wilkins等[17]研究了橘皮油对多变发酵单胞菌发酵生产乙醇的影响。在30℃发酵24、48、72、96 h后橘皮油浓缩液抑制的最低限量分别为0.05%、0.10%、0.15%、0.20%;37℃ 发酵 24、48、72 h 后橘皮油浓缩液抑制的最低限量分别为0.05%、0.10%、0.20%,在96h后橘皮油对乙醇生产就不再有抑制作用。Wilkins等[18]研究发现D-柠檬烯浓缩液初始浓度≥0.33%(v/v),或24 h发酵后浓度≥0.14%时,发酵产生的乙醇量减少。Wilkins等[19]研究了橘皮油对啤酒酵母和克鲁维酵母在37℃发酵柑橘皮渣的抑制作用,啤酒酵母比克鲁维酵母对橘皮油耐受性好。
3.2 发酵底物浓度
柑橘皮渣生物转化燃料乙醇过程中,糖液浓度对酵母菌的影响表现在对成熟醪液中乙醇产量以及酵母分解糖发酵的速度和利用率等方面。稀醪液可以提高酵母对糖分的利用率,更有利于生物转化为乙醇。而浓醪液有利于减少乙醇提取浓缩时的蒸馏成本,但发酵底物浓度过高,抑制酵母发酵速度。另外,随着发酵进行底物中积累的乙醇对高耐乙醇的菌株的抑制作用较小。因此在菌种选择上,选择能够耐高糖浓度和耐高乙醇浓度的发酵菌更有利于生产乙醇。Zhao等[20]研究补充锌显著提高了絮凝酵母对乙醇的耐受性以及耐热性,从而提高乙醇产量。
3.3 发酵条件
生物转化燃料乙醇时,pH值、温度、氧气、营养物质等发酵条件对乙醇产量也有影响。一般在柑橘皮渣废弃物初始pH值为4.8和pH值6.0时有较大的乙醇产量。保证培养基营养物质合适比例,既经济又可以一定幅度提高酿酒酵母的乙醇产量。River等[21]提出用拟牛顿法(QN)和实数编码遗传法(RGA)估算乙醇产量和温度之间的相关性以及最佳发酵温度。Perego等[22]研究发现不同温度、稀释率和糖浓度不同对乙醇产量影响显著。在添加酵母提取液、蛋白胨、混合氨基酸、玉米浸渍液等营养物质后菌种发酵乙醇的效率明显提高。Karel等[23]利用大肠杆菌KO11发酵柑橘皮渣水解液生产乙醇时添加少量的氨基酸和肽,发酵动力明显增加。
4 燃料乙醇的提取和质量指标
乙醇的提取通常是先将醪液分馏得到乙醇粗馏分,再通过精馏得到水体积<0.5%的无水乙醇产品即为燃料乙醇。从柑橘皮渣发酵产物中提取乙醇可以通过单级分批蒸馏法,连续蒸馏难度较大[24]。目前较成熟的脱水方法是恒沸蒸馏和萃取蒸馏,但由于存在能耗高的缺点,逐渐发展出渗透汽化、吸附蒸馏、共沸蒸馏、加盐萃取蒸馏、变压吸附以及超临界萃取等方法。
生物转化中为了得到高质量的燃料乙醇,发酵醪液中要控制甲醇、甘油和杂醇油的产生外,要避免杂菌污染,蒸馏得到燃料乙醇时还需均衡进汽和进料以及控制温度等。用红外图谱可鉴定乙醇的等级,醇的吸收峰C—O在1 049.265 cm-1为一级醇。
5 结论
燃料乙醇是一种可再生的替代逐渐石油资源的新能源。利用柑橘皮渣生物转化燃料乙醇,不仅能解决其污染环境、浪费资源等问题,也为制备燃料乙醇提供了充足的原料。目前柑橘皮渣生物转化燃料乙醇的应用还缺乏高新技术的支持,同时经济成本较高,如厂房、设备、运输和酶等的费用仍是一大问题,当前尤其需要诱变筛选得到高耐D-柠檬烯、耐高浓度糖液、乙醇量高产的菌株。乙醇脱水浓缩得到燃料乙醇过程中仍存在能耗高效率低或脱水技术难以工业化应用的问题,是限制皮渣生物转化燃料乙醇产业规模发展的瓶颈,低成本高科技生物转化燃料乙醇对于充分利用柑橘皮渣、缓解能源紧缺状况至关重要。
[1] Sanchez O J,Cardona C A.Trends in biotechnological production of fuel ethanol from different feedstocks[J].Bioresource Technology,2008,99(33):5270 -5295.
[2] Gunaseelan V N.Biochemical methane potential of fruits and vegetable solid waste feedstocks[J].Biomass and Bioenergy,2004,26(4):389-399.
[3] Widmer W,Zhou W Y,Grohmann K.Pretreatment effects on orange processing waste for making ethanol by simultaneous saccharification and fermentation[J].Bioresource Technology,2010,101(14):5 242-5 249.
[4] Maria B A,Lidia G V,González-Castaneda F P,et al.Mandarin peel wastes pretreatment with steam explosion for bioethanol production[J].Bioresource Technology,2010,101(10):3 506-3 513.
[5] Margeot A,Hahn-Hagerdal B,Edlund M,et al.New improvements for lignocellulosic ethanol[J].Current Opinion in Biotechnology,2009,20(3):372-380.
[6] Talebnia F,Pourbarfani M,Lundin M,et al.Optimization study of citrus wastes saccharification by dilute-acid Hy-drolysis[J].Bioresource,2008,3(1):108 -122.
[7] Grohmann K,Baldwin E A,Buslig B S.Production of ethanol from enzymaticaily hydrolyzed orange peel by the yeast Saccharomyces cerevisiae[J].Applied Bixhemistry and Biotechnology,1994,45(46):315 -327.
[8] Pourbafrani M,Forgacs G,Horvath I S,et al.Production of biofuels,limonene and pectin from citrus wastes[J].Bioresource Technology,2010,101(11):4246-4250.
[9] Grohmann K,Baldwin E A.Hydrolysis of orange peel with pectinase and cellulase enzymes[J].Biotechnology letters,1992,14(12):1 169-1 174.
[10] Grohmann K,Cameron R G,Buslig B S.Fractionation a n d pretreatment of orange peel by dilute acid hydrolysis[J].Bioresource Technology,1995,54(2):129 -141.
[11] Widmer W W,Narciso J A,Grohmann K,et al.Simultaneous saccharification and fermentation of orange processing waste to ethanol using Kluyveromyces marxianus[J].American Society of Agricultural and Biological Engineers,2009,2(1):117-129.
[12] Panesar P S,Marwaha S S,Kennedy J F.Zymomonas mobilis:an alternative ethanol producer[J].Journal of Chemical Technology and Biotechnology,2006,81(4):623-635.
[13] Plessas S,Bekatorou A,KOUTINAS A A,et al.Use of Saccharomyces cerevisiae cells immobilized on orange peel as biocatalyst for alcoholic fermentation[J].Bioresource Technology,2007,98(4):860-865.
[14] Bai F W,Anderson W A,Moo-young M.Ethanol fermentation technologies from sugar and starch feedstocks[J].Biotechnology Advances,2008,26(1):89 -105.
[15] David A,Swewart K G,Mark R,et al.Ethanol production from citrus processing waste:United States,2006/0177916 A1[P],2006,10.
[16] Gerow G P.Economics of d-limonene recovery[J].Citrus Eng Conf,1974,20(5):61 -66.
[17] Wilkins M R.Effect of orange peel oil on ethanol production by Zymomonas mobilis[J].Biomass and Bioenergy,2009,33(3):538-541.
[18] Wilkins M R,Widmer W W,Grohmann K.Simultaneous saccharification and fermentation of citrus peel waste by Saccharomyces cerevisiae to produce ethanol[J].Process Biochemistry,2007,42(12):1614 -1619.
[19] Wilkins M R,Suryawati L,Maness N O,et al.Ethanol production by Saccharomyces cerevisiae and Kluyveromyces marxianus in the presence of orange-peel oil[J].World Journal of Microbiology Biotechnology,2007,23(8):1 161-1 168.
[20] Zhao X Q,Xue C,Ge X M,et al.Impact of zinc supplementation on the improvement of ethanol tolerance andyield of self-flocculating yeast in continuous ethanol fermentation[J].Journal of Biotechnology,2009,139(1):55-60.
[21] Rivera E C,Costa A C,Atala D I P,et al.Evaluation of optimization techniques for parameter estimation:application to ethanol fermentation considering the effect of temperature[J].Process Biochemistry 2006,41(7):1 682-1 687.
[22] Perego L JR,Cabral DE S Dias J M,Koshimizu L H,et al.Influence of temperature,dilution rate and sugar concentration on the establishment of steady-state in continuous ethanol fermentation of molasses[J].Biomass,1985,6(3):247-256.
[23] Karel G,Randall G,Cameron B S,et al.Fermentation of orange peel hydrolysates by ethanologenic Escherichia coil[J].Applied Biochemistry and Biotechnology,1996,57(58):383-388.
[24] Zhou WY,Winder W,Grohmann K.Developments in ethanol production from citrus peel waste[J].Proc Fla State Hort Soc,2008,121(5):307-310.
Progress on Fuel Ethanol Production from Citrus Peels by Biotransformation
Chen Hai-gui1,Gu Nan1,Liu Mei-yan1,Zhao Guo-hua1,2
1(College of Food Science,Southwest University,Chongqing 400715,China)2(Chongqing Key Laboratory of Agricultural Products Processing,Chongqing 400715,China)
Biotransformation of citrus peels for making fuel ethanol production is a safe renewable method.With citrus peels as materials by enzymes or acid hydrolysing into fermentable sugar,microorganisms by the glycolytic pathway ferment sugar into ethanol,and extract concentration of 99.5%dehydrated ethanol which are fuel ethanol.This is designed to address a large number of by-products of citrus industry that caused environmental pollution,while producing ethanol as the depletion of oil energy alternatives.D-limonene inhibits microbial fermentation when biotransformation of citrus peels,but the reasonable control of various factors will reach a high ethanol production.Citrus peels by biotransformation for making fuel ethanol and affecting factors were reviewed,which would provide valuable references for utilization of citrus peels and bio-ethanol production.
citrus peels,biotransformation,fuel ethanol
硕士研究生(赵国华教授为通讯作者,Email:zhaoguohua1971@163.com)。
*中央高校基本科研业务费专项资金资助(XDJK2009B003)
2010-07-27,改回日期:2010-11-17

