氢过氧化物裂解酶的筛选及纯化*
龙祯,阮奇珺,孔祥珍,张彩猛,华欲飞,江波
(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
氢过氧化物裂解酶的筛选及纯化*
龙祯,阮奇珺,孔祥珍,张彩猛,华欲飞,江波
(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
研 究了不同植物原料中氢过氧化物裂解酶的含量,并最后筛选出苋菜作为提取原料。利用高速离心、表面活性剂溶解、硫酸铵分级沉淀、羟基磷灰石柱层析和离子交换色谱对苋菜氢过氧化物裂解酶进行纯化至电泳纯。结果表明,纯化的苋菜氢过氧化物裂解酶分子量约为55ku,对于13-亚麻酸氢过氧化物的活力高于13-亚油酸氢过氧化物,最适pH6.0,最适温度为25℃,在常温下酶能保持较高水平的活力。
氢 过氧化物裂解酶,苋菜,纯化,特性
植物氢过氧化物裂解酶(HPL)是植物脂氧化途径中脂肪氧合酶(LOX)下游的酶,可将脂肪氧合酶和多不饱和脂肪酸形成的氢过氧化脂肪酸裂解形成含氧酸和挥发性醛类。它是植物产生清香风味成分基本途径(LOX/HPL)的关键组成部分之一,且其催化产物还与植物抗病、抗虫害有关[1]。近年来由于人们对天然香料的青睐,氢过氧化物裂解酶也逐渐受到人们的关注。
本课题对不同植物中氢过氧化物裂解酶含量进行比较和筛选,并选择苋菜氢过氧化物裂解酶为研究对象进行初步分离纯化和性质研究。本研究为酶法生产C6挥发性醛类奠定坚实的基础。这是首次从中国种植苋菜中分离纯化得到氢过氧化物裂解酶。
1 材料与方法
1.1 实验材料
青椒、苋菜、茄子、豌豆苗、菠菜和绿豆芽均购于当地农贸市场。二硫苏糖醇(DTT)、大豆脂肪氧合酶typeⅠ-B(LOX)、亚油酸、亚麻酸、己醛、己烯醛均购于Sigma公司。其他试剂为分析纯。
CXG-I型电脑恒温层析柜、HL-2型恒流泵、BS2-100型自动部分收集器,上海沪西设备厂;羟基磷石灰柱填料,上海Bio-red公司;DEAE-Tog-opeval柱顶料,上海TOSOH公司;柱套、上海锦华层析设备厂。
1.2 实验方法
1.2.1 亚油酸氢过氧化物和亚麻酸氢过氧化物的制备
100 mg亚麻酸或亚油酸溶于2 mL无水乙醇中,后转移至预先通氧气至饱和的100 mL 0.2 mol/L pH9.0的硼酸盐缓冲液中,随后加入3 mg溶入少量的硼酸盐缓冲液的LOX。快速搅拌均匀后在冰浴和持续通氧条件下反应1.5 h,随后用6 mol/L HCl调节反应液至pH3.0以下结束反应。用等体积无水乙醚萃取反应液2次后合并有机相,加入无水MgSO4干燥,过滤后在30℃下旋转蒸发除去乙醚,残留部分为亚麻酸氢过氧化物(13-HPOT)或亚油酸氢过氧化物(13-HPOD)溶于一定量乙醇,充氮后分装于 -20℃下密封保存。
1.2.2 同原料中氢过氧化物裂解酶的提取方法
100 g不同原料(青椒去籽去蒂、茄子去心去籽、绿豆芽子叶、豌豆苗叶、菠菜叶、苋菜叶)与300 mL 0.1 mol/L pH6.8的Tris-HCl(含0.5%PVP),匀浆3次共1 min得粗均浆液。4层纱布过滤,滤液于30 000 g、4℃离心20 min,弃去上清液,沉淀为氢过氧化物裂解酶(HPL)膜组分。而后用50 mL含0.5%Triton-X100的0.1 mol/L pH 8.5的Tris-HCl(和5 mmol/L DTT)溶解沉淀,4℃下搅拌1 h,在30 000 g、4℃下离心20 min,上清液即为溶解膜组分待用。
1.2.3 氢过氧化物裂解酶酶活的测定
采用分光光度法测定氢过氧化物裂解酶(HPL)的酶活。取x μL酶液(15~40 μL,因原料不同而不同)和 15 μL 10 mmol/L底物(13-HPOD 或 13-HPOT)与合适pH下的(2985-x)μL 0.02酸盐缓冲液混合,在234 nm、1 min内测定其吸光值的线性下降。空白用x μL酶液和(3000-x)μL磷酸盐缓冲液混合。1U酶活定义为每分钟每裂解1 μmol/L 13-HPOD/13-HPOT所需的酶量(ε=25 000mol/(L·cm)[2].
1.2.4 蛋白含量的测定
采用的BCA法测定[3]。
1.2.5 各种来源氢过氧化物裂解酶液最适pH值测定
所用的缓冲液为pH 5.0的0.02 mol/L柠檬酸-磷酸氢二钠缓冲液,pH 6.0、pH 7.0、pH 8.0的0.02 mol/L磷酸盐缓冲液,pH 9.0的0.02 mol/L硼酸盐缓冲液。
1.2.6 苋菜氢过氧化物裂解酶的纯化
苋菜经1.2.2所述处理后经硫酸铵分级沉淀(5% ~35%饱和度)再于40 000g、4℃下离心30 min得沉淀,用少量0.01 mol/L,pH6.8的磷酸钠缓冲液(其中含1 mmol/L DTT和0.5%Tritron X-100(缓冲液A))溶解后在相同缓冲液中透析过夜,在40 000 g、4℃下离心30 min,取上清液过0.22 μm 微孔滤膜。
过膜后酶液上经缓冲液A平衡过的羟基磷灰石柱(2.6 cm ×15 cm),用含 0.01、0.25和 0.4 mol/L磷酸钠的缓冲液A进行阶段洗脱,流速为3.0 mL/min,收集有酶活部分,用35%硫酸铵沉淀,离心,倒掉上清液,用少量0.02 mol/L,pH 8.5的Tris-HCl缓冲液(其中含1m mol/L DTT和0.5%Tritron X-100(缓冲液B))溶解,再在缓冲液B中透析过夜。
将透析液离心后,去上清,上经缓冲液B平衡的DEAE-Toyopearl柱((1.1 cm × 8.0 cm),用含 0,0.15,0.25和1.0 mol/L NaCl的缓冲液B进行阶段洗脱,流速为1.0 mL/min,收集有酶活部分,用100 ku的超滤管浓缩(15 mL,Millipore,上海,中国)待用。
1.2.7 十二烷基硫酸钠凝胶电泳(SDS-PAGE)
依照Laemmli[4]进行纯化HPL样品的十二烷基硫酸钠凝胶电泳(SDS-PAGE)。分离胶和浓缩胶的聚丙烯酰胺终浓度分别为12%(w/v)和4%(w/v)。蛋白用考马斯亮蓝染色。标准分子量蛋白为:兔磷酸化酶b(97 400u),牛血清白蛋白(66 200u),兔肌动蛋白(43 000u),牛碳酸酐(31 000u),胰蛋白酶抑制剂(20 100u)和鸡蛋清溶菌(14 400u)。
1.2.8 热稳定性的测定
将粗酶液与0.01 mol/L磷酸盐缓冲溶液的反应体系,分别在 25、30、35、40、45、50℃以及 55℃水浴中保温一定时间后立即冰浴冷却至室温后,测定HPL的残留活性。
2 结果与讨论
2.1 各原料氢过氧化物裂解酶最适pH的比较
为了更准确地比较不同原料中HPL的酶活,先对其最适pH值进行了测定。由表1可以看出,几种原料的最适pH值在5.5~7.0,且对于13-HPOD和13-HPOT其最适pH基本相同;而据报道,梨、茶叶和大豆子叶中最适pH都在中性[5,7]。不同来源的HPL对pH的敏感程度不同。青椒、苋菜HPL的最适pH在6.0附近,对pH的上升较敏感;而豌豆苗和菠菜最适pH在7.0左右,且对pH下降比较敏感。茄子HPL在pH值6.0~8.0酶活能够维持在90%以上,在pH5.0时大约为80%,在pH9.0时仍能维持在60%以上,说明茄子HPL有着一个较宽的工作pH。

表1 不同原料中氢过氧化物裂解酶的最适pH
2.2 不同原料中氢过氧化物裂解酶酶活的比较
根据表1,在不同来源HPL的最适pH下分别测定其活力,结果见图1。苋菜HPL的活性显著高于其他被选原料。因此选用苋菜叶作为原料提取HPL。

图1 不同原料中氢过氧化物裂解酶的酶活
由图1可知,所选原料中HPL对13-HPOT的活力更高。与 Fauconnier等人[10]和 Shibata 等人[5]发现番茄和青椒中的HPL也有类似的底物特异性的报道相吻合。然而,Olias等人[7]报道,在大豆幼苗中,HPL对13-HPOD的特异性高于13-HPOT。据报道,酶的特异性与生物体内真实脂肪酸组成是一致的。在苋菜叶中,亚麻酸是主要脂肪酸(占42%)[8],这符合HPL的底物特异性。相类似的亚麻酸在青椒中尤为丰富,而亚油酸是在大豆幼苗中占有优势。
2.3 苋菜氢过氧化物裂解酶的分离纯化
苋菜叶经均浆,高速离心,表面活性剂溶解和硫酸铵沉淀得到部分纯化HPL,具体结果见表2。

表2 苋菜中氢过氧化物裂解酶的分离纯化
通过高速离心得到膜组分回收了苋菜叶粗均浆液中绝大部分的HPL,而0.5%Triton X-100能将HPL从膜组分上溶解和分离,比酶活提高1.8倍。随后通过硫酸铵沉淀对HPL进行进一步纯化。
经硫酸铵沉淀后的HPL粗酶液上羟基磷灰石柱,收集磷酸盐浓度为0.25 mol/L的洗脱峰(见图2)用硫酸铵进行浓缩,进行下一步分离纯化。

图2 羟基磷灰石层析谱图
将经羟基磷灰石柱层析的酶液上DEAEToyopearl柱,结果见图3。收集活性组分,得到纯化倍数为83.3倍的HPL,酶比活为22.5U/mg,回收率为27%。

图3 DEAE-Toyopearl离子交换柱层析谱图
2.4 苋菜氢过氧化物裂解酶的SDSPAGE
由图4可知,经过一系列过程的纯化,得到电泳纯的HPL,在SDSPAGE图谱上基本为单一条带条带,分子质量约为 55ku,与报道一致[9-10]。
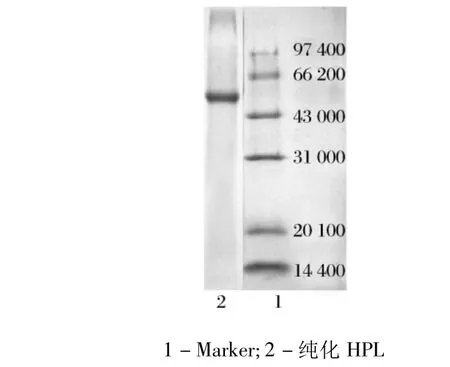
图4 苋菜氢过氧化物裂解酶的SDS-PAGE
2.5 苋菜氢过氧化物裂解酶最适温度及热稳定性
由图5可以看出,苋菜HPL的合适反应温度为20~35℃,反应最适温度为25℃。
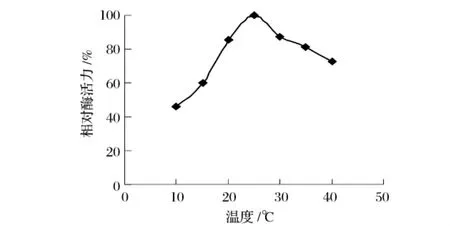
图5 苋菜氢过氧化物的最适温度
由图6可知,在10~45℃加热10 min,苋菜HPL活性能维持在80%以上,而高于45℃,随温度的上升,酶活迅速下降,在55℃保温10 min后酶活基本完全丧失。可见HPL对温度敏感,稍高的温度就有可能使酶失活。因此,游离酶的利用和处理都应尽量在常温下操作,以便保持较高的酶活。
3 结论
本课题组选取几种常见植物为原料,比较筛选出苋菜作为氢过氧化物裂解酶的提取原料。并对其进行部分纯化和性质研究。结果表明,苋菜中富含氢过氧化物裂解酶,其分子量大约为55 ku,最适pH6.0,最适温度25℃,在常温下酶能保持较高水平的活力。
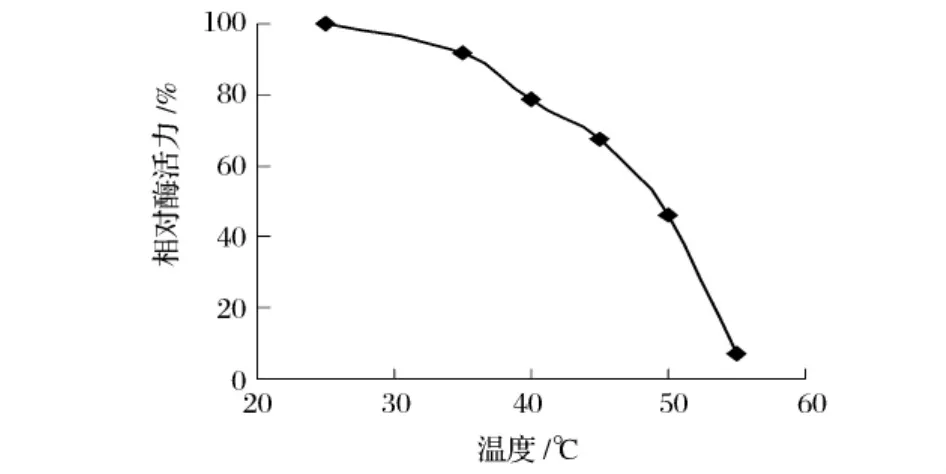
图6 苋菜氢过氧化物裂解酶的热稳定性
[1] Noordermeer M A,Gerrit A Veldink,Vliegenthart J F G.Fatty acid hydroperoxide lyase:a plant cytochrome P450 enzyme involved inwound healing and pest resistance[J].Chembiochemistry,2001,2:494 - 504.
[2] Noordermeer M A,Dijken A J H V,Smeekens SCM,et al.Characterization of three cloned and expressed hydroperoxide lyase isoenzymes from alfalfa with unusual N-terminal sequences and different enzyme kinetics[J].FEBS Lett,2000,267:2 473 -2 482.
[3] Hill H D,Straka J G.Protein determination using bicinchoninic acid in the presence of sulfhydryl reagents[J].Analytical Biochemistry 1988,170:203-208.
[4] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[5] Kim I S,Grosch W.Partial purification and properties of a hydroperoxide lyase from fruits of pear[J].Journal of agrictual and Food Chemistry,1981,29:1 220-1 225.
[6] Shibata Y,Matsui K,Kajiwara T,et al.Purification and properties of fatty acid hydroperoxide lyase from green bell pepper fruits[J].Plant physiology,1995,36:147 -156.
[7] Olias J M,Rios J J,Valle M,et al.Fatty acid hydroperoxide lyase in germinating soybean seedlings[J].Journal of Agrictual and Food Chemistry,1991,38:624-630.
[8] Fernando T,Bean G.Fatty acids and sterols of Amarantus tricolor L[J].Food Chemistry,1984,15:233 -237.
[9] Hornostaj A R,Robinson D S,Hornostaj A R,et al.Purification of hydroperoxide lyase from cucumbers[J].Food Chemistry,1999,66:173-180.
[10] Fauconnier M L,Perez A G,Sanz C,et al.Purification and characterization of tomato leaf(Lycopersicon esculentum Mill.)hydroperoxide lyase[J].Journal of Agrictual and Food Chemistry,1997,45:4 232-4 236.
Screen and Purification of Hydroperoxide Lyase
Long Zhen ,Ruan Qi-Jun,Kong Xiang-zhen,Zhang Cai-meng,Hua Yu-fei,Jiang Bo
(State key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Amaranthus tricolor leaves were identified as a particularly rich source of HPL activity.Hydroperoxide lyase(HPL)was purified to electrophoretic homogeneity from high speed centrifigation,solubilized by Tritron X-100,ammonium sulfate precipitation,hydroxypatite chromatography and DEAE Toyopearl chromatography.The purified HPL preparation consisted of a single band with a molecular mass of about 55 ku in SDSPAGE.The HPL showed higher activity against 13-hydroperoxy-linolenic acid compared to 13-hydroxy-linoleic acid.Maximum HPL activity was observed at pH 6.0 and 25℃,and room temperature sustains high enzyme activity.
hydroperoxide lyase,amaranth tricolor,purification,characteristics
在读博士(华欲飞教授为通讯作者)。
*国家863计划基金((2008AA10Z305);中央高校基本科研业务费专项资金资助(JUSRP10919)。
2010-08-05,改回日期:2010-11-15

