斑马鱼心脏标记基因VMHC多抗血清的制备
王 琨,满 贤,刘华友,李 志,李发祥,赵 阳,廖四芳,吴秀山,袁婺洲
(湖南师范大学蛋白质化学与发育生物学教育部重点实验室,心脏发育研究中心,中国长沙 410081)
斑马鱼心脏标记基因VMHC多抗血清的制备
王 琨,满 贤,刘华友,李 志,李发祥,赵 阳,廖四芳,吴秀山,袁婺洲*
(湖南师范大学蛋白质化学与发育生物学教育部重点实验室,心脏发育研究中心,中国长沙 410081)
斑马鱼基因VMHC(Ventricularmyosin heavy chain)是心脏发育早期的标志基因,制备该基因多抗血清,首先通过生物信息学方法,选择VMHC基因中特异性强、具亲水性的一段核苷酸序列(3 772~4 221 bp),通过PCR扩增,将片段重组到原核表达载体pGEX-4T-1,通过原核诱导表达获得含有表达目的片段的融合蛋白,以该融合蛋白免疫小鼠,获得VMHC多克隆抗鼠血清.对该多抗血清抗体进行验证,结果具有很好特异性和较高效价,可以用作western-blot、免疫印迹等试验分析.
VMHC;标记基因;融合蛋白;多抗血清
心脏肌球蛋白由2条重链和4条轻链构成,每条重链分别与2种轻链相结合.目前,已知的心脏肌球蛋白重链有α和β两种亚型[1-2],其中β-MHC与心肌肥大有着重要关系,β链的突变会引起心肌肥大症.在斑马鱼发育心脏中,VMHC(ventricular myosin heavy chain)是由心室心肌细胞表达而来,与β-MHC/MYH7有75%同源性,与β-MHC/MYH6有74%同源性,由于VMHC在心脏发育中和β-MHC/MYH7非常相似,因此将它们归为一类.VMHC只在心室的心肌细胞中表达,心房肌细胞则表达相应的AMHC(atrial myosin heavy chain)[3-4].VMHC表达受多种基因调控,研究发现在该基因启动子上有心脏发育相关基因N kx2.5、M EF2、GATA和Prx2/S8转录结合位点[5],可见该基因在心脏发育中的重要性.
斑马鱼基因VMHC已被证明最先在心室的心肌前体细胞中表达,是早期心脏发育标记基因之一.通过制备斑马鱼VMHC多抗血清,可以利用它作为斑马鱼心脏早期发育的标记,从而用于研究其他心脏发育候选基因在心脏发育中的功能.
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄小白鼠购自湘雅医院.
1.1.2 菌株与质粒 大肠杆菌感受态细胞XL-1 blue和BL21为湖南师范大学心脏发育研究中心保存;质粒pGEX-4T-1购自Promega公司;pMD18-T购自大连宝生物公司.
1.1.3 主要试剂 斑马鱼cDNA文库为湖南师范大学心脏发育研究中心保存;pfu高保真PCR酶购自Promega公司;限制性内切酶、T4连接酶购自NEB公司;质粒提取试剂盒购自Omega公司;IPTG、抗生素、DNA相对分子质量标准、蛋白相对分子质量标准等购自上海生工公司;PCR纯化回收试剂盒购自bio-tech公司, Glulalhione SepharoseTM4B蛋白纯化回收试剂盒购自PIERCE公司,其他试剂均为国产分析纯.
1.2 方法
1.2.1 抗原编码序列制备 选择150~500 bp基因片段作为抗原表达序列,利用在线分析软件:http:// www.proteinlounge.com/peptide_finder/default.asp分析编码VMHC蛋白的氨基酸序列亲水性,选择一段亲水性较强的氨基酸序列作为抗原编码序列,同时将该段氨基酸编码序列用BLAST软件与斑马鱼基因组比对,利用primerpremier5.0软件设计引物,正引物vmhcF:5'-GAATTCATGGAACATGTTGTAAAGA-3′,下划线标记为EcoRⅠ酶切位点,反引物vmhcR:5′-GTCGAC GGATGGCATCAGTTTC-3′,下划线标记为SalⅠ酶切位点,由上海生工公司合成,以斑马鱼cDNA文库为模板进行PCR扩增.反应条件是:94℃变性4 min;94℃30 s,55℃30 s,72℃30 s,反应30个循环;最后72℃延伸8 min.得到PCR产物大小为451 bp,经PCR纯化回收试剂盒纯化回收.
1.2.2VMHC的基因克隆与原核表达质粒构建 将扩增得到的VMHC基因片段连接到pMD18-T载体,转化大肠杆菌XL-1 blue感受态细胞,筛选阳性克隆,经EcoRⅠ和SalⅠ鉴定插入正确后,抽提重组质粒pMD18-T-VMHC.用EcoRⅠ和SalⅠ双酶切该重组质粒后,回收VMHC片段,与经同样的双酶切后的pGEX-4T-1原核表达载体连接,转化大肠杆菌XL-1 blue感受态细胞,经EcoRⅠ和SalⅠ双酶切鉴定插入正确后,进一步测序分析.
1.2.3 VMHC原核诱导 测序正确的质粒pGEX-4T-1-VMHC转化BL21感受态细胞,挑取2~3个单克隆,接种于10 mL含50 mg/L氨苄青霉素的培养基中,于37℃恒温摇床(200 r/min)培养过夜,取500μL培养过夜的菌液接种至20 mL的含50μg/mL氨苄青霉素的培养基中,培养2 h,用分光光度计检测菌液浓度,当OD600为0.4~0.6时,取1 mL菌液作为诱导前对照,加入IPTG至终浓度为100μmol/L,于37℃恒温摇床(200 r/min)诱导5 h[6],收集5 mL菌液于12 000 r/min离心5 min,弃上清,沉淀用1 mL PBS溶液混匀,超声(电压80 V,超声时间9 s,间隔4 s)60次左右,直至细菌溶液变澄清,再于12 000 r/min离心15 min,将上清转移到另一干净离心管,沉淀用1 mL PBS溶液混匀,诱导前菌液于12 000 r/min离心5 min,弃上清,沉淀中加入100μL PBS溶液混匀,沸水浴裂解10 min,分别取上清、沉淀和诱导前溶液40μL进行S DS-PAGE电泳检测.
1.2.4 VMHC蛋白纯化 按上述条件进行大量诱导,收集200 mL诱导的菌体超声裂解,于10 000 r/min离心15 min,收集上清,用Glulalhione SepharoseTM4B蛋白纯化回收试剂盒参照说明书纯化GST-VMHC融合蛋白,并于-80℃保存.
1.2.5 VMHC多抗血清制备 选取12只6周龄健康小白鼠,耳静脉取血约1 mL作为免疫前对照.取300μg纯化的GST-VMHC蛋白与等体积弗氏完全佐剂混合,于100 V超声1~2次制成乳剂,在小鼠背腹部皮下多点注射进行免疫.在第10 d、第17 d、第24 d将抗原蛋白与弗氏不完全佐剂等体积混合进行加强免疫,第31 d摘眼球取血.鼠血放置25℃静置过夜,以3 000 r/min离心10 min,收集血清,按每管200μL分装并于-80℃保存.
1.2.6 VMHC多抗血清检测 以pGEX-4T-1-VMHC转化BL21菌株诱导的蛋白进行SDS-PAGE电泳,用稀释1 000倍制备的抗VMHC鼠血清作一抗进行Western Blot检测.
2 实验结果
2.1 VM HC抗体制备肽段的亲水性及特异性分析
利用在线分析软件Peptide antigen finder对VMHC氨基酸序列进行亲水性分析,如图1显示VMHC氨基酸序列(1 257~1 407 aa)中大部分氨基酸疏水性数值为负值,表明这段序列中亲水性氨基酸较多,BLAST结果表明该段氨基酸编码序列(CDS:3 772~4 221 bp)为斑马鱼基因组中特异序列.
2.2 VM HC基因克隆
以斑马鱼cDNA文库为模板,以设计的引物扩增VMHC部分编码序列,经琼脂糖凝胶电泳检测结果如图2所示,扩增得到的目的条带与预期一致.
将目的片段连接到经EcorⅠ和SalⅠ酶切处理的pGEX-4T-1载体,经双酶切鉴定,如图3所示,约451 bp的VMHC片段从重组的表达载体中酶切出来.经进一步测序验证,表明pGEX-4T-1-VMHC载体已经成功构建.

图2 VMHC的PCR产物

图1 利用在线软件Peptide Antigen Finder分析VMHC抗体制备肽段(1 257~1 407 aa)的Kyte-Doolittle图

图3 pGEX-4T-1-VMHC双酶切鉴定结果
2.3 VM HC原核诱导表达
将质粒pGEX-4T-1-VMHC转化到大肠杆菌BL21中,在温度为37℃,IPTG浓度为100μmol/L的条件下诱导5 h,收集菌体,超声裂解细胞,离心获得上清和沉淀,以诱导前细菌裂解产物作对照,进行SDS-PAGE检测,如图4所示,在上清中相对分子质量为43 000处有明显的表达条带与预测的GST-VMHC肽段的融合蛋白大小一致,表明GST-VMHC融合蛋白为可溶性蛋白,可直接进行下步纯化处理.
2.4 GST-VM HC融合蛋白纯化
按上述诱导条件,大量诱导GST-VMHC融合蛋白,超声裂解细胞,于12 000 r/min离心15 min,取上清经GST-蛋白纯化试剂盒纯化后,进行SDS-PAGE电泳,经考马斯亮蓝染色,结果如图5显示,得到了纯度较高的GST-VMHC融合表达蛋白.

图4 pGEX-4T-1-VMHC在BL21大肠杆菌中融合蛋白诱导表达结果

图5 融合蛋白GST-VMHC的纯化结果
2.5 VM HC多抗血清W estern-blot检测
用pGEX-4T-1-VMHC原核诱导蛋白进行SDS-PAGE,以1∶1 000比例稀释的多抗血清作一抗检测,用免疫前鼠血清做对照,Westernblot检测结果如图6所示,用抗VMHC鼠血清检测出一条和GST-VMHC蛋白大小一致的特异性条带.以上结果表明本次制备的VMHC多抗血清具有良好的特异性和较高效价,可以用作斑马鱼心脏发育相关基因的表达研究.
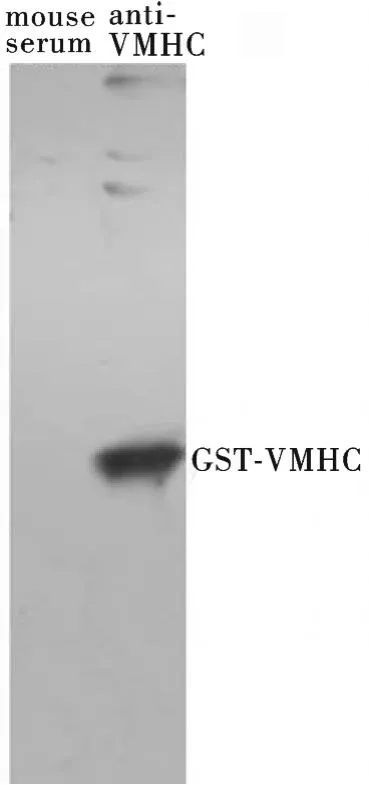
图6 多抗血清anti-VMHC的Western-blotting鉴定
3 讨论
本研究目的是获得VMHC原核表达融合蛋白,制备高效价和特异性好的鼠抗VMHC血清,用于本实验室斑马鱼心脏发育相关基因的研究[7-9].首先选择一段亲水性和特异性较强的VMHC部分编码序列,并构建该序列的原核表达载体,通过大肠杆菌原核诱导获得大量VMHC融合蛋白.为了克服原核诱导产生包涵体这一缺点,需要改变诱导条件包括:原核表达载体选择、大肠杆菌菌株选择、诱导温度、IPTG浓度、诱导时间等,另外也可以使用适量浓度的蛋白变性剂如尿素、盐酸胍等溶解包涵体,最终获得可溶性融合蛋白,从而方便使用蛋白纯化回收试剂盒进行纯化.实验选择带有GST标记的原核表达载体pGEX-4T-1,构建pGEX-4T-VMHC原核表达质粒,转化到具有高效蛋白表达特性的大肠杆菌BL21中,在温度为37℃,IPTG浓度为100μmol/L的条件下诱导5 h获得大量可溶性的GST-VMHC融合蛋白,利用Glulalhione SepharoseT M4B蛋白纯化回收试剂盒纯化后的纯度较高,能够满足多抗血清制备需要.实验按常规免疫方法获得抗VMHC鼠血清经Western Blot检测,多抗血清具有较高效价,而且没有其他杂带背景.
[1] WEISSA,LE INWAND L A.The mammalian myosin heavy chain gene family[J].Annu Rev CellDevBiol,1996,12:417-439.
[2] MORK IN E.Control of cardiac myosin heavy chain gene expression[J].Microsc Res Tech,2000,50:522-531.
[3] YELON D,HORNE SA,STA IN IER D Y.Restricted expression of cardiac myosin genes reveals regulated aspects of heart tube assembly in zebrafish[J].DevBiol,1999,214:23-37.
[4] BERDOUGO E,COLEMAN H,LEED H,et al.Mutation ofweakAtrium/atrialmyosin heavy chain disrupts atrial function and influences ventricularmorphogenesis in zebrafish[J].Development,2003,130:6121-6129.
[5] BRANTM W,DEREKL S,WOLFGANGD,et al.Gridlock,a localized heritable vascular patterning defect in the zebrafish [J].NatMed,1995,1:1143-1147.
[6] SAMBROOK J,RUSSELL D W.分子克隆实验指南[M].黄培堂,主译.3版.北京:科学出版社,2002:418-429.
[7] YUAN C,REULAND J M,LEE L,et al.Opt imized expression and refolding of human kerato epithelin in BL21(DE3)[J]. Protein Expr Purif,2004,35:39-45.
[8] ODENTHAL J,ROSSNAGEL K,HAFFTER P,et al.Mutations affecting xanthophore pigmentation in the zebrafish,Danio rerio[J].Development,1996,123:391-398.
[9] 王 华,张 云,吴秀山,等.斑马鱼心脏标记基因pitx2的多克隆抗体的制备[J].湖南师范大学自然科学学报,2010, 33(2):98-101.
Preparation of PolyclonalAntiserum of HeartMarker Gene VMHC in Zebrafish
WANG Kun,MAN X ian,L IU Hua-you,LI Zhi,L I Fa-xiang, ZHAO Yang,L IAO Si-fang,WU X iu-shan,YUAN W u-zhou*
(The Center for HeartDevelopment,KeyLab.ofMOE forDevelopmentBiology and Protein Chemistry, Hunan NormalUniversity,Changsha 410081,China)
Zebrafish geneVMHC(Ventricularmyosin heavy chain)is a marker gen in the early development heart.In order to get the polyclonal antiserum ofVMHC,aVMHC-specific,hydrophilic nucleotide sequence(CDS from 3 772 to 4 221 bp)was selected by using bioinfor maticsmethods,and the sequence was amplified by PCR. The PCR productwas inserted into the prokaryotic expression vectorpGEX-4T-1 and the fusion proteinwas induced to express in BL21 cells.The mouse was immunized by injecting appropriate amount of fusion protein and the VMHC polyclonal antiserum was obtained.The antiserum's titer and specification was identified.The results showed that theVMHCpolyclonal antiserum was practical and available forwestern-blotting analysis and immueprecipitation.
VMHC;marker gen;fusion protein;polyclonal antiserum
Q78
A
1000-2537(2011)02-0071-04
2010-12-18
湖南省普通高校学科带头人培养计划资助项目(湘教通2008-315);国家精品课程资助项目(教高函2009-21)
*通讯作者,E-mail:yuanwuzhou@yahoo.com.cn
(编辑 王 健)

