高迁移率族蛋白H MGB4的表达及多克隆抗体的制备
易 朵,王 成,帅 勇,肖湘文,赵晓蒙,周 畅*
(1.湖南师范大学生命科学学院,蛋白质化学与发育生物学教育部重点实验室,中国长沙 410081; 2.中山大学达安基因股份有限公司,中国广州 510665)
高迁移率族蛋白H MGB4的表达及多克隆抗体的制备
易 朵1*,王 成1*,帅 勇1,肖湘文2,赵晓蒙1,周 畅1**
(1.湖南师范大学生命科学学院,蛋白质化学与发育生物学教育部重点实验室,中国长沙 410081; 2.中山大学达安基因股份有限公司,中国广州 510665)
高迁移率族蛋白B4(high mobility group box,HMGB4)是HMGB家族的新成员,研究表明其可能在睾丸发育和精子发生等方面发挥重要作用.为进一步研究HMGB4的结构、功能及与其相互作用的蛋白而进行his-HMGB4融合蛋白表达载体的构建.序列鉴定分析后,用该重组质粒转化大肠杆菌BL21(DE3),异丙基β-D硫代半乳糖苷(IPTG)诱导产生his-HMGB4融合蛋白,继而纯化获得相对分子质量约25 000的融合蛋白.将此融合蛋白免疫新西兰兔,经Western印迹和EL ISA检测,制备的抗体可特异性识别HMGB4蛋白,其效价达1∶20 000.获得的高效价、高特异性的兔抗HMGB4蛋白多克隆抗体为下阶段研究HMGB4的功能奠定了基础.
HMGB4;原核表达;纯化;多克隆抗体
高迁移率族蛋白(high mobility group protein,HMG)由英国科学家Goodwin[1]于1973年在牛胸腺细胞中首次发现,是真核细胞内继组蛋白之后含量最为丰富的一组染色质蛋白质.因其分子量小,凝胶电泳时泳动速度快而得名.HMG蛋白在维持核小体稳定、DNA转录调控[2]、重组[3]、染色质重构[4]、炎症[5]及基因表达调控过程中均发挥着重要作用[6].
HMG家族蛋白的特点是都含有一个或多个HMG-box,是一个大的多样化的家族.目前HMG族中的多个成员,分为三亚家族:HMGA,HMGB,HMGN[7].它们有着不同DNA结合区的模式:HMGA家族有AT hook结构域[8];HMGB家族有HMG-box结构域;HMGN家族有核小体结合域[9].文献报道,HMGA蛋白质在早期的胚胎组织中含量很丰富,而在大部分的成体细胞中含量却相对较少.HMGN是一组与核小体结合的核蛋白,它们能够改变染色质的结构,增强染色质模板的转录和复制[10-11].HMGB蛋白在细胞中的含量最丰富,该家族目前报道的有HMGB1、HMGB2和HMGB3和HMGB4共4个成员.HMGB蛋白质之间通过酸性尾巴的长度来区分,对于HMGB1、HMGB2和HMGB3其酸性尾巴的长度分别是30、22和20个连续酸性残基, HMGB4缺乏酸性的尾部.HMGB1、HMGB2和HMGB3蛋白在氨基酸序列上有80%的一致性,且具有2个保守的半胱氨酸(Cys22、Cys44).它们主要由3个结构域组成:2个HMG-box(分别是A box和B box)和1个高酸性的重复C末端尾的尾部.A-box和B-box均由80个氨基酸形成3段α螺旋组成,富含赖氨酸,带正电荷.A-box和B-box折叠成楔形,与DNA小沟结合,没有序列特异性.C-端的酸性尾部富含天冬氨酸和谷氨酸残基,带负电荷,可参与调节与DNA结合的亲和力[12-15].
人类的HMGB4基因(GenBank登录号DQ 207367)是本研究室运用数字消减杂交技术新克隆的新基因.HMGB4基因和HMGB家族其他3个成员一样,也有2个HMG-box功能结构域,所处氨基酸的位置分别是A-box(aa8-80)和B-box(aa92-162),但它特殊之处是没有重复C末端尾的尾部.前期Northern Blot实验结果表明,HMGB4在睾丸组织中特异表达,在心、肝、脾、肺、肾、卵巢中都未检测到表达.它的组织特异性表达提示其功能可能与睾丸发育和精子生成相关,具体生理功能目前还不清楚.因此作者在克隆HMGB4的基础上,将HMGB4基因定向克隆至原核表达载体pQE-N1中,并将重组质粒转化至大肠杆菌BL21(DE3),实现了HMGB4蛋白的表达,采用Ni-NTA亲和层析柱对重组蛋白进行了纯化并测定了其生物活性,将制备his-HMGB4融合蛋白作为抗原免疫家兔获得抗血清,所得抗血清制备HMGB4特异性多克隆抗体.高效和特异的抗体的获得,为进一步研究HMGB4蛋白的生理功能研究奠定基础.
1 实验部分
1.1 材料
大肠杆菌DH5α、BL21(DE3),原核表达载体pQE-N1,NT2细胞为本室保存.雌性新西兰白兔购自湖南农业大学实验动物中心.pMD18-T购自Takara公司,总RNA提取试剂购自Invitrogen公司,逆转录RT-PCR试剂盒购自Promega公司,PCR试剂盒、T4 DNA连接酶,限制性内切酶及工具酶购自NEB公司,DNA Marker、蛋白Marker购自MB I Fer mentas公司,Ni-NTA琼脂糖购自Q IAGEN公司,DAB显色试剂盒购于武汉博士德公司,二抗辣根过氧化物酶标记的羊抗兔IgG、二抗辣根过氧化物酶标记的羊抗鼠IgG购于Jackson Immuno Research公司,质粒抽提试剂盒、凝胶纯化试剂盒购自安比奥生物技术公司,抗his单克隆抗体购自Santa Cruz公司.睾丸组织取自湖南省肿瘤医院精原细胞瘤和前列腺癌病人的睾丸组织活检.
1.2 方法
1.2.1 引物的设计合成与PCR扩增 引物的设计合成:根据GenBank上登录号DQ 207367的序列,用Primer5软件设计克隆HMGB4开放阅读框的一对引物,上游和下游引物分别是P1和P2.P1(5′-GGAAGATCTATG GGAAAAGAAATCCAGCTAAA-3′);P2(5′-CCCAAGCTTCAAACTGGATCCATCAGCTCTG-3′).预计扩增片段长度592 bp,两引物5′端分别加入了B glⅡ和HindⅢ酶切位点(划线部分).引物由上海生工公司合成.用TR IZOL提取人睾丸组织的总RNA,然后用Promega反转录试剂盒,以提取的总RNA为模板进行反转录获得睾丸cDNA.PCR反应体系为25μL:睾丸cDNA 1μL,10×PCR Buffer 2.5μL,exTaq酶0.125μL,上、下游引物各1μL(10μmol/L),dNTPsMixture 0.5μL(10 mmol/L),灭菌超纯水18.875μL. PCR反应条件为:95℃预变性90 s,94℃变性30 s,57℃复性30 s,72℃延伸30 s,32个循环,再用72℃延伸5 min.将HMGB4开放阅读框的PCR产物与pMD18-T克隆载体连接.
1.2.2 HMGB4原核表达载体的构建 将人HMGB4开放阅读框的PCR产物与pMD18-T克隆载体连接,然后转化DH5α感受态菌.氨苄青霉素(Amp)平板筛选抗性菌落,提取质粒,用限制性内切酶BglⅡ和HindⅢ双酶切鉴定.所选原核表达载体是pQE-N1,此载体内有his-Tag,能与目的蛋白高效融合表达.使用B glⅡ和HindⅢ双酶切重组克隆载体pMD-T-HMGB4,经琼脂糖凝胶电泳后用DNA凝胶回收试剂盒回收HMGB4目的片段,与用相同双酶切回收的pQE-N1线形载体连接.将连接产物转化DH5α感受态菌,氨苄青霉素平板筛选抗性菌落,酶切鉴定,然后测序验证.测序正确的命名为pQE-N1-HMGB4重组质粒.
1.2.3 pQE-N1-HMGB4在大肠杆菌BL21(DE3)中的表达及SDS-PAGE鉴定 将pQE-N1和pQE-N1-HMGB4分别转化至大肠杆菌BL21(DE3)感受态菌中,涂板培养于含有Amp的2×YT固体培养基上,37℃活化过夜后,挑取单菌落接种于含Amp(80 mg/L)的2×YT液体培养基中.37℃剧烈摇动培养1 h,培养至OD600=0.5~0.6,加入IPTG至终浓度1 mmol/L诱导表达.37℃诱导4 h后,分别收集菌液的上清和沉淀,通过可见光比色测定各组诱导样品的菌液浓度,计算各组样品在SDS-PAGE电泳时的上样量.菌液的上清和沉淀分别经过超声波破碎、煮菌后离心处理收集.分别用未诱导的pQE-N1转化的BL21(DE3)菌、诱导的pQE-N1转化的BL21(DE3)菌及未诱导的pQE-N1-HMGB4转化菌作为对照,与IPTG诱导的pQE-N1-HMGB4转化菌同时电泳.经考马斯亮蓝染色后脱色,用凝胶图像分析系统扫描凝胶,鉴定融合蛋白的表达形式并测算蛋白产量.
1.2.4 his-HMGB4蛋白的纯化 参照Q IAGEN公司的实验手册,将阳性单菌落接种于含有Amp的2×YT培养基中,37℃,200 r/min下培养至OD600值约为0.5~0.6,加入IPTG至终浓度为1 mmol/L,31℃下200 r/ min继续诱导培养4 h.收集250 mL诱导表达菌体,加入10 mL PBS洗一次,将其悬浮于10 mL裂解缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L咪唑,pH 8.0)中,加入溶菌酶至终浓度1 g/L,冰上放置30 min,加入PMSF至终浓度1 mmol/L,冰上超声破碎菌体(工作10 s/间隙10 s/6次,功率200~300 W),加入体积分数为1%的Triton X-100,5 mg/L DNase和10 mg/L RNase,冰上放置10 min.加入10 mmol巯基乙醇,4℃3 000 g离心30 min,去除不溶性细胞碎片,将上清转移到新管,加入蛋白酶抑制剂(100×cock tail稀释到1×).加入1 mL Ni-NTA slurry(50%是Ni-NTA Agarose,每毫升Ni-NTA Agarose可吸附510 mg his-Tag融合蛋白),4℃旋转60 min.将裂解上清与琼脂糖珠子混合物装入层析柱,用4 mL洗涤缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L咪唑,pH 8.0)洗柱,洗2次.用0.5 mL洗脱缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,250 mmol/L咪唑,pH 8.0)进行洗脱,洗4次,最后取样进行SDS-PAGE分析.
1.2.5 兔抗HMGB4蛋白抗体血清的制备 用Bradford法测定蛋白浓度后,符合要求即用于家兔的免疫.将纯化后的his-HMGB4融合蛋白与等体积弗氏佐剂混合超声乳化,按常规法免疫新西兰家兔,免疫前耳缘静脉取血作为阴性对照,接种方式为皮下多点注射,免疫周期为1、7、35 d,前2次采用弗氏完全佐剂,第3次采用弗氏不完全佐剂,每次每只500μg his-HMGB4融合蛋白,最后一次免疫后一周后颈动脉取血,室温静置1 h后,4℃静置过夜分离血清,2 000 g离心10 min去除血细胞,收集血清后分装,-80℃保存.
1.2.6 Western blotting鉴定重组融合蛋白 Western blotting法分别检测抗体对his-HMGB4融合蛋白和NT2细胞中内源HMGB4蛋白的识别.制备的HMGB4多克隆抗体作为一抗检测原核表达的his-HMGB4、内源表达的HMGB4,同时以his单抗检测作对照.抽提未经转染的NT2细胞的总蛋白,收获his-HMGB4融合蛋白.这两种蛋白经SDS-PAGE分离后,转移PVDF膜,用含50 g/L脱脂奶粉的TBS缓冲液4℃封闭过夜,然后与anti-his、自制HMGB4抗体和β-actin抗体37℃孵育2 h,用1×TBS、体积分数为0.1%的Tween-20洗涤4次,每次10~15min,再与辣根过氧化物酶标记的羊抗兔IgG、辣根过氧化物酶标记的羊抗鼠IgG在37℃温育1 h,1×TBS、体积分数为0.1%的Tween-20洗涤4次,每次10~15 min.最后采用DAB显色分析.
2 结果
2.1 重组质粒pQE-N1-HM GB4的构建和鉴定
将PCR产物先与pMD18-T载体连接,并转化至大肠杆菌DH5α感受态细胞中,通过抗性筛选得到含有目的基因的阳性菌.采用限制性内切酶B glⅡ和HindⅢ酶切克隆载体pMD18-T-HMGB4,得到目的基因片段,然后与同样经过这两种酶切后的表达载体pQE-N1连接,转化至大肠杆菌DH5α中,挑取单菌落提取质粒,采用BglⅡ和HindⅢ进行双酶切进行鉴定.同时以此质粒为模板,采用PCR扩增进行鉴定,所得结果如图1所示:由10 g/L琼脂糖凝胶电泳图中可以看出,以重组后的质粒为模板可以扩增出约592 bp的产物,酶切后的质粒在相同位置也出现大小一致的片段,说明目的基因片段与表达载体连接正确,表达载体pQE-N1-HMGB4的构建是成功的.DNA序列测定结果证实:扩增序列与人的HMGB4的DNA序列一致.
2.2 重组pQE-N1-HM GB4抗原的表达和纯化
将pQE-N1-HMGB4原核表达载体转化大肠杆菌BL21(DE3),得到含重组质粒的基因工程菌.细菌在37℃条件下摇菌培养,至OD值约0.6时,加IPTG诱导4 h后,超声破菌.分别制备全菌、上清、沉淀样品.SDSPAGE分析结果表明,经诱导的pQE-N1-HMGB4在25 000位置出现了一条明显的显色带.结果如图2所示:含有pQE-N1-HMGB4的菌株有外源蛋白产生,大小与his-HMGB4融合蛋白预期分子质量一致,表明诱导表达成功.该融合蛋白能可溶性表达,表达产物在上清和沉淀中都有.

图1 PCR扩增HMGB4目的基因片段和表达质粒pQE-N1-HMGB4双酶切鉴定
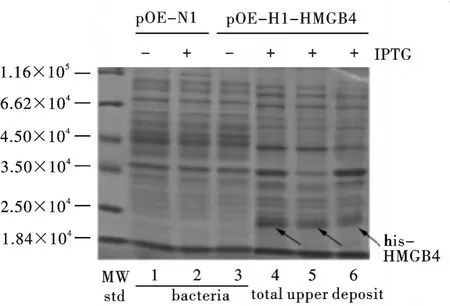
图2 his-HMGB4融合蛋白表达的SDS-PAGE分析
SDS-PAGE分析显示,直接诱导表达的蛋白中含有一些杂带,将表达可溶性HMGB4融合蛋白的上清液部分过Ni-NTA琼脂糖亲和层析纯化,充分洗涤将结合的蛋白从柱上洗脱下来纯化后效果很好,基本去除杂带,其纯度可达85%以上(图3),可以用作免疫抗原.Bradford法测定结果表明重组蛋白的表达量约为5~6 mg/L,获得约10 mg his-HMGB4蛋白用作免疫抗原.

图3 采用Ni-NTA亲和层析柱纯化重组HMGB4蛋白的SDS-PAGE电泳结果
2.3 抗HM GB4抗体的制备和效价检测
用his-HMGB4融合蛋白纯化的抗原皮下多点免疫家兔,获得抗HMGB4的血清.用酶联免疫吸附法(EL ISA)对制备的抗体进行检测,空白对照为PBS,阴性对照为未免疫的家兔血清,样品为免疫后的家兔血清.由于未免疫的家兔血清没有产生颜色反应,而免疫的家兔血清有颜色反应,说明免疫后的家兔产生了针对本实验抗原的抗体.EL ISA法测定效价的结果表明,从1∶100到1∶20 000的各个稀释度的抗体与重组的HMGB4蛋白有反应,抗体效价达1∶20 000(表1).

表1 EL ISA测定重组HMGB4蛋白血清抗体效价
2.4 W estern blotting鉴定重组融合蛋白
分别用制备的HMGB4多克隆抗体和anti-his抗体对抗原pQE-N1-HMGB4重组蛋白进行Western blotting检测,结果显示,用his单抗和HMGB4多克隆抗体都可识别抗原.另外,用制备的HMGB4多克隆抗体也可以检测到NT2细胞中内源HMGB4的内源表达(图4).Western blotting的结果蛋白大小相符,条带单一,抗体的特异性非常好.

图4 重组融合蛋白his-HMGB4的Western blotting分析
3 讨论
在蛋白质功能研究中,抗体是最直接、最有效的传统工具.特异性抗体常用于蛋白质的亚细胞定位分析,抗原在组织或细胞中的表达谱分析以及发现和鉴定与抗原蛋白相互作用的蛋白质等诸多方面[16].
本研究扩增了一个在人类睾丸特异性表达的新基因HMGB4.它定位在染色体1p35.1,氨基酸序列中含有186个氨基酸残基,成熟HMGB4蛋白分子的相对分子质量为25 000.通过pGL3-Luc转录活性报告分析实验,发现HMGB4是一个潜在的转录抑制子,作者推测HMGB4在睾丸发育和精子形成过程中有重要意义.为进一步研究HMGB4的功能及与其相互作用的蛋白而制备高效价的多克隆抗体.制备多克隆抗体选择的表达载体起关键的作用,本实验选用原核表达载体pQE-N1,因为pQE-N1具有高效的T5启动子,T5启动子引导的高效转录能被lac抑制蛋白所调控,而且pQE-N1上带有6个组氨酸(H IS)配体,His基因融合表达系统含6×His-Tag是比较理想的,表达的蛋白质可用于制备抗体和在体外研究蛋白质的相互作用等.His-Tag只有6个组氨酸大小的标签,在pH 8.0时不带电,很小,几乎没有什么免疫原性.经多种融合蛋白验证,对蛋白的分泌、折叠和结构甚至功能几乎没影响.His可利用Ni-NTA亲和层析进行纯化,得到较纯的融合蛋白.
本研究构建的pQE-N1-HMGB4重组载体在大肠杆菌中成功地表达了his-HMGB4融合蛋白,经SDSPAGE进行诱导表达可溶性分析,发现重组蛋白在上清和沉淀都有表达,为了获得更多可溶性的重组蛋白,尝试降低培养温度,改变IPTG诱导浓度、诱导时间等.得出最好的条件是37℃条件下摇菌培养,至OD值约0.6时,加终浓度为1 mmol/L IPTG在31℃诱导4 h,可以获得大部分可溶性重组蛋白.然后利用Ni-NTA琼脂糖亲和层析纯化.以融合蛋白为抗原免疫家兔并纯化抗血清,获得了抗HMGB4的多克隆抗体.Western blotting实验分析证实,抗体可特异性结合NT2细胞中的内源HMGB4蛋白,表明了所制备抗体具有高的亲和性.本实验制得高特异性抗体为下一步通过CH IP的方法寻找HMGB4的下游结合靶基因的研究提供了必要的基础.
[1] GOODW IN G H,SANDERS C,JOHNS EW.A new group of chromatin-associated proteins with a high content of acidic and basic amino acids[J].Eur J Biochem,1973,38(1):14-19.
[2] S INGH J,D I XON G H.High mobility group proteins 1 and 2 function as general class II transcription factors[J].Biochemistry,1990,29:6295-6302.
[3] GENTD C,H IOM K,PAULL T T,et al.Stimulation ofV(D)J cleavage by high mobility group proteins[J].Embo J,1997, 16:2665-2670.
[4] BONALD I T,LANGST G,STROHNER R,et al.The DNA chaperone HMGB1 facilitatesACF/CHRAC-dependent nucleosome sliding[J].Embo J,2002,21:6865-6873.
[5] WANG H,BLOOM O,ZHANGM,et al.HMG-1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285 (5425):248-251.
[6] BONALD I T,TALAMO F,SCAFF ID I P,et al.Monocytic cells hyperacetylate chromatin protein HMGB1 to redirect it towards secretion[J].EMBO J,2003,22(20):5551-5560.
[7] BUST IN M.Revised nomenclature for high mobility group(HMG)chromosomal proteins[J].Trends Biochem Sci,2001,26: 152-153.
[8] HUTH J R,BEWLEY C A,N ISSEN M S,et al.The solution structure of an HMG-I(Y)-DNA complex defines a new architecturalminor groove bindingmotif[J].Nat StructBiol,1997,4:657-665.
[9] BUST IN M.Chromatin folding and activation by HMGN chromosomal proteins[J].TrendsBiochem Sci,2001,26:431-437.
[10] REEVES R,ADA IR J E.Role of high mobility group(HMG)chromatin proteins in DNA repair[J].DNA Repair,2005,4 (8):926-938.
[11] CATEZ F,BROWN D T,M ISTEL I T,et al.Competition between histone H1 and HMGN proteins for chromatin binding sites [J].EMBO Rep,2002,8:760-766.
[12] GOODW IN G H,SANDERS C,JOHNS EW.A new group of chromatin-associated proteinswith a high content of acidic and basic amino acids[J].Eur J Biochem,1973,38:14-19.
[13] LANDS MAN D,BUST IN M.A signature for the HMG-1 boxDNA-binding proteins[J].Bioessays,1993,15:539-546.
[14] STOTT K,TANG G S,LEE KB,et al.Structure of a complex of tandem HMG boxes and DNA[J].J MolBiol,2006,360: 90-104.
[15] B IANCH IM E,AGRESTIA.HMG proteins:dynamic players in gene regulation and differentiation[J].Curr Opin Genet Dev,2005,15:496-506.
[16] ED HARLOW,DAV ID J.Antibodies,A LaboratoryManual[M].New York:Cold Spring Harbor Laboratory Press,1998: 282-318.
Prokaryotic Expression of Hum an HMGB4 and Generation of Its Rabbit PolyclonalAntisera
YI Duo1*,WANG Cheng1*,SHUA I Yong1,X IAO X iang-wen2,ZHAO X iao-m eng1,ZHOU Chang1**
(1.KeyLaboratory of Protein Chemistry and DevelopmentalBiology of State EducationMinistry of China, College ofLife Science,Hunan NormalUniversity,Changsha 410081,China; 2.Da An Gene Co.,Ltd.of Sun Yat-sen University,Guangzhou 510665,China)
HMGB4 protein is a new member of HMGB(High mobility group protein B)family,which may play important role in testis development and spermatogenesis.In order to further study the structure and biological function of HMGB4 and to investigate the proteins interacted with HMGB4,his-HMGB4 fusion protein vector was constructed.His-HMGB4 fusion protein was expressed and purified in prokaryotic system,and its polyclonal antibody was prepared.HMGB4 cDNA codon domain was amplified from human testis by RT-PCR method and recombined into pQE-N1 plasmid expressing his-tag fusion protein.After identified by the restriction enzyme digestion and sequencing,the recombinant clone was transformed into the competent expressive cells ofE.coliBL21(DE3). His-HMGB4 fusion protein was induced by IPTG and furtherpurified byNi-NTA Agarose affinity chromatography to obtain a fusion protein with molecularweight of 25 000.Rabbitswere immunized with the purified protein to prepare antisera.The antibody could recognize HMGB4 protein specifically and its titer is about 1∶20 000.These results confirm that the anti-rabbit HMGB4 polyclonal antibody with high affinity and specificity has been prepared successfully,and lay a foundation for our ongoing research on the specific expression of HMGB4 in human testis.
HMGB4;prokaryotic expression;purification;polyclonal antibody
Q78
A
1000-2537(2011)02-0065-06
2010-11-06
国家自然科学基金资助项目(81071696);湖南省教育厅科研资助项目(09B059);教育部留学回国人员科研启动基金资助项目((2010)609号)
**通讯作者,E-mail:zhouchang1972@126.com
*共同第一作者.
(编辑 王 健)

