普罗布考对高同型半胱氨酸血症兔肿瘤坏死因子-α和动脉粥样硬化的影响
吴乐,黎红华,武强,王晓昆
(广州军区武汉总医院1.神经内科;2.医学实验中心, 430070)
动脉粥样硬化(atherosclerosis,AS)从起源到最终并发症的形成都是动脉壁的慢性炎症过程[1]。肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)是一种具有广泛促炎活性的细胞因子,在动脉粥样硬化的形成过程中发挥重要作用[2-3]。近年来研究表明,同型半胱氨酸(homocysteinemia,Hcy)是导致 AS 的独立危险因素[4-6]。普罗布考已作为降血脂药物应用于临床,同时也具有抗动脉粥样硬化作用[7-8]。笔者以高蛋氨酸饮食诱导兔高Hcy血症及AS模型,探讨普罗布考对高Hcy血症致AS过程中的作用以及对TNF-α的影响。
1 材料与方法
1.1 实验动物和药物 雄性纯种新西兰大耳白兔24只,体质量2.0~2.5 kg,购自湖北省动物实验中心,动物许可证号:SCXK(鄂)2008-0005。普罗布考粉剂购自山东齐鲁制药有限公司。
1.2 主要试剂 TNF-α引物由上海赛百盛基因技术有限公司设计并合成,TNF-α的酶联免疫吸附试剂盒为R&D公司产品。
1.3 实验分组及给药 将大耳白兔随机分为3组,每组8只:对照组给予基础饲料每只200 g·d-1;模型组喂高蛋氨酸饲料每只200 g·d-1(基础饲料中加入1%蛋氨酸);治疗组在喂高蛋氨酸饲料每只200 g·d-1基础上,从第12周开始灌胃给予普罗布考每只1 g·d-1,共20周。
1.4 血清TNF-α及血浆Hcy测定 实验结束时每只动物采血4 mL,其中2 mL不抗凝,3 000 r·min-1(r=5.5 cm)离心15 min,取上清液,用酶联免疫法批量检测血清TNF-α,严格按照试剂盒的程序操作。用依地酸二钠溶液2 mL抗凝,30 min内4℃ 3 000 r·min-1离心15 min,分离血浆,-80℃冻存,以高效液相色谱法检测血浆Hcy。
1.5 病理形态学观察 末次给药后24 h禁食,不禁水,用气栓法处死动物,快速打开腹腔剥离腹主动脉,剪取腹主动脉约0.5 cm,10%中性甲醛溶液固定,梯度乙醇脱水,石蜡包埋,连续切片4μm,苏木精-伊红染色后于光镜下观察。其余腹主动脉-80℃冻存。
1.6 逆转录-聚合酶链法检测腹主动脉中TNF-α的mRNA表达水平 按照Trizol说明书方法提取组织总RNA,测定总RNA浓度及纯度。逆转录-聚合酶链反应:在逆转录反应体系25μL中,以总RNA 4μg为模板,用Mix逆转录酶将mRNA逆转录为cDNA。引物序列 如 下:TNF-α :5 '-AGCTCCAGTGGCTGAACCG-3 '(上游,5'-CAGGGCAATGATCCCAAAGTA-3'(下游),扩增 片 段 为 398 bp;GAPDH:5'-ACCAGCCCCAGCAAGAGCACAAG-3 '(上 游),5 '-TTC-AAGGGGTCTACATGGCAACTG-3'(下游),扩增片段为 123 bp。反应参数为:95℃预变性5 min,94℃变性30 s,61℃退火45 s,72℃延伸30 s,35个循环,72℃终末延伸5 min。扩增产物以1.6%琼脂糖凝胶电泳,凝胶成像系统进行半定量分析。每个实验组重复3次进行统计学分析。
1.7 统计学方法 数据以均数±标准差(x±s)表示,治疗前后比较采用配对资料t检验,组间比较采用成组设计资料t检验。所有统计分析均采用SPSS11.5统计软件进行计算。以P<0.05为差异有统计学意义。
2 结果
2.1 血清TNF-α及血浆同型半胱氨酸水平 见表1。模型组血清TNF-α和血浆Hcy水平较正常组明显增高。治疗组较模型组血清TNF-α水平明显下降。治疗组和模型组血浆同型半胱氨酸水平检查结果差异无统计学意义。
表1 3组兔TNF-α及Hcy水平的变化Tab.1 The changes of the levels of TNF-α and Hcy in the three groups of rats ±s

表1 3组兔TNF-α及Hcy水平的变化Tab.1 The changes of the levels of TNF-α and Hcy in the three groups of rats ±s
与模型组比较,*1 P<0.05,*2 P>0.05;与正常组比较,*3 P<0.05Compared with the model group,*1 P < 0.05,*2 P > 0.05;Compared with the normal group,*3 P <0.05
组别 兔/只TNF-α/(pg·mL-1)Hcy/(μmol·L-1)治疗组 8 4.01±1.13*1 43.42±3.53*2模型组 8 7.65±1.73*3 45.81±4.03*3正常组8 2.37±0.86 14.94±2.12
2.2 腹主动脉TNF-α的mRNA表达水平 以正常组DNA扩增条带吸光度为对照,各组DNA扩增条带吸光度与之进行比较,以所得比值作为TNF-α的mRNA水平的相对定量指标。结果模型组腹主动脉TNF-α的mRNA表达水平较正常明显增高(P<0.01)。治疗组腹主动脉TNF-α的mRNA表达明显降低,与模型组相比差异有统计学意义(P<0.05)。见图1。
2.3 组织形态学变化 见图2。苏木精-伊红染色显示,正常组血管壁内膜光滑完整,中膜平滑肌细胞排列规则;模型组血管内膜明显增厚,并可见一处内膜下出血(箭头处),中膜平滑肌细胞排列紊乱;治疗组血管内膜增厚明显减轻,中膜平滑肌细胞排列规则。
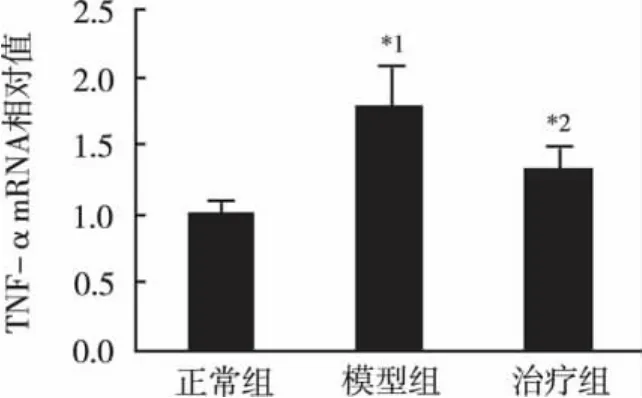
图1 3组兔腹主动脉TNF-α的mRNA表达与正常组比较,*1 P<0.01;与模型组比较,*2 P<0.05Fig.1 The m RNA expressions of TNF-α of abdom inal aorta in the three groups of ratsCompared with the normal group,*1 P <0.01;Compared with themodel group,*2 P <0.05
3 讨论
研究证实,血浆Hcy水平升高是心血管疾病的一个独立的危险因素。健康人的血浆Hcy水平为5~10μmol·L-1。血浆Hcy水平严重升高的患者通常伴有早发性的动脉粥样硬化。迄今为止,血浆Hcy水平升高引起心血管疾病的发病机制尚未完全明了。目前认为主要与以下几个方面有关:①高Hcy导致内皮细胞损伤及功能障碍。如内皮细胞合成一氧化氮减少,超氧阴离子产生增多,直接导致内皮细胞的氧化损害。由于代谢反应,Hcy之间的自身氧化增强,导致活性氧、羟自由基和脂质过氧化物激活剂增多,损伤血管内皮[9-10]。②高Hcy促进脂蛋白的氧化。当血浆中Hcy水平增高时,Hcy间的自身氧化增强,活性氧产生增多,促使脂蛋白发生过氧化,导致低密度脂蛋白的氧化,生成氧化低密度脂蛋白[11],从而易被巨噬细胞吞噬,巨噬细胞随后转变成泡沫细胞,导致脂质条纹病变的产生和纤维斑块的形成,促进主动脉粥样斑块的形成。③高Hcy能引起许多炎症递质释放,引起单核细胞、中性粒细胞对内皮细胞的黏附,白细胞在粥样斑块中的聚集,导致动脉粥样硬化的形成[12]。④其他机制,如刺激血管平滑肌细胞增殖和激活血栓形成。本研究观察到给予20周高蛋氨酸饮食后,兔血浆Hcy水平明显升高,同时主动脉组织形态明显改变,血管内膜明显增厚,中膜平滑肌细胞排列紊乱,可见高Hcy水平可以导致血管病变。

图2 3组腹主动脉苏木精-伊红染色结果(×200)Fig.2 HE stain of abdom inal aorta in the three groups of rats(×200)
TNF-α主要由单核-巨噬细胞产生,血管内皮细胞和血管平滑肌细胞也能产生TNF-α。TNF-α由单核细胞和巨噬细胞分泌后,通过促进血管内皮细胞和平滑肌细胞的增殖、影响脂类摄取与代谢、使血脂水平增高及增加细胞间质胶原的合成等途径参与动脉粥样硬化的形成[13]。研究表明,人动脉粥样硬化病变处TNF-α表达增加[14]。血清TNF-α水平升高能加重动脉粥样硬化病变程度以及增加冠心病发病风险[15-16]。因此,降低血清TNF-α水平可能是防治动脉粥样硬化有效途径。
普罗布考除了具有降血脂的作用外,还具有强大的抗氧化作用。普罗布考分子内所含的酚羟基很容易被氧化而发生断链,捕捉氧离子并与之结合形成稳定的酚氧基,有效降低氧自由基浓度,从而预防或延迟动脉粥样硬化的发生和发展,普罗布考可以通过其较强的抗氧化作用抑制该炎症的发展[17-18]。普罗布考的脂溶性使其易于穿过内皮细胞到达血管壁及脂质斑块之间发生抗氧化作用,从而抑制了斑块的形成,改变斑块的成分而发挥强大的抗动脉粥样硬化作用[19]。
本研究显示,给予普罗布考治疗8周后,兔血清TNF-α水平明显下降,腹主动脉TNF-α的mRNA表达明显减少,兔主动脉组织形态明显改善,但血浆Hcy水平差异无统计学意义。综上所述,普罗布考抗AS的作用可能与其能降低血清TNF-α以及抑制腹主动脉TNF-α的mRNA表达有关。
[1] LIBBY P,RIDKER P M,MASERIA.Inflammation and atherosclerosis[J].Circulation,2002,105(9):1135-1143.
[2] RODRIGUEZ-MALDONADO E,HERNANDEZ-REBOLLAR A E,LOPEZ-MARURE R,et al.Role of tumor necrosis factor alpha in atherosclerosis[J].Arch Cardiol Mex,2001,71(3):241-249.
[3] GUSTAFSON B J.Adipose tissue,inflammation and atherosclerosis[J].Atheroscler Thromb,2010,17(4):332-341.
[4] DUELL P B,MALINOW M R.Homocysteine:an important risk factor for atherosclerosis vascular disease[J].Curr Opin Lipidol,1997,8(1):28-34.
[5] EIKELBOOM JW,LONN E,GENEST J Jr,et al.Homocysteine and cardiovascular disease:a critical review of the epidemiologic evidence [J].Ann Intern Med,1999,131(5):363-375.
[6] CIACCIO M,BELLIA C.Hyperhomocysteinemia and cardiovascular risk:effect of vitamin supplementation in risk reduction[J].Curr Clin Pharmacol,2010,5(1):30-36.
[7] TAGAWA T,URABE Y,KIMURA Y,et al.Long-term treatment with probucol improves endothelial function in patients with coronary artery disease [J].Hypertens Res,2004,271(5):311-318.
[8] YAMASHITA S,MATSUZAWA Y.Where are we with probucol:a new life for an old drug?[J].Atherosclerosis,2009,207(1):16-23.
[9] JIN L,CALDWELL R B,LI-MASTERS T,et al.Homocysteine induces endothelial dysfunction via inhibition of arginine transport[J].J Physiol Pharmacol,2007,58(2):191-206.
[10] YAMAMOTO M,HARA H,ADACHI T.Effects of homocysteine on the binding of extracellular-superoxide dismutase to the endothelial cell surface[J].FEBS Lett,2000,486(2):159-162.
[11] GUILLAND J C,FAVIER A,POTIER D E,et al.Hyperhomocysteinemia:an independent risk factor or a simple marker of vascular disease?[J].Pathol Biol,2003,51(2):101-110.
[12] SCHROECKSNADEL K,FRICK B,WIRLEITNER B,et al.Moderate hyperhomocysteinemia and immune activation[J].Curr Pharm Biotechnol,2004,5(1):107-118.
[13] 任强,李自成,巫少荣,等.血管细胞黏附分子-1在动脉粥样硬化中的作用[J].临床荟萃,2004,19(4):419-421.
[14] RUS H G,NICULESCU F,VLAICU R.Tumor necrosis factor-alpha in human arterialwallwith atherosclerosis[J].Atherosclerosis,1991,89(2-3):247-254.
[15] SKOOG T,DICHTLW,BOQUIST S,et al.Plasma tumour necrosis factor-alpha and early carotid atherosclerosis in healthymiddle-aged men[J].Eur Heart J,2002,23(5):376-383.
[16] CESARIM,PENNINX B W,NEWMAN A B,et al.Inflammatory markers and onset of cardiovascular events:results from the health ABC study[J].Circulation,2003,108(19):2317-2322.
[17] NIEMANN-JONSSON A,DIMAYUGA P,JOVINGE S,et al.Accumulation of LDL in rat arteries is associated with activation of tumor necrosis factor alpha expression [J].Ahterioscler Thromb Vasc Biol,2000,20(10):2205-2211.
[18] ADAMEOVA A,XU Y J,DUHAMEL T A,et al.Antiatherosclerotic molecules targeting oxidative stress and inflammation[J].Curr Pharm Des,2009,15(27):3094-3107.
[19] 谢志忠,杨云波,陆明辉,等.普罗布考对受损内皮细胞增殖和功能修复的促进作用[J].中国临床药理学与治疗学,2002,7(5):401-405.

