条斑紫菜活性肽的制备及其功能性质研究
姚兴存,李静,舒留泉
(淮海工学院江苏省海洋生物技术重点实验室,江苏 连云港 222005)
条斑紫菜活性肽的制备及其功能性质研究
姚兴存,李静,舒留泉
(淮海工学院江苏省海洋生物技术重点实验室,江苏 连云港 222005)
采用木瓜蛋白酶、胰蛋白酶、胃蛋白酶水解紫菜蛋白制备活性肽,以水解度为评价指标,优化酶水解条件;研究条斑紫菜活性肽的溶解性、乳化性与乳化稳定性、起泡性与泡沫稳定性等功能性质。结果表明,3种酶解物都具有良好的溶解性且在等电点附近不沉淀,乳化性及其稳定性不如紫菜蛋白且随着pH升高而增强,酸性条件下起泡性较好,胰蛋白酶解物起泡性最强。
条斑紫菜;活性肽;水解条件;功能性质
条斑紫菜(Porphyra yezoensis)是长江以北江苏沿海人工养殖的大型食用海藻。紫菜的主要成分有约50%的碳水化合物和30%的粗蛋白[1],此外还含有丰富的维生素、矿物质及生物活性物质等。国内紫菜的主要利用途径是作为干品直接食用,精深加工产品几乎是空白。利用当地盛产的条斑紫菜,提取其中蛋白质,选取作用环境分别为酸性的胃蛋白酶、中性的木瓜蛋白酶、碱性的胰蛋白酶作为水解酶,将紫菜蛋白水解为生物活性肽,确定蛋白酶的最佳作用条件,研究紫菜活性肽的功能性质,以进一步开发紫菜保健食品,提高紫菜的利用价值。
1 材料与方法
1.1 材料与试剂
条斑紫菜为2010年3月连云港西墅物产有限公司生产的紫菜饼干品,凯氏定氮法[2]测定其蛋白质含量为33%。实验室中将紫菜50℃烘干至恒重,粉碎机粉碎,100目过筛后超临界CO2流体萃取脱除脂肪,储于广口瓶中干燥保存。
木瓜蛋白酶(酶活力为3×104U/g)、胰蛋白酶(酶活力为2.5×105U/g)、胃蛋白酶(酶活力为3×105U/g)购于上海生工有限公司;十二烷基磺酸钠(SDS)等化学试剂皆为国产分析纯;玉米胚芽油购于连云港大润发超市。
1.2 主要仪器
T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;Duo Flow层析系统:美国Bio-Rad公司;Primo R多用途台式高速冷冻离心机:美国热电公司;Pro250精密匀浆器,美国Pro Scientific公司;PHS-3C精密pH计:上海精密科学仪器有限公司;FW-100高速万能粉碎机:天津市泰斯特仪器有限公司;KS-300超声波粉碎机:宁波科生仪器厂;RE-501旋转蒸发仪:南京金正科教仪器有限公司。
1.3 方法
1.3.1 紫菜蛋白活性肽的制备
精确称取一定量紫菜干粉,加100 mL水混合均匀,超声辅助提取15 min,4000 r/min离心10 min,取上清液定容到100 mL。将3份提取液分别调节pH至7.0、8.0、2.0,分别加入木瓜蛋白酶、胰蛋白酶、胃蛋白酶等3种蛋白酶,充分均匀后按各自的最佳水解条件分别进行酶解,每间隔20 min振荡1次,酶解结束后,100℃灭酶10 min,自然冷却后8000 r/min离心15 min,上清液即为紫菜蛋白酶解液(活性肽),冷藏备用。
1.3.2 蛋白质水解度的测定
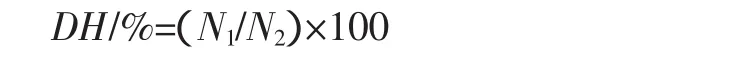
式中:DH为蛋白质水解度,%;N1为水解液中总氨基态氮含量,(g/mL);N2为样品的总氮含量,(g/mL)。
水解液中总氨基态氮含量根据中性甲醛电位滴定法测定[2],样品总氮含量按凯氏定氮法测定[2]。
1.3.3 溶解性测定
测定方法依照参考文献[3]。将酶解液浓缩4倍,取20 mL样液,用HCl或NaOH溶液分别调pH 2.0、4.0、6.0、8.0、10.0,各取10 mL进行凯氏定氮[2]。另10 mL分别加入等体积的质量分数为10%三氯乙酸(TCA),混匀后放置30 min,5000 r/min离心15 min,取上清液进行凯氏定氮[2],测可溶性氮含量,则样品液三氯乙酸氮溶解指数(TCA-NSI)为:

1.3.4 乳化性和乳化稳定性的测定
乳化性和乳化稳定性的测定为浊度法[4]。取3种酶解液和未酶解样品液各21 mL,加入9 mL玉米油混合均匀,分别调pH至2.0、4.0、6.0、8.0、10.0,取3 mL室温下14000 r/min均质1 min,分别在静置0 min和30 min后从容器底部取0.03 mL乳状液放入比色皿中,用3 mL质量分数为0.1%SDS溶液稀释,500 nm处测吸光度,以SDS溶液空白调零。以静置0 min后测出的OD值表示其乳化性,0 min和30 min后OD值的差值表示其相对乳化稳定性。乳化性(EAI)和乳化稳定性(ESI)分别按下式计算:
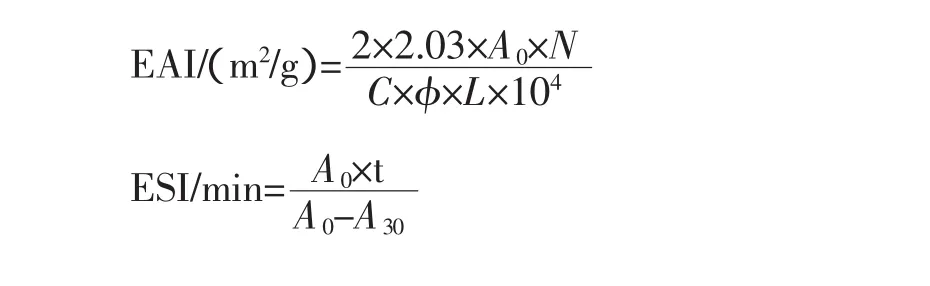
式中:C为样品浓度,(g/mL);L为比色杯光径,cm;A0为初始乳化液的吸光度;A30为30 min后的吸光度;Φ为乳化液中油相的比例;N为稀释倍数;t为2次测定乳化性的时间间隔(这里t=30)。
1.3.5 起泡性和泡沫稳定性的测定
测定方法依照参考文献[5]。将酶解液浓缩10倍,取20 mL样液,分别调pH2.0、4.0、6.0、8.0、10.0,取6 mL用高速匀浆器10000 r/min搅打1 min,立即倒入量筒并记录泡沫体积,静置30 min后,再记录其泡沫体积。起泡性(FC)和泡沫稳定性(FS)分别按下式计算:
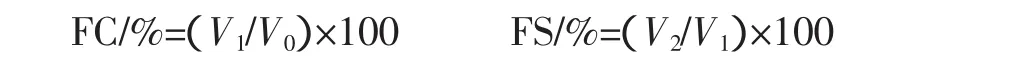
式中:V0为搅打前的液体体积,mL;V1为搅打停止时的泡沫体积,mL;V2为搅打停止30 min后的泡沫体积,mL。
2 结果与分析
2.1 蛋白酶的水解条件研究
蛋白酶水解时受到温度、水解时间、酶用量和酸碱度的影响最大。为此,根据单因素试验结果,设计采用了L9(34)的正交试验,研究因素间的交互作用。木瓜蛋白酶水解试验的因素和水平如表1,表2为其正交试验结果与极差分析。
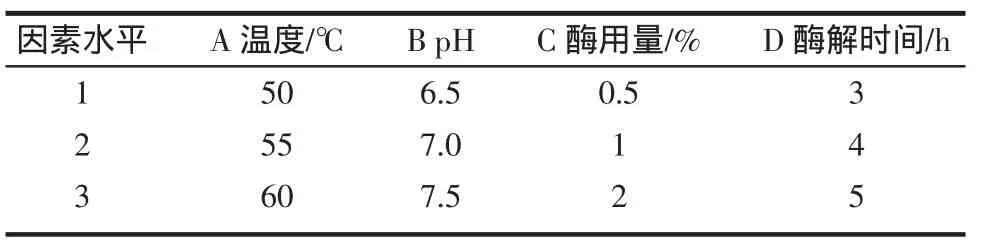
表 1 木瓜蛋白酶水解正交试验因素水平表Table 1 Factors and levels of papayin hydrolysis
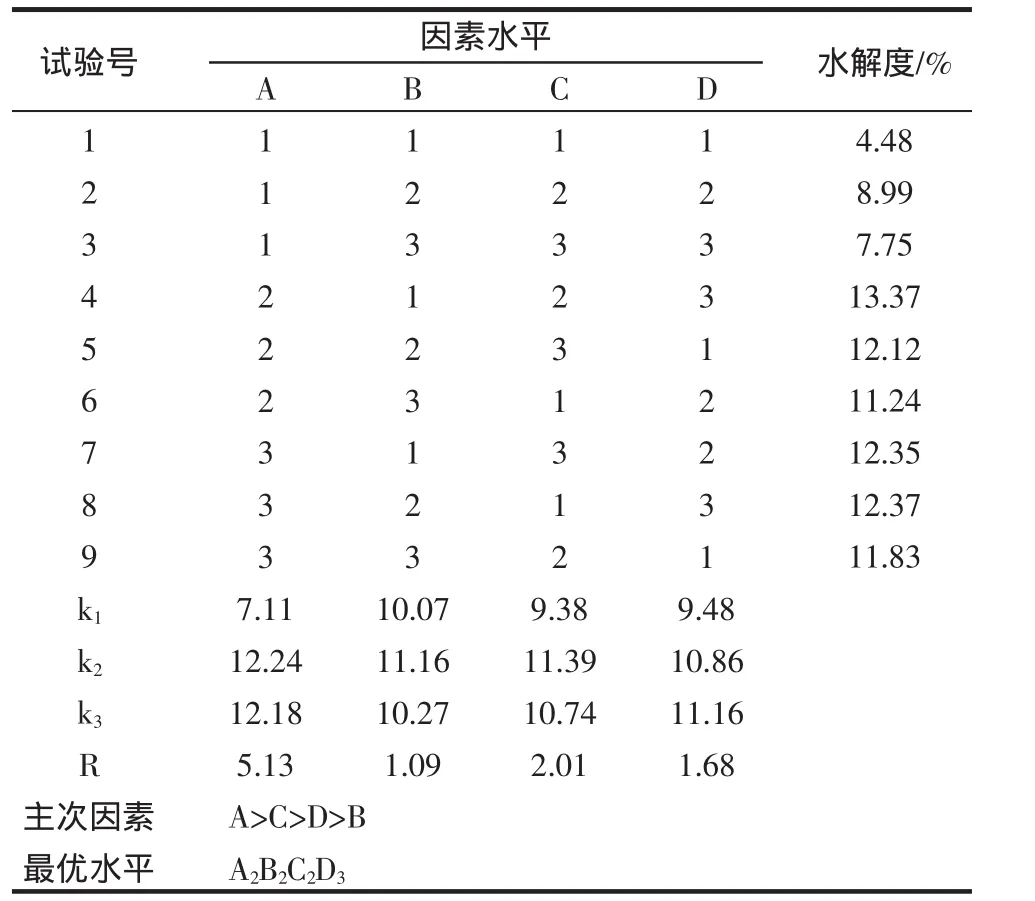
表 2 木瓜蛋白酶水解正交试验结果与极差分析Table 2 Result and range analysis of the orthogonal test of papayin hydrolysis
由极差分析比较可以看出,因素对木瓜蛋白酶水解紫菜蛋白影响的主次顺序是ACDB,即温度对紫菜蛋白的水解度影响最大,其次是酶用量、酶解时间和pH。由此,确定水解各因素的最优水平组合为A2B2C2D3,即最佳水解条件为:水解温度55℃,pH7.0,酶用量1%,水解时间为5 h。
在此条件下,进行3次验证试验,测得紫菜蛋白的水解度平均值为13.85%,说明最佳工艺条件下具有最大水解度。
同样方法,正交试验研究胃蛋白酶、胰蛋白酶的最佳水解条件,可以得到类似的结果,将3种酶水解紫菜蛋白优化后的水解条件列于表3。

表 3 3种酶的适宜水解条件Table 3 The optimum hydrolyzing conditions of three kinds of enzymes
2.2 溶解性
不同pH条件下酶解液和未水解液的三氯乙酸氮溶解指数(TCA-NSI)见图1。
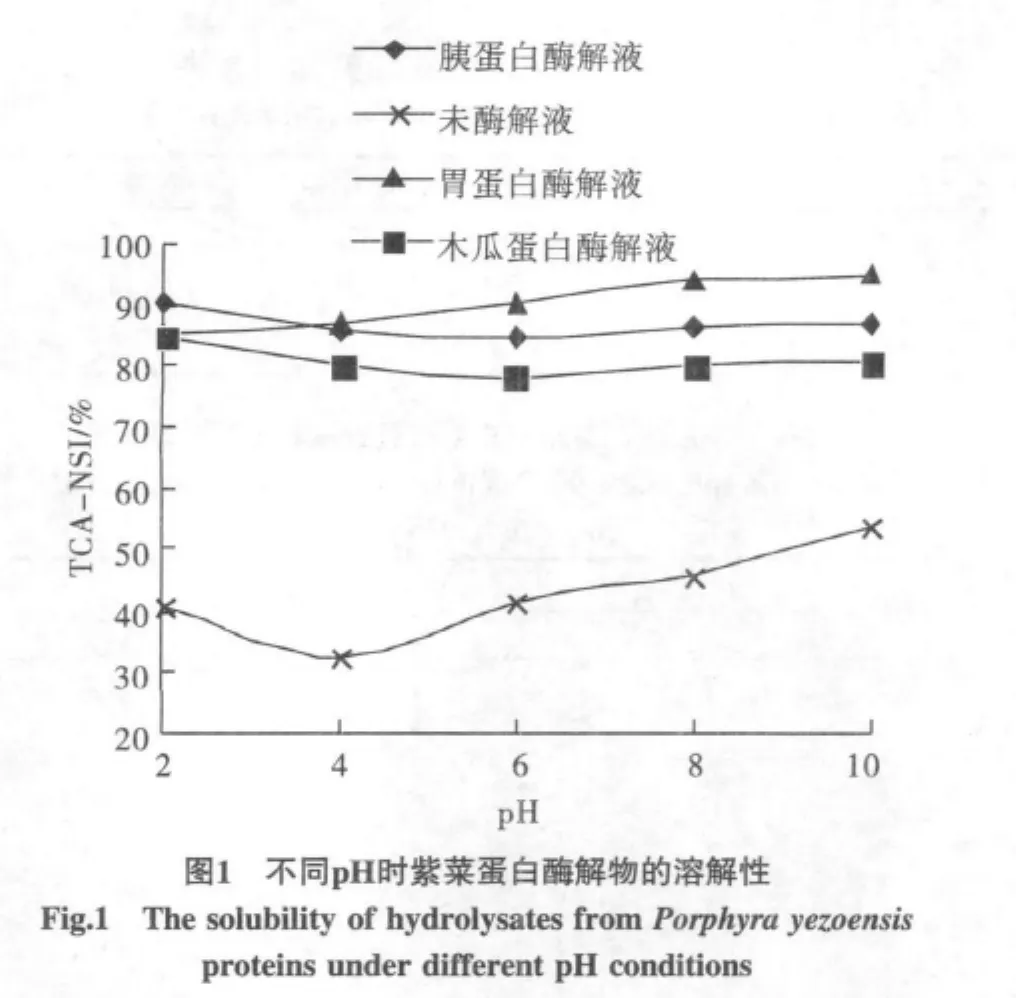
由图1可以看出,未酶解蛋白及酶解液在pH4~6时(等电点附近)溶解性皆较低;与未酶解蛋白相比,蛋白酶解液的溶解性显著增大,这主要由于酶水解使得蛋白质的二级结构破坏,肽链长度变小,更小的分子和新暴露的离子化氨基与羧基提高了水解产物的亲水性,从而增加了其溶解性。TCA-NSI指数也是蛋白质水解程度的重要指标。
2.3 乳化性和乳化稳定性
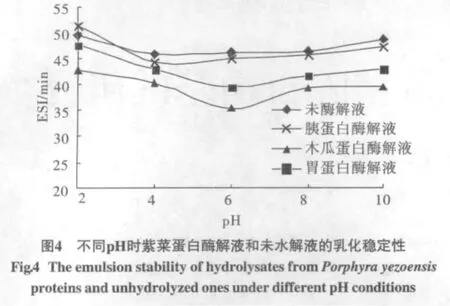
3种酶解液的乳化性测定结果如图2所示,未进行酶水解的紫菜蛋白液的乳化性见图3,酶解液和未水解液的乳化稳定性见图4。
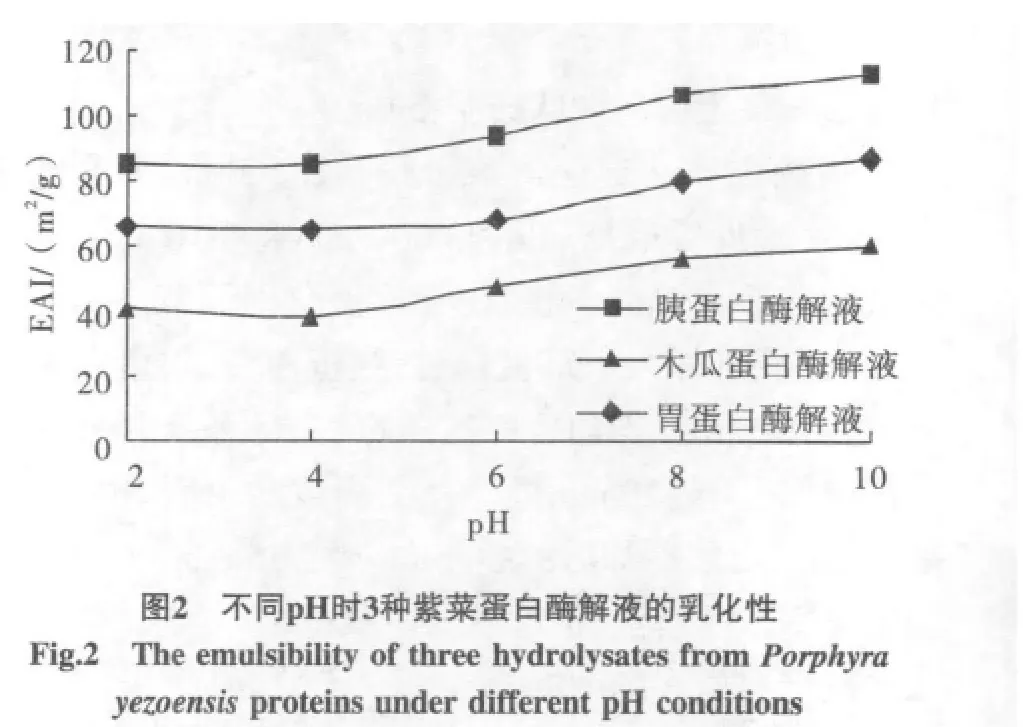
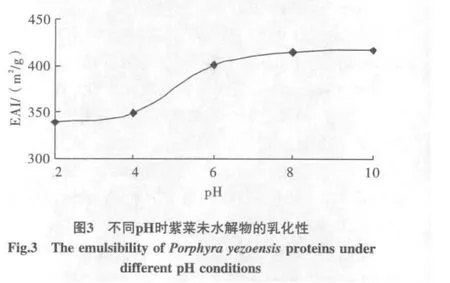
由图2和图3可以看出,在研究的pH范围内,未水解紫菜蛋白乳化性远远高于蛋白酶解物;随着pH的升高,乳化性呈现明显的上升趋势,酸性环境中的乳化能力要弱于碱性环境;3种酶解液中,胰蛋白酶酶解液的乳化性最大,胃蛋白酶次之,木瓜蛋白酶最小。蛋白质与肽的乳化性与分子表面的亲水、疏水基团及分子大小有关,酶法水解时,蛋白质被降解成短肽链,使大量的疏水性基团暴露并几乎完全亲水,则其乳化能力降低。另外,对于同一种蛋白酶解物,在不同pH下的乳化性有一定差别,随着pH升高,其所带负电荷增多,乳化性则有一定程度的增强。
从图4乳化稳定性的变化来看,在考查的pH范围内,3种酶水解液和未水解液的乳化稳定性均较小,在pH6时稳定性最差。究其原因,一是由于紫菜蛋白的水解,酶解液中多为相对分子质量较小的肽,其乳化稳定性降低;二是无论是原始蛋白质溶液还是酶解液的浓度均较低,即使能够形成一定的乳化状态也不会维持太长时间。
2.4 起泡性和泡沫稳定性
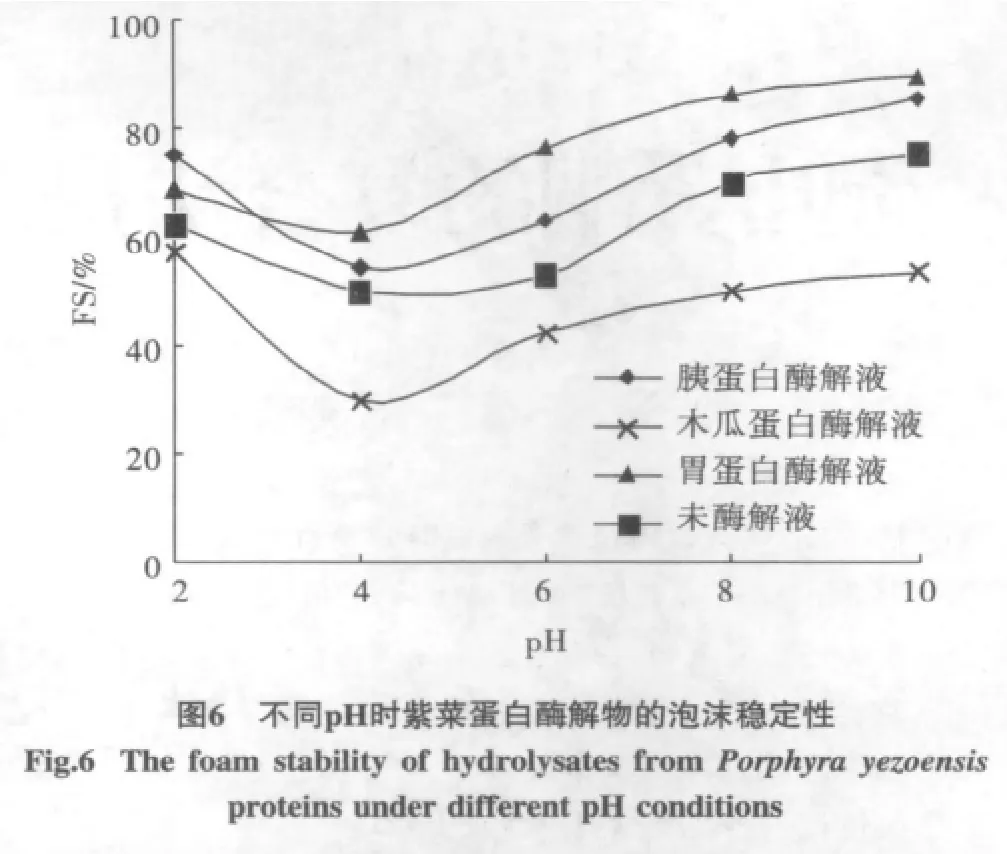
3种酶解液和未水解液的起泡性见图5,泡沫稳定性见图6。
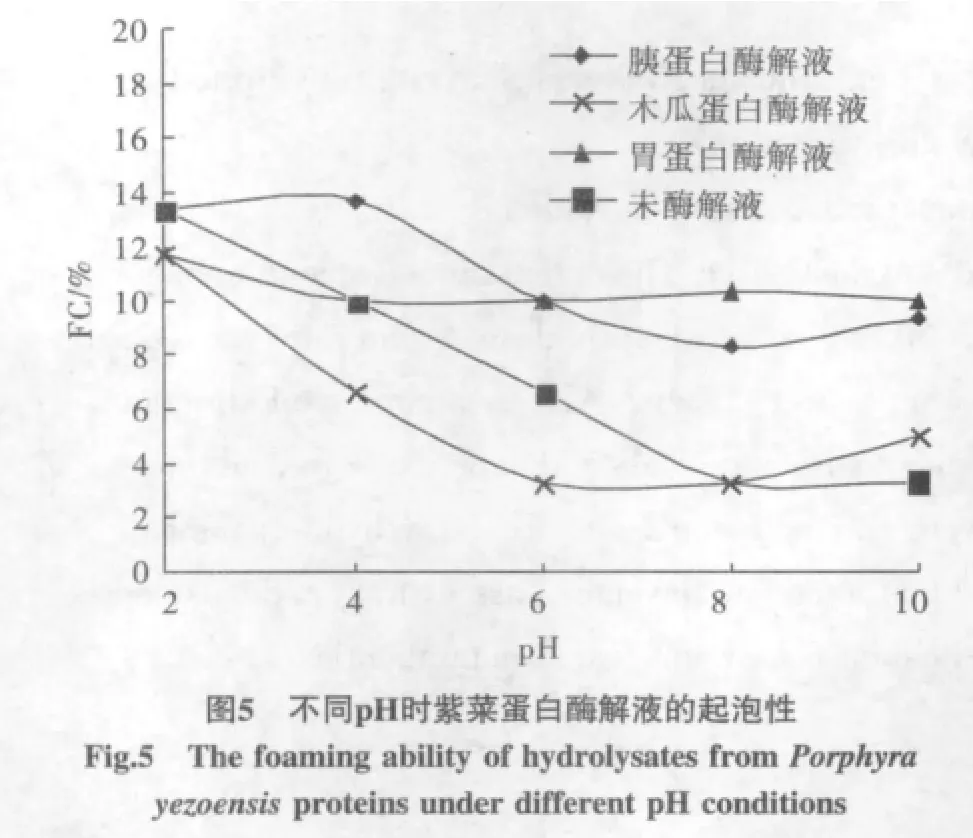
根据图5和图6,蛋白酶解液和未酶解液在酸性条件下起泡性皆较好,但未发现两者之间的明显差异;蛋白质起泡性与分子表面基团的极性有关,随着pH降低,极性基团增多,提高了表面疏水性,起泡性增强。在泡沫稳定性方面,胃蛋白酶和胰蛋白酶酶解液的泡沫稳定性较好,木瓜蛋白酶酶解液的泡沫稳定性较差;泡沫稳定性在pH3~6的酸性环境下较差,随着pH的升高,泡沫稳定性增加,由于决定泡沫稳定性的关键因素在于液膜的强度,而液膜强度主要取决于表面吸附膜的坚固性,当pH>6时表面活性较高,故泡沫稳定性也高。
3 结论
通过实验,确定了3种蛋白酶制备紫菜活性肽的适宜水解条件和制备工艺流程。
功能性研究结果表明,采用不同蛋白酶水解紫菜中的蛋白质,由于酶水解后,蛋白质被水解为短肽链,提高了紫菜蛋白的溶解性且在等电点附近不易沉淀,扩大了紫菜蛋白在食品工业中的应用范围;紫菜蛋白质酶解物乳化活性随着pH的升高而增强,但远不及原始蛋白质;酶解物在酸性条件下起泡性较好,其中胰蛋白酶解物起泡性最强。
[1]姚兴存,邱春江,穆春林.条斑紫菜营养成分与季节变化的研究[J].水产养殖,2002(5):34-35
[2]张水华.食品分析实验[M].北京:化学工业出版社,2006:45-49
[3]陈升军,熊华,李庭,等.米渣蛋白酶解及酶解物功能性质研究[J].食品与发酵工业,2008,34(5):114-118
[4]汪芳安,王慧溪,李永丽,等.米渣肽理化性质的研究[J].食品工业科技,2009,30(10):127-130
[5]郭兴凤,马维琦,张娟娟.酶法提取米渣中的蛋白质的功能性研究[J].河南工业大学学报:自然科学版,2009,30(10):4-8
Study on Preparation and Properties of Bioactive Oligopeptide from Porphyra yezoensis Proteins
YAO Xing-cun,LI Jing,SHU Liu-quan
(Jiangsu Key Laboratory of Marine Biotechnology,Huaihai Institute of Technology,Lianyungang 222005,Jiangsu,China)
In the research,Porphyra yezoensis proteins were hydrolyzed by papayin,trypsin and pepsin to prepare active peptides.The degree of hydrolysis was used as an index to optimize hydrolyzing conditions.Such properties as solubility,emulsibility,emulsion stability,foaming ability and foam stability of the peptides were also studied.The results showed that all of the three hydrolysates had good solubility and did not precipitate in the isoelectric point.The emulsibility and emulsion stability were not as good as Porphyra yezoensis proteins,and increased as pH rose.The foaming ability was good under the acidic condition,with trypsin hydrolysates the strongest.
Porphyra yezoensis;bioactive oligopeptide;hydrolyzing conditions;function properties
江苏省海洋生物技术重点建设实验室开放课题(2008HS015)
姚兴存(1963—),男(汉),副教授,本科,研究方向:海洋贝藻类精深加工与利用。
2011-03-13

