微波辅助萃取洛龙党参多糖的工艺优化
余兰,陈华,娄方明
(遵义医学院 药学系,贵州 遵义 563003)
党参出典于《本草从新》,为桔梗科植物党参[Codonopsis pilosula (Franch.) Nannf.], 素 花 党 参[Codonopsis pilosula Nannf.var.modesta(Nannf.)L.T.Shen]或川党参(Codonopsi tangshen Oliv.)的干燥根,是我国传统的补益药[1-3]。具有补中益气,健脾益肺,用于脾肺虚弱,气短心悸,食少便溏,虚喘咳嗽,内热消渴等病症[4]。党参的主要成分为多糖、皂甙、三萜醇、挥发油等,党参多糖作为党参功效成分之一,具有明确的增强免疫力、抗肿瘤、抗衰老等方面的药理作用[5]。贵州省道真县洛龙地区的洛龙党参,是川党参(Codonopsis tangshen Oliv.)的生态型变种,以肉质根食用或入药,又名单枝党、条党或蛮党,与“文党”、“潞党”齐名,且营养丰富,风味佳美,被视为菜肴中上品[6]。现代研究表明,党参多糖具有增强免疫力、抗肿瘤、防衰老以及抗疲劳等功效[7],被广泛地应用于医疗和保健行业,具有极大的开发和利用前景。所见文献中对“文党”、“潞党”多糖研究的报道较多,而对“洛党”多糖的文献鲜见报道。
植物多糖的提取大多采用直接水煎煮法和有机溶剂(如乙醚、乙醇、石油醚等)脱脂后水煎煮法[8],通常需要较长时间的萃取。微波具有穿透力强、选择性高、加热效率高等特点,微波辅助萃取技术已被应用于多种植物成分的萃取[9-10]。本文中探讨了微波辅助萃取法在洛龙党参多糖中的应用,并与传统索氏提取法进行了比较,取得了较好的结果。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
HITACHI U3010紫外分光光度计:HITACHI公司;AL204电子天平:METTLER TOLEDO 公司;MAS-II型常压微波合成/萃取反应工作站:上海新仪微波化学科技有限公司;FZ植物粉碎机:天津泰斯特仪器有限公司;Anke TGL-16C型高速离心机:上海安亭科学仪器厂;艾柯DZG-303A型纯水仪:成都唐氏康宁科技有限公司。
1.1.2 试剂
葡萄糖标准品:TREECHEM公司;用水为二次蒸馏水;浓硫酸、苯酚、正丁醇、氯仿、乙醚、乙醇试剂均为分析纯。
1.1.3 材料
洛龙党参药材,秋季挖取,洗净,阴干(样品由当地种植户提供,经遵义医学院药学系生药学教研室杨建文副教授鉴定为洛龙党参(Codonopsis tangshen Oliv.),粉碎,过60目筛,80℃干燥5 h备用。
1.2 洛龙党参多糖的提取
精密称取干燥洛龙党参粉末10.0 g,置于1000 mL三颈烧瓶中,加入95%乙醇提取2次,离心取残渣,回收乙醇液,用Sevag方法除蛋白2次,加适量蒸馏水,放置于MAS-II型常压微波合成/萃取反应工作站中,装好冷凝管,按正交表设计方法进行微波萃取。萃取结束后,离心取上清液,残渣及烧瓶用热水洗涤3次(50 mL×3),洗液并入上清液在1000 mL容量瓶,蒸馏水定容至刻度,摇匀。精密吸取该样品液5 mL于500 mL容量瓶中,稀释至刻度线,冰箱中保存备用,以测定其浓度。
1.3 洛龙党参多糖测定方法
1.3.1 5%苯酚溶液的配制
按文献[11]进行配制。
1.3.2 葡萄糖对照溶液的配制
精密称取105℃干燥至恒重的对照品D-葡萄糖11.54 mg,加水溶解,定容至100 mL容量瓶中,得葡萄糖对照品备用液,浓度为115.40μg/L。
1.3.3 标准曲线的绘制
精密吸取标准D-葡萄糖溶液0.0、0.1、0.3、0.5、0.7、0.9、1.1、1.3 mL标准葡萄糖溶液放入10 mL具塞试管中,用蒸馏水补足至2 mL,同时吸取2 mL蒸馏水作为空白对照。然后分别加入1 mL 5%苯酚溶液,7 mL浓硫酸(控制在15 s~20 s内完成),充分混匀后,迅速浸入沸水浴中加热15 min,取出冷却至室温,在分光光度计上扫描波长从300 nm~760 nm之间的吸光度。在490 nm处有最大吸收,测其吸光度值,以吸光度值(A)为纵坐标,多糖浓度(C)为横坐标,得标准曲线。数据经回归处理后,得回归方程:A=0.0704C(μg/mL)+0.1245,R2=0.9997。
1.3.4 样品多糖含量测定
用加样枪从稀释后的萃取液中取出1 mL,按照1.3.3,在490 nm处测其吸光度值,根据标准曲线求的洛龙党参多糖得率,其计算公式为:多糖得率=洛龙党参多糖含量/洛龙党参原料重量×100%,即洛龙党参多糖得率=CMV/W×100%。式中:C为样品液吸光度在标准曲线中查出得含糖量,(μg/mL);M为稀疏倍数,一般是50~250之间;V为样品溶液的体积,mL;W为样品质量,g。
2 结果与讨论
2.1 时间对洛龙党参多糖得率的影响
萃取过程中,温度过高时,多糖溶液很容易从冷凝管中冲出,造成试验结果不准。选择萃取温度为70℃,保证党参多糖能顺利溶出,又防止温度过高时多糖溶液冲出。准确称取10.0 g党参,以二次蒸馏水为萃取剂,在相同的微波功率(400 W)、固液比[1∶40(g/mL)]、微波辐射温度(70℃),萃取次数1次的条件下,对不同微波时间对微波辐射萃取洛龙党参多糖得率的影响进行了研究,结果见表1所示。

表1 时间对洛龙党参多糖得率的影响Table 1 The affection of time on the yield of polysaccharides
从表1可以得知,微波时间是影响多糖得率的一个重要因素,党参多糖得率随时间延长而增加。微波时间延长,党参中的多糖溶出增加,多糖得率提高。但微波辐射20 min后多糖的得率变化不大,综合考虑试验进度和能源因素,考察固液比和微波辐射功率对洛龙党参多糖得率的影响时,选择20 min作为微波萃取时间。
2.2 固液比对洛龙党参多糖得率的影响
准确称取10.0 g党参,以二次蒸馏水为萃取剂,固定萃取温度为70℃,微波功率400 W,微波辐射时间20 min,萃取次数1次的条件下,分别用不同固液比例进行萃取,结果见表2。

表2 固液比对洛龙党参多糖得率的影响Table 2 The affection of solid/solvent ratio on the yield of polysaccharides
表2可以看出,固液比增大,洛龙党参多糖得率增高,当固液比为1∶40(g/mL),多糖得率最高。
2.3 微波辐射功率对洛龙党参多糖得率的影响
准确称取10.0 g党参,以二次蒸馏水为萃取剂,固定萃取温度为70 ℃,固液比为1∶40(g/mL),微波辐照时间为20 min,萃取次数1次的条件下,考察不同微波辐射功率对洛龙党参多糖得率的影响,结果见表3。

表3 微波辐射功率对洛龙党参多糖得率的影响Table 3 The affection of radiation power on the yield of polysaccharides
由表3可以看出,洛龙党参多糖得率开始随微波辐射功率增大而增高,但当功率增大到500 W以后,多糖得率有下降趋势。
2.4 正交试验确定提取的最佳条件
在上述单因素试验的基础上,选定微波时间、微波辐射功率和固液比作为考察因素,洛龙党参多糖得率为指标,应用L9(33)正交试验设计进行试验研究,确定最佳提取工艺条件,因素水平见表4,试验结果见表5。据表5可知,根据极差的大小RB>RA>RC,所以影响微波辅助提取洛龙党参多糖的主要因素是:固液比>提取时间>微波提取功率。将实验结果进行方差分析,分析结果见表6。

表4 正交试验所选因素和水平表Table 4 Factors and levels of orthogonal experiment design

表5 正交试验设计表及结果Table 5 Arrangement and results of L9(33)orthogonal experiments
2.5 试验因素对洛龙党参多糖提取率影响的方差分析方差分析见表6。

表6 方差分析表Table 6 Analysis of variance
由表6方差分析结果可知,固液比对洛龙党参多糖得率有显著性影响,而微波时间和微波辐射功率对多糖得率无显著影响。
通过正交试验和数据处理考虑A、B、C三因素在3个水平上的变化,得出最佳提取条件。正交试验极差分析显示,影响洛龙党参多糖得率的主要因素是固液比,其次是微波时间和微波辐射功率,主次顺序为B>A>C;经分析可知,B因子(固液比)是高度显著的,根据K1、K2和K3的大小,最优水平应取B2,A是一般显著的,最优水平取A2,因子C的最优水平取C3,于是最佳工艺条件选择为A2B2C3,即在微波温度为70℃,微波辐射功率600 W,微波时间25 min,固液比为1∶40的条件下洛龙党参多糖得率为15.2%。
2.6 微波辅助萃取与传统索氏萃取洛龙党参多糖结果比较
精密称取干燥洛龙党参粉末10.0 g,加入400 mL的二次蒸馏水,置于1000 mL三颈烧瓶中,在温度70℃时,分别置于索氏提取器和MAS-II型常压微波合成/萃取反应工作站中(微波辐射声功率500 W)中,萃取时间20 min,其洛龙党参多糖得率及其多糖含量见表7。
3 结论
1)对洛龙党参多糖得率影响较大的因素是固液比,其次是微波辐射功率和微波时间。微波辅助萃取洛龙党参多糖的最佳工艺条件是:微波萃取温度70℃、微波时间25 min、微波辐射功率600 W、固液比为1∶40(g/mL)。
2)微波辅助萃取与常规索氏萃取法相比较,微波加热的热效率高,温度升高快速而均匀,能够使药材中的有效成分得以充分释出,缩短萃取时间,较大程度地提高多糖的萃取效率。采用微波辅助萃取洛龙党参多糖具有提取时间短、提取得率高、简便、平行性好,操作成本低、节约能源等优点,值得推广应用。
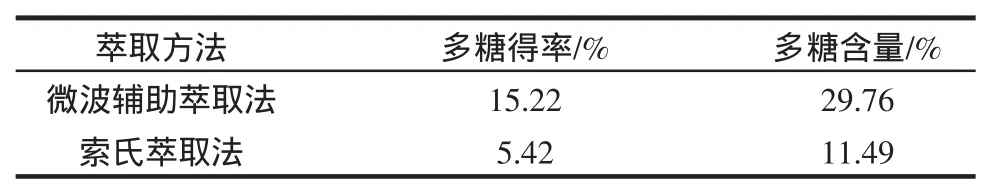
表7 微波辅助萃取与传统索氏萃取方法的比较(n=5)Table 7 Comparison of Microwave-assisted extraction to traditional Soxhlet extraction method
[1]南京中医学院.中药学概论[M].北京:人民卫生出版社,1959:185-186
[2]王世民.党参出典小考[J].山西中医,2005,21(6):42-43
[3]田源红,任永全,龙安.党参不同炮制品中微量元素的含量测定[J].微量元素与健康研究,2001,18(2):45-46
[4]国家药典委员会.中华人民共和国药典一部[S].1版.北京:化学工业出版社,2005:199
[5]杨光,李发胜,刘辉,等.党参多糖对小鼠免疫功能的影响[J].中国药物与临床,2005,21(4):39
[6]韩丰.洛党参的经济价值及产业化发展的前景探讨[J].贵州农业科学,2009,37(2):154-157
[7]韩凤梅,程伶俐,陈勇.板桥党参多糖的分离纯化及组成研究[J].中国药学杂志,2005,40(18):1381-1383
[8]倪艳,苏强,刘霞,等.黄芪多糖水煎提取工艺的优化试验研究[J].中国中药杂志,1998,23(5):284
[9]高梦祥,刘恒蔚,宗明远.采用微波技术提取海带多糖的工艺研究[J].食品研究与开发,2006,27(8):69-71
[10]鲁建江,王莉,刘志勇,等.微波技术辅助测定黄芪中总黄酮和多糖的含量[J].中成药,2003,25(3):246-247
[11]张大伟,张永亮,昆道列提,等.红松松子壳酸性多糖最佳提取条件研究[J].时珍国医国药,2006(6):997-999

