天然沸石对阳离子染料中性红的吸附及机理研究
邹卫华, 白红娟, 李 苛, 赵亚婔, 韩润平
(1.郑州大学 化工与能源学院 河南 郑州 450001; 2.郑州大学 化学系 河南 郑州450001)
天然沸石对阳离子染料中性红的吸附及机理研究
邹卫华1, 白红娟1, 李 苛1, 赵亚婔1, 韩润平2
(1.郑州大学 化工与能源学院 河南 郑州 450001; 2.郑州大学 化学系 河南 郑州450001)
研究了天然沸石对中性红的吸附及其作用机理,考察了吸附剂用量、pH值、盐浓度、振荡时间、中性红初始质量浓度、温度等因素对沸石吸附中性红的影响. 结果表明,吸附量随着吸附剂用量的增加而减少,但随着溶液pH值的增大、温度的升高以及盐浓度的降低而增加;吸附过程符合Langmuir吸附等温式. 温度从288 K升高到308 K,中性红的饱和吸附量从14.79 mg/g升高到31.78 mg/g.利用准二级动力学方程及粒子内扩散方程检验了吸附过程的动力学性质,结果表明,其吸附过程的速率控制步骤为膜扩散控制,并随溶液初始质量浓度的增加准二级速率常数降低,面内扩散速率常数增加.
沸石; 中性红; 吸附
0 引言
合成染料具有性质稳定、成本低、品种多等优点,广泛应用于纺织、造纸、橡胶、塑料、化妆品、制药和食品工业中.合成染料废水浓度高、色度高、毒性高且水质变化大,其处理技术长期以来一直是个难点.为此,国内外已试用多种方法和技术,如化学混凝法、离子交换法、臭氧氧化法、H2O2及Fenton试剂法、电化学法、光催化降解法和吸附法等[1],其中,吸附法是广泛使用的去除水中难降解污染物的有效方法.
沸石是一种天然廉价矿物,具有较高的化学和生物稳定性,吸附性能优良,既可用于去除水中氨氮、有机污染物,又可用于去除水中重金属离子,在水和废水处理中具有广泛的应用前景[2-5].作者以中性红为研究对象,用分光光度法研究了天然沸石对中性红的吸附行为,探讨了pH值、吸附时间、吸附剂用量、温度、中性红初始质量浓度及盐浓度等因素对中性红的吸附影响,分别利用热力学和动力学模型探讨了中性红/沸石的吸附热力学、动力学特性及其吸附机理.
1 材料和方法
1.1材料和仪器
材料源自河南省信阳市的天然斜发沸石,取20~40目进行吸附实验.沸石的红外光谱主要由吸收的水份、沸石的骨架振动及Si—O或Al—O的振动引起.沸石表面粗糙,XRD分析表明该沸石属斜发沸石,EDS分析表明沸石主要由硅、铝、氧及钾等元素组成[6-7].中性红、NaOH、HCl等均为分析纯.
721分光光度计(上海第三仪器有限公司);SHZ-82恒温气浴振荡器 (常州国华电器有限公司).
1.2实验方法
采用静态法进行实验,将3 g/L天然沸石放入50 mL锥形瓶中(吸附剂用量实验除外),加入一定质量浓度的中性红溶液10 mL,在振荡器上进行吸附.一定时间后取上清液用光度法测定中性红的质量浓度,计算单位质量的沸石对中性红的吸附量.吸附温度分别控制在288,298和308 K.
1.3中性红的测定
采用可见分光光度法,在pH为4.5左右,530 nm处测量吸光度,根据吸光度与中性红的质量浓度在一定范围内呈线性关系进行中性红的测定.
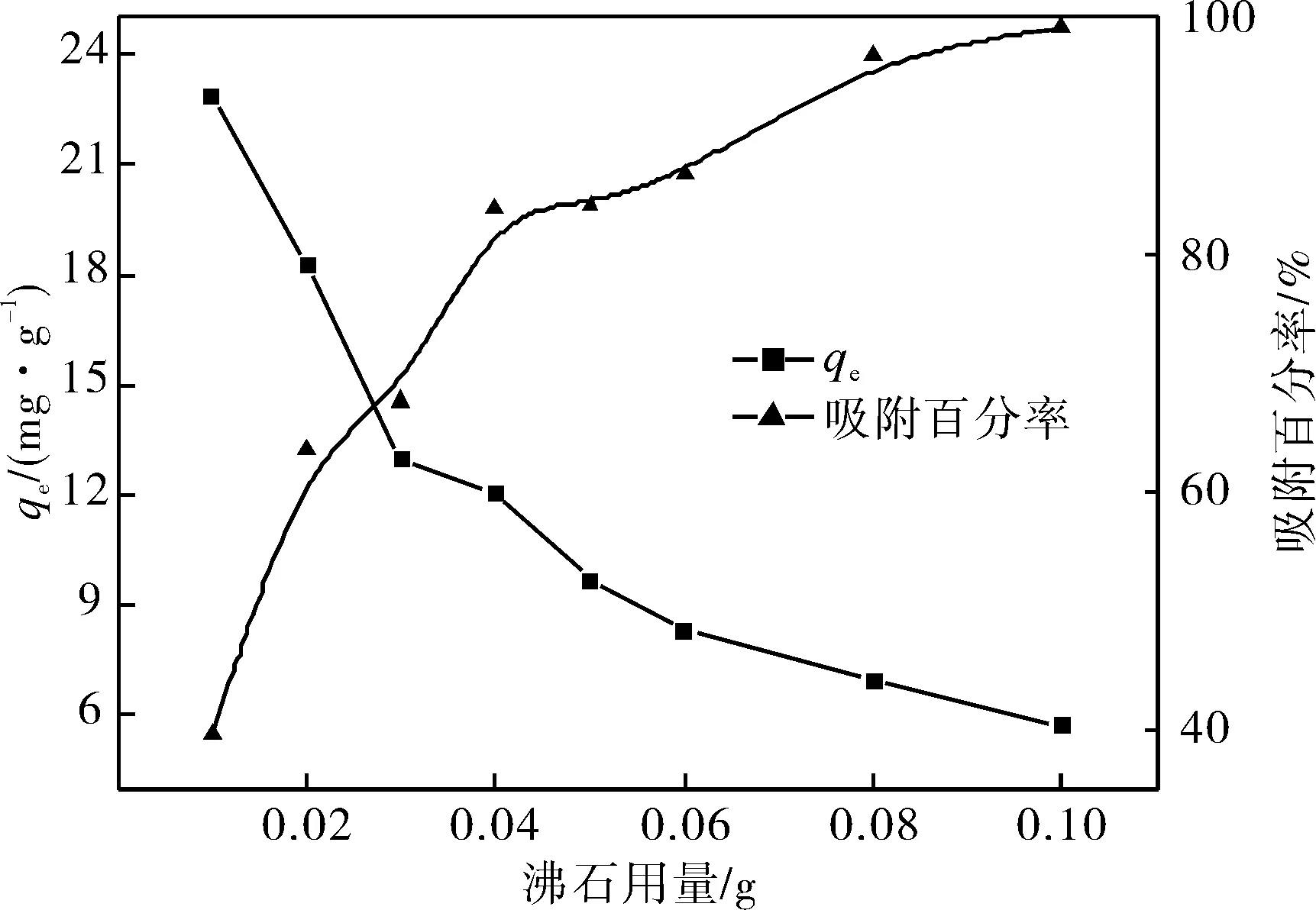
图1 沸石用量对中性红吸附的影响Fig.1 Effect of zeolite dosage on adsorpbion of neutral red
2 结果与讨论
2.1沸石用量对中性红吸附的影响
取数份60 mg/L的中性红吸附液10 mL,分别加入0.01~0.10 g的沸石,在288 K振荡8 h. 以吸附量和吸附百分率对吸附剂用量作图,结果见图1.
从图1可以看出,随着沸石用量的增加,沸石对中性红的吸附量逐渐降低,而吸附百分率随吸附剂用量的增加而逐渐增大.这是因为吸附剂用量的增加提供了更多的活性吸附点位,可以吸附去除更多的染料分子,因此去除率是随着沸石用量的增加而增加的;而由于每个体系中染料分子的数量是相等的,活性吸附点位的增加就导致了单位质量吸附剂吸附染料分子的质量降低,因此单位吸附量是随着沸石用量的增加而降低的.这种现象与文献[8-9]报道的类似.
2.2pH值对中性红吸附的影响
中性红溶液的初始质量浓度为60 mg/L,调节溶液pH分别为1~7,以吸附量qe对pH值作图,结果如图2所示.pH在1~4时,随pH的升高,中性红的吸附量不断增加,当pH约为4时,吸附量达到最大.在pH为4~7范围内,吸附量变化不大.在水溶液中,中性红以阳离子形式存在,pH较低时,沸石表面被较多的H+包围,与中性红阳离子竞争结合吸附剂表面的活性点位;pH较高时,沸石表面带负电荷,通过静电引力结合较多的中性红阳离子.鉴于上述实验结果,在以后的实验中调节溶液的pH值为4.5.
2.3盐浓度对中性红吸附的影响
中性红溶液的初始质量浓度为60 mg/L,在288 K振荡8 h.KCl、NaCl及CaCl2对吸附量的影响如图3所示.
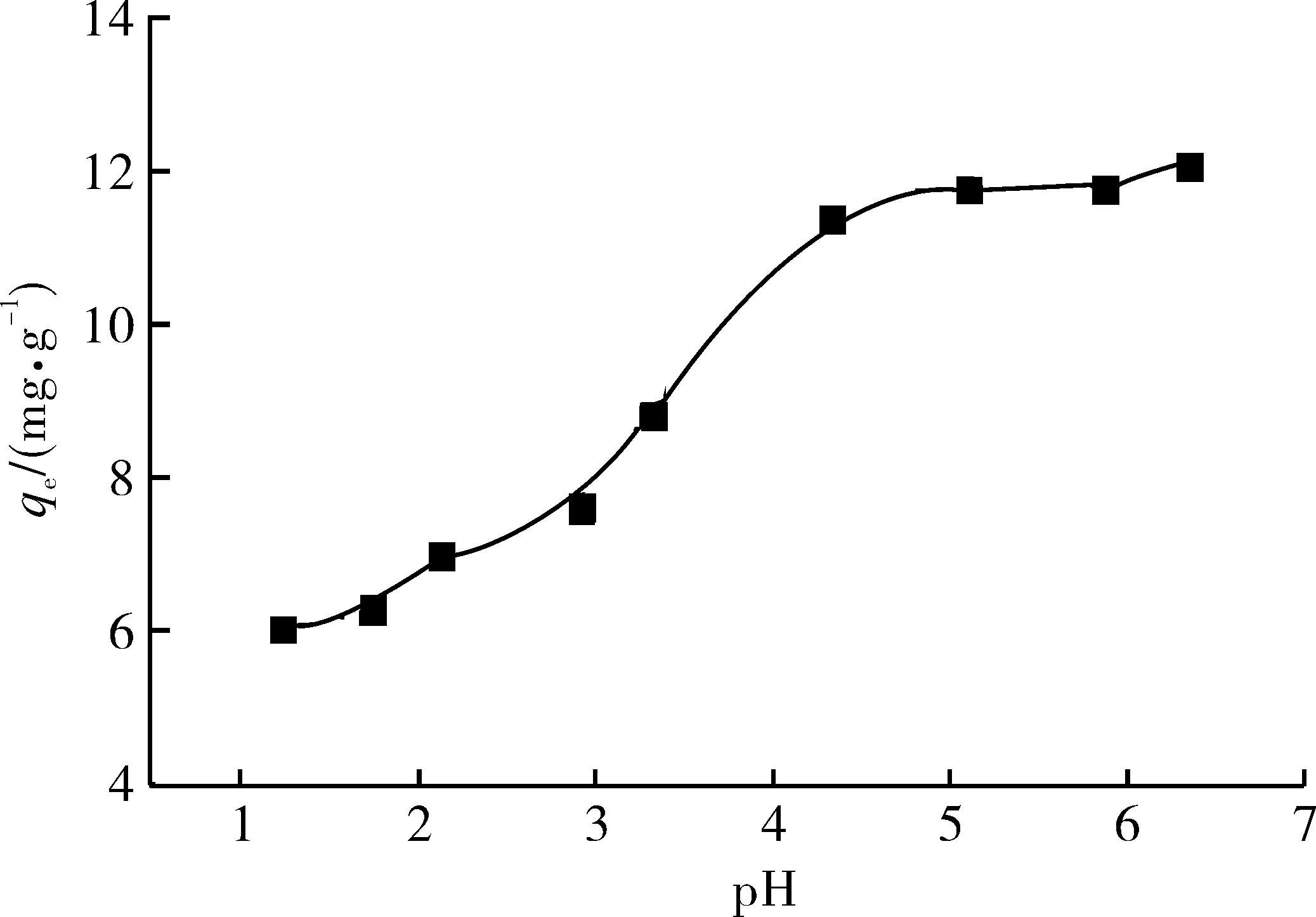
图2 pH值对中性红吸附的影响Fig.2 Effect of initial pH on adsorption of neutral red
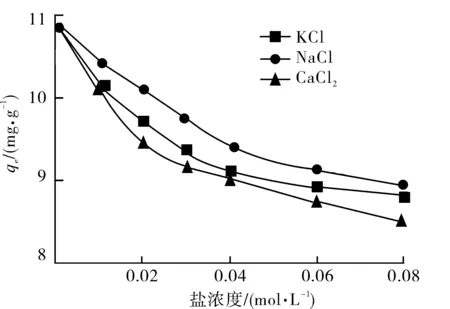
图3 盐浓度对中性红吸附的影响Fig.3 Effect of salt concentration on adsorption of neutral red
由图3可以看出,沸石对中性红的吸附量随着盐浓度的增加而降低,表明阳离子染料与支持电解质之间存在竞争吸附.Ca2+对吸附的影响大于Na+和K+,而K+的影响大于Na+,说明共存离子对阳离子染料的影响与其化合价以及离子的水合半径等性质有关[10-11].
2.4中性红的吸附等温线及热力学研究
在中性红初始质量浓度范围为10~150 mg/L的吸附液中(pH为4.5),加入0.03 g粒径为20~40目的沸石,分别在288,298和308 K 条件下吸附8 h,吸附等温线如图4所示.
从图4可以看出,在中性红的初始质量浓度较低时,沸石对中性红的吸附量增幅较大;当初始质量浓度超过60 mg/L时,中性红的吸附量增幅减缓,随着质量浓度进一步增大,吸附逐渐达到饱和.温度从288 K升高到308 K,沸石对中性红的吸附量增大.
选取常见的Langmuir等温吸附方程[12],将不同温度下沸石吸附中性红的实验数据与方程进行非线性拟合分析.Langmuir 吸附等温式为
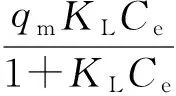
(1)
式中:qe为平衡吸附量;qm为饱和吸附量;KL为吸附平衡常数;Ce为吸附平衡后阳离子染料的质量浓度.
根据实验结果,依式(1)作图,得Langmuir吸附等温式参数.在不同温度下,沸石对中性红的吸附符合Langmuir等温吸附模型 (R均大于0.970). 温度从288,298 K升高到308 K,吸附平衡常数KL依次从0.040,0.028降低到0.017,而中性红的饱和吸附量qm依次从14.79,18.84 mg/g升高到31.78 mg/g,表明沸石对中性红的吸附过程是吸热的.
2.5接触时间对中性红吸附的影响及吸附动力学研究
在288 K时,不同中性红质量浓度下接触时间对沸石吸附中性红的影响如图5所示.可以看出,沸石对中性红的吸附过程分为3个阶段:初期是快速过程;20 min以后,吸附速率明显减慢,进入中速过程;150 min后进入慢速阶段,吸附8 h后基本达到平衡.达到中性红吸附平衡所需时间在很大程度上与初始质量浓度有关,对于质量浓度为60,80和100 mg/L的中性红溶液,分别在180,300和420 min之后,中性红的吸附量增加缓慢,基本达到动态平衡.

图4 不同温度下的吸附等温线与Langmuir模型的非线性拟合曲线Fig.4 Adsorption isotherm curves at different temperatures and Langmuir isotherm curve
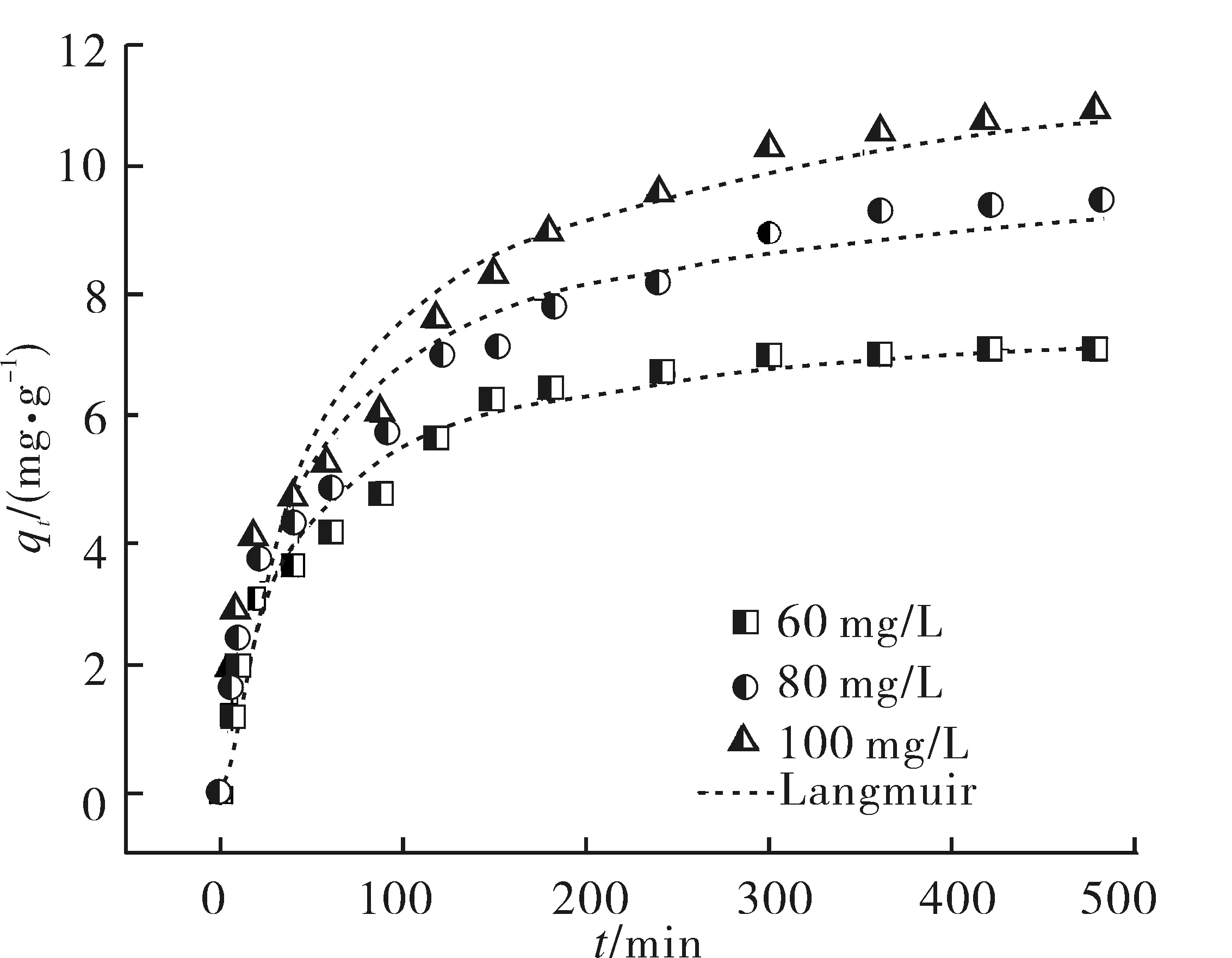
图5 不同中性红质量浓度下接触时间对吸附的影响Fig.5 Effect of contact time on neutral red adsorption at various initial concentrations
时间对吸附的影响可用动力学方程来预测.准二级动力学方程是常用的动力学方程之一[13],其非线性形式为
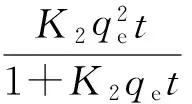
(2)
式中:K2是吸附速率常数;qe和qt分别是吸附平衡时和吸附过程中任意时间t时的吸附量.将实验数据根据式(2)进行非线性拟合,所得动力学参数和相关系数见表1.
由表1中可以看出,对于3种不同初始质量浓度的中性红溶液,准二级动力学模型的相关系数均大于0.980,而且所计算得到的平衡吸附量值与实际平衡吸附量值基本符合,说明用准二级动力学方程可以预测时间对吸附的影响.该吸附过程符合准二级动力学方程也说明吸附是化学吸附[13].
由表1显示,准二级速率常数K2随着溶液初始质量浓度的增加而减小,从图5可以看出,吸附达到动态平衡所需要的时间随溶液质量浓度的增加而增加,这种变化趋势与文献[8,14-15]报道的实验结果有类似规律.
2.6吸附机理
按照Weber和Morris理论,粒子内扩散方程[16]为
qt=kidt1/2+C,
(3)
式中:kid是粒子内扩散速率常数;C表示膜扩散程度.以qt对t1/2作图,可将图中曲线分为两部分:初始部分代表膜扩散,后续部分代表粒子内扩散[17-18].图6显示,整个吸附过程分为初始部分的膜扩散阶段和后续部分的内扩散阶段,同时发现溶液的初始质量浓度与吸附过程的控制步骤有较大关系,溶液初始质量浓度越大,截距越大,吸附剂表面吸附作用在速率控制步骤中的影响越大,kid也越大(见表1).
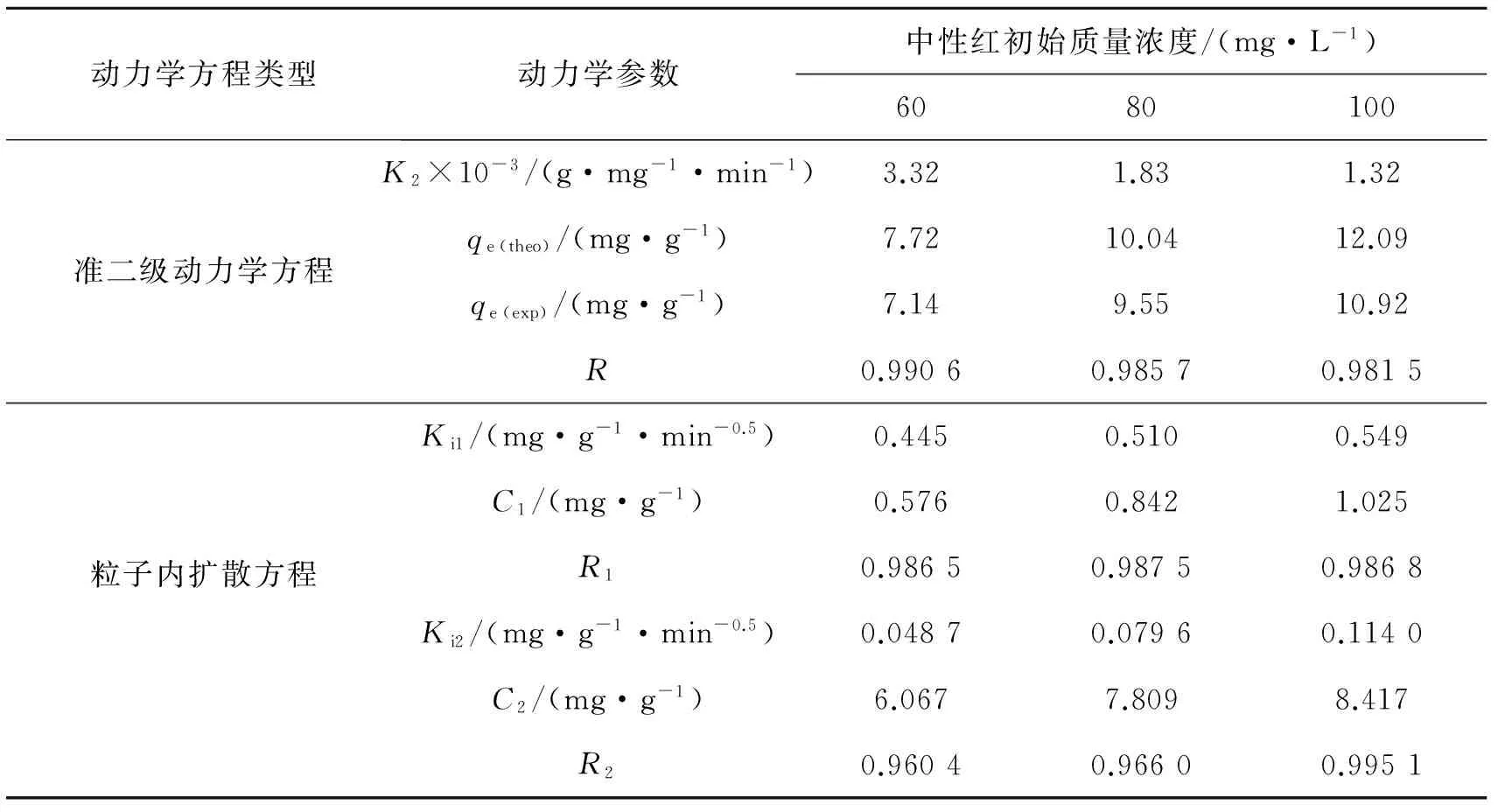
表1 中性红不同质量浓度下沸石对中性红的吸附动力学参数
为了预测吸附过程中速率控制步骤,用Boyd动力学方程[19]进一步分析动力学数据. Boyd动力学方程为
(4)
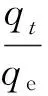
(5)
Bt是F的函数,其值在不同的吸附时间可以通过式(5)计算得到.以Bt对t作图(见图7),B值为图中直线的斜率,通过该图可以区别吸附是属于膜扩散控制还是粒子内扩散控制.如果直线通过原点,则说明吸附控制步骤为粒子内扩散控制,否则为膜扩散控制[20].
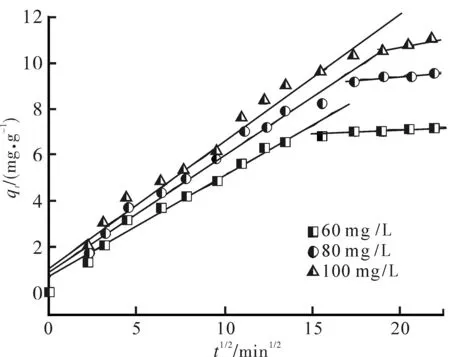
图6 288 K时沸石吸附中性红的粒子内扩散图Fig.6 Intraparticle diffusion plot for neutral red on zeolite at 288 K
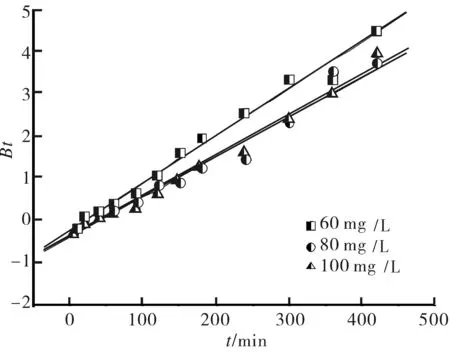
图7 沸石吸附中性红的Bt对t图Fig.7 Plot of Bt vs. t for neutral red on zeolite
从图7中可以看出,不同质量浓度所对应的直线均不通过原点,说明速率控制步骤为膜扩散控制.对于质量浓度为60,80和100 mg/L的中性红溶液,B值分别为0.011 2,0.009 58和0.009 46 min-1.
不同初始质量浓度的有效扩散系数Deff可通过式(6)并结合图7计算得到[21]:
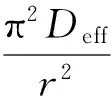
(6)
式中:Deff为吸附质在吸附剂中的有效扩散系数;r为假设为球状的吸附质粒子的半径.假设所用吸附剂沸石为球形,粒径平均为30目,计算所得Deff值分别为4.27×10-6,3.65×10-6和3.61×10-6cm2/s, 比Deff值为10-11cm2/s(粒子内扩散为控制步骤[22])的大5个数量级,表明沸石对中性红的吸附控制步骤为膜扩散控制[23-24].
3 结论
研究结果表明,天然沸石对阳离子染料中性红具有很好的去除效果.在288 K时,沸石对中性红的最大吸附量为14.79 mg/g,并且随着温度升高吸附量增大. 吸附等温线符合Langmuir方程,吸附过程符合准二级动力学模型和粒子内扩散模型,随溶液初始质量浓度的增大,由模型拟合得到的准二级速率常数减小,粒子内扩散速率常数增大.由Boyd动力学方程分析表明,中性红在沸石上的吸附控制步骤为膜扩散控制.
[1] 程云,周启星,马奇英,等.染料废水处理技术的研究与进展[J].环境污染治理技术与设备,2003,4(6): 56-60.
[2] Babel S,Kurniawan T A. Low-cost adsorbents for heavy metals uptake from contaminated water: a review[J]. Journal of Hazardous Materials,2003,97(1/3): 219-243.
[3] Sismanoglu T,Pura S. Adsorption of aqueous nitrophenols on clinoptilolite[J]. Colloids and Surfaces A,2001,180(1/2): 1-6.
[4] 何少华,黄仕元,金必慧.沸石在水和废水处理中的应用[J].矿业工程,2004,2(1): 24-27.
[5] 朱俊,王宁.天然沸石在环保中的应用[J].矿物学报,2003,23(3): 250-254.
[6] 杨贯羽,朱路,李延虎,等.天然沸石红外光谱X粉末衍射及扫描电镜分析[J].安阳师范学院学报,2006(2): 77-78.
[7] 邹卫华.锰氧化物改性过滤材料对铜和铅离子的吸附研究[D].长沙:湖南大学,2006.
[8] Zou Weihua,Han Pan,Li Yinli,et al. Equilibrium,kinetic and mechanism study for the adsorption of neutral red onto rice husk[J]. Desalination and Water Treatment,2009,12(1/3): 210-218.
[9] Han Runping,Han Pan,Cai Zhaohui,et al. Kinetics and isotherms of neutral red adsorption on peanut husk[J]. Journal of Environmental Sciences,2008,20(9): 1035-1041.
[10] Bowman R S,O’connor G A. Control of nickel and strontium sorption by free metal ion activity[J]. Soil Sci Soc Am J,1982,46(5): 933-936.
[11] 邹卫华,陈宗璋,韩润平,等. 锰氧化物/石英砂(MOCS)对铜和铅离子的吸附研究[J]. 环境科学学报,2005,25(6):779-784.
[12] Langmuir I. The constitution and fundamental properties of solids and liquids[J].J Am Chem Soc,1916,38(11): 2221-2295.
[13] Ho Y S. Second-order kinetic model for the sorption of cadmium onto tree fern: a comparison of linear and nonlinear methods[J]. Water Res,2006,40(1): 119-125.
[14] Zou Weihua,Han Runping,Chen Zongzhang,et al. Kinetic study of adsorption of Cu(Ⅱ) and Pb(Ⅱ) from aqueous solutions using manganese oxide coated zeolite in batch mode[J]. Colloids Surfaces A,2006,279(1/3):238-246.
[15] 解瑞,彭金辉,张利波,等. 废催化剂再生后对甲基橙的吸附动力学研究[J]. 环境科学导刊,2009,28(3): 10-13.
[16] Walker G M,Hansen L,Hanna J A,et al. Kinetics of a reactive dye adsorption onto dolomiteic sorbents[J]. Water Res,2003,37(9):2081-2089.
[17] Vadivelan V,Kumar K V. Equilibrium,kinetics,mechanism,and process design for the sorption of methylene blue onto rice husk[J]. J Colloid Inter Sci,2005,286(1): 90-100.
[18] Sivaraj R,Namasivayam C,Kadirvelu K. Orange peel as an adsorbent in the removal of acid violet 17(acid dye) from aqueous solutions[J].Waste Manag,2001,21(1): 105-110.
[19] Chingombe P,Saha B,Wakeman R J. Sorption of atrazine on conventional and surface modified activated carbons[J]. J Colloid Inter Sci,2006,302(2): 408-416.
[20] Mohan D,Singh K P. Single- and multi-component adsorption of cadmium and zinc using activated carbon derived from bagasse-an agricultural waste[J]. Water Res,2002,36(9): 2304-2318.
[21] Boyd G E,Adamson A W,Myers Jr L S. The exchange adsorption of ions from aqueous solutions by organic zeolites: II. kinetics[J]. J Am Chem Soc,1947,69(11): 2836-2848.
[22] Singh K K,Rastogi R,Hasan S H. Removal of Cr(VI) from wastewater using rice bran[J]. J Colloid Inter Sci,2005,290(1): 61-68.
[23] Kumar K V,Ramamurthi V,Sivanesan S. Modeling the mechanism involved during the sorption of methylene blue onto fly ash[J]. J Colloid Inter Sci,2005,284(1): 14-21.
[24] Hameed B H,El-Khaiary M I. Equilibrium,kinetics and mechanism of malachite green adsorption on activated carbon prepared from bamboo by K2CO3activation and subsequent gasification with CO2[J]. J Hazard Mater,2008,157(2/3): 344-351.
AdsorptionPropertiesandMechanismofNeutralRedonNaturalZeolite
ZOU Wei-hua1, BAI Hong-juan1, LI Ke1, ZHAO Ya-fei1, HAN Run-ping2
(1.SchoolofChemicalEngineeringandEnergy,ZhengzhouUniversity,Zhengzhou450001,China;2.DepartmentofChemistry,ZhengzhouUniversity,Zhengzhou450001,China)
The adsorption of neutral red onto natural zeolite in aqueous solutions was investigated. Experiments were carried out as function of adsorbent dosage,pH,salt concentration,contact time,initial dye concentration and temperature. The results showed that as the dose of zeolite and salt concentration increased,the adsorption capacities of neutral red decreased,but increased with the increase in pH and temperature. The equilibrium data was fitted well by the Langmuir model. According to the evaluation with the Langmuir equation,the maximum adsorption capacities of neutral red onto zeolite increased from 14.79 mg/g to 31.78 mg/g with temperature increasing from 288 K to 308 K. The kinetics of adsorption of neutral red was discussed using the pseudo-second-order and the intraparticle diffusion model.The adsorption process was controlled by membrane diffusion,the pseudo-second-order rate constant was decreased and intraparticle diffusion rate constant was increased with increasing initial neutral red concentration.
zeolite;neutral red;adsorption
X 703
A
1671-6841(2011)04-0071-06
2011-06-12
河南省科技攻关资助项目,编号102102210103;河南省教育厅科技攻关资助项目,编号2010A610003.
邹卫华(1967-),女,副教授,主要从事环境分析研究, E-mail:whzou@zzu.edu.cn.

