La2CoAlO6催化剂的制备及其甲烷催化燃烧性能
张慧敏 胡瑞生,* 胡佳楠 张玉龙
(1内蒙古大学化学化工学院,稀土材料化学与物理重点实验室,呼和浩特010021; 2Western Research Institute,365 N 9St,Laramie,Wyoming,USA)
La2CoAlO6催化剂的制备及其甲烷催化燃烧性能
张慧敏1胡瑞生1,*胡佳楠1张玉龙2
(1内蒙古大学化学化工学院,稀土材料化学与物理重点实验室,呼和浩特010021;2Western Research Institute,365 N 9St,Laramie,Wyoming,USA)
采用溶胶-凝胶法,以柠檬酸为络合剂制备了新型稀土双钙钛矿催化材料La2CoAlO6,利用X射线粉末衍射(XRD)、H2-程序升温还原(H2-TPR)、比表面(BET)、扫描电镜(SEM)、傅里叶变换红外(FT-IR)光谱和磁性测试等手段对其进行了表征,以甲烷催化燃烧反应为探针考察了其催化活性.结果表明,在空气气氛中,经过1100°C焙烧3 h后,可以形成稳定的单相稀土双钙钛矿型化合物La2CoAlO6,且该化合物表现出较好的甲烷催化燃烧活性,起燃温度(T10)和完全转化温度(T90)分别为434.1和657.4°C.与稀土单钙钛矿型催化剂LaCoO3和LaAlO3相比,其T10分别降低了56.5和138.2°C,T90分别降低了84.6和108.9°C.H2-程序升温还原结果表明,稀土双钙钛矿型化合物La2CoAlO6有较低的还原温度,并且经过H2-程序升温还原反应后,La2CoAlO6样品XRD图中的所有衍射峰均向小角度方向发生了移动.扫描电子显微镜的结果表明,稀土双钙钛矿型催化剂La2CoAlO6表现出无规则的片状形貌及较强的抗烧结性.此外还发现稀土双钙钛矿型催化剂La2CoAlO6的磁滞回线较为特殊.
稀土;双钙钛矿;单钙钛矿;甲烷催化燃烧;溶胶-凝胶法
1 引言
甲烷催化燃烧可以在较低的温度下完全高效地燃烧,减少NOx等污染物的生成,具有节能减排的作用,近年来引起了人们的极大兴趣.1,2在常用的甲烷催化燃烧体系中,贵金属催化剂低温活性突出,3,4但价格昂贵、热稳定性差,在高温下容易烧结失活,限制了其应用.单钙钛矿型化合物(ABO3)具有高的热稳定性、化学可裁剪性以及氧化还原性等,5近年来作为甲烷高温燃烧催化剂得到了广泛的关注,并取得了一些成果.6-8但到目前为止,双钙钛矿型化合物(A2B′B″O6)作为甲烷高温燃烧催化剂的研究报道尚不多见.
早在上世纪50年代末,双钙钛矿型化合物就相继被人们发现和制备,但自1998年Kobayashi等人9报道了双钙钛矿结构多晶材料Sr2FeMoO6有巨磁电阻以后,双钙钛矿材料才引起了人们的关注和重视.10在随后的短短几年内,物理学界对其相关体系材料的电、磁性质及输运性质展开了大量广泛的研究.11-13然而化学界对双钙钛矿型化合物的研究相对较少,2004年Falcón等人14首次报道了双钙钛矿型化合物Sr2FeMoO6作为甲烷高温燃烧催化剂,并且表现出良好的甲烷催化燃烧活性.本文采用柠檬酸溶胶-凝胶法,在空气气氛中1100°C焙烧3 h后,成功制备出了新型稀土双钙钛矿型催化剂La2CoAlO6,以甲烷催化燃烧反应为探针考察了其催化活性,并与相对应的稀土单钙钛矿型催化剂LaCoO3和LaAlO3的甲烷催化燃烧性能进行了比较,得到了一些有意义的结果.
2 实验部分
2.1 试剂与仪器
实验所用试剂:La(NO3)3·6H2O,Co(NO3)2· 6H2O,柠檬酸(分析纯,国药集团化学试剂有限公司);Al(NO3)3·9H2O(分析纯,北京化学试剂有限公司).
样品的XRD测试是在德国BRUKER公司D8ADVANCE型X射线衍射仪上进行的.测试条件为Cu-Kα辐射源,工作电压40 kV,工作电流100 mA,扫描范围10°-80°,扫描速率2(°)·min-1.H2-程序升温还原(H2-TPR)是在TP-5000型多用吸附仪(天津先权仪器公司制造)上完成的.以H2和N2的体积比为5:95的混合气为还原气,流量为50 mL·min-1,热导池检测器检测耗氢量,升温速率10°C·min-1,最高还原温度900°C.比表面积(BET)的测定是在美国Micromeritics公司的ASAP2020M型表面孔径分析仪上完成.以高纯氮(99.999%)为吸附气体,液氮温度为吸附温度,BET方程计算比表面.样品的扫描电镜测试是在日本日立公司S-3400N型扫描电镜上进行的,加速电压15.0 kV.傅里叶变换红外(FTIR)光谱测试采用美国Nicolet Nexus FT-IR670型红外分光光度计,KBr压片.磁性测量采用美国LareShore7407-型振动催化剂磁强计,测量温度为295 K,控温精度为0.1 K,测量精度为10-7A·m2.
2.2 催化剂的制备
按一定摩尔比将La(NO3)3·6H2O、Co(NO3)2· 6H2O和Al(NO3)3·9H2O溶于去离子水中,搅拌得透明溶液,加入适量的柠檬酸以使其充分络合,70°C水浴热缩得透明粘稠状胶体,100°C干燥24 h得干胶,500°C焙烧3 h得氧化物原粉,最后该氧化物原粉再经1100°C焙烧3 h,制备出1#样品双钙钛矿型La-Co-Al-O体系催化剂.为了进行比较,我们以同种方法合成了2#样品单钙钛矿型La-Co-O体系和3#样品单钙钛矿La-Al-O体系催化剂.
2.3 催化剂的活性测试
采用常压固定床石英反应器(直径10 mm)进行催化剂活性的测试.催化剂颗粒为40-60目,用量为200 mg.反应混合气CH4:O2:N2的组成为2:18:80(体积百分比).气体流速由质量流量计控制,空速为48000 h-1.采用程序升温控制仪控制反应温度,采用佛山分析仪器厂的FQ-W型CH4红外分析仪分析与计算该反应在不同温度下达到稳定后的CH4转化率.
3 结果与讨论
3.1 催化剂物相分析
理想的立方单钙钛矿结构(ABO3)可以看作是在BO6八面体里结合A离子所形成的固溶体.各离子半径间满足下列关系:RA+RO=21/2(RB+RO)(其中, RA、RB、RO分别为A位离子半径、B位离子半径、O离子半径),但实际上钙钛矿结构可能存在偏差,可由Goldschmidt容忍因子t来度量:t=(RA+RO)/21/2(RB+ RO).当t=1.0时,对应的是理想立方晶系的钙钛矿结构;当0.75<t<1时,ABO3化合物也能具有稳定的钙钛矿结构,且根据离子大小不同可以形成六方、立方、正交等晶系.15,16对于双钙钛矿A2B′B″O6结构来说,RB=0.5(RB′+RB″).14,17由上述两公式计算出三种催化剂La2CoAlO6、LaCoO3、LaAlO3的容忍因子分别为0.830、0.811、0.899,列于表1中,可见从容忍因子角度看,它们均具备生成稳定钙钛矿型化合物的能力.
图1为经1100°C焙烧3 h后三种催化剂的XRD谱图,其比表面积、平均粒径和晶胞参数见表1.从图中可以看出,La2CoAlO6(1#样品)在2θ为23°、32°、40°、46°、52°、58°和68°附近出现了钙钛矿结构的特征衍射峰,没有杂相峰的出现,结合文献报道,18可以确定所制备的样品形成了单相的稀土双钙钛矿型化合物La2CoAlO6.LaCoO3(2#样品)和LaAlO3(3#样品)的XRD谱图分别与LaCoO3标准卡片(JCPDS 48-0123)和LaAlO3标准卡片(JCPDS 31-0022)相一致,且没有杂相峰的出现,说明分别形成了单相的稀土单钙钛矿型化合物LaCoO3和LaAlO3.双钙钛矿La2CoAlO6与单钙钛矿LaAlO3、LaCoO3相比较,其部分衍射峰发生了少许偏移但不明显.从表1中可知, LaAlO3有较大的比表面积(9.44 m2·g-1),但结合活性曲线可知其催化活性最差;LaCoO3的活性较好,比表面积却较小(0.72 m2·g-1);La2CoAlO6比表面积(1.10 m2·g-1)较LaCoO3有所提高,这说明比表面积不是影响催化剂活性的关键因素,在钙钛矿结构中不同的B位元素对催化剂甲烷燃烧活性有较大的影响.19同时催化剂比表面积在甲烷燃烧反应前后的变化不到20%,说明三种催化剂在经过1100°C焙烧后,具有良好的热稳定性.从表1中催化剂的晶胞参数可知,La2CoAlO6、LaAlO3和LaCoO3均为六方晶系,结构偏离理想的立方晶系,这是由于所制备的三种钙钛矿结构催化剂的容忍因子t偏离1.0,从而使其晶体结构发生畸变所致.20

图1 样品的XRD谱图Fig.1 XRD patterns of samples(a)La2CoAlO6,(b)LaCoO3,(c)LaAlO3
3.2 催化活性分析
图2是催化剂的甲烷催化燃烧活性曲线,通常甲烷燃烧催化剂的活性可以用三个性能指标去进行初步评价,即甲烷转化10%时的温度(通常称为起燃温度,用T10表示)、甲烷转化50%的温度(用T50表示)和甲烷转化100%温度(用T100表示,有时也用T90来近似地表示完全转化温度),转化温度越低,甲烷催化燃烧活性越好.我们将这三个性能指标列于表2中.由图2和表2可见,所制备的新型稀土双钙钛矿型催化剂La2CoAlO6(1#样品)的甲烷催化燃烧活性明显高于相应的单钙钛矿型催化剂LaCoO3(2#样品)和LaAlO3(3#样品),活性顺序近似为:La2CoAlO6>LaCoO3>LaAlO3.稀土双钙钛矿型催化剂La2CoAlO6与稀土单钙钛矿型催化剂LaCoO3、LaAlO3相比,其起燃温度T10分别降低了56.5和138.2°C,完全转化温度T90分别降低了84.6和108.9°C,同时500°C之后反应速率较快,这也是双钙钛矿型催化剂的主要优点之一.
众所周知,在钙钛矿结构中,B位元素是影响甲烷催化燃烧活性的主要因素之一.为了更好地说明双钙钛矿型催化剂La2CoAlO6优良的甲烷催化燃烧活性,我们又采用机械混合的方法,将两种单钙钛矿型催化剂LaCoO3和LaAlO3按照1:1的摩尔比进行混合后测试其催化活性(4#样品),如图3所示.从图中可明显看出,稀土双钙钛矿型催化剂La2CoAlO6(1#样品)的甲烷燃烧催化活性明显高于单钙钛矿型催化剂LaCoO3和LaAlO3的混合物(4#样品),这说明在双钙钛矿催化剂La2CoAlO6结构中,Co、Al元素之间存在着协同作用,而这种协同作用对甲烷催化燃烧反应是有利的.而在4#样品中,由于Co、Al元素分别处于不同的单钙钛矿结构的晶格中,不能有效地使Co、Al元素之间产生作用,所以4#样品虽然有着和双钙钛矿型催化剂La2CoAlO6相同的元素组成,但其活性却远远不及La2CoAlO6样品.由此可见,钴铝双钙钛矿结构可以有效地使钴、铝元素结合在一起发挥作用.

表1 催化剂容忍因子(t)、比表面积(SBET)、平均粒径及晶胞参数Table 1 Tolerance factor(t),specific surface area(SBET),crystallite,and lattice constants of catalysts
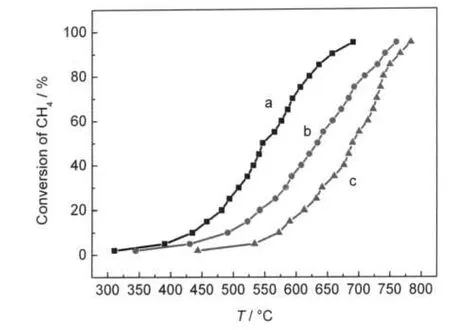
图2 (a)La2CoAlO6、(b)LaCoO3和(c)LaAlO3样品的催化活性曲线Fig.2 Catalytic performance of samples(a)La2CoAlO6, (b)LaCoO3,and(c)LaAlO3
3.3 催化剂H2-TPR分析
在甲烷催化燃烧反应中,催化剂的氧化还原性能与催化剂活性密切相关.程序升温还原(TPR)技术广泛用于催化剂还原性质的研究,可以方便地分析催化剂中氧物种的数量和类型,21,22但目前有关双钙钛矿化合物的H2-TPR分析报道并不多见,图4为合成的系列催化剂的H2-TPR谱图.

表2 样品的催化性质Table 2 Activities of the catalysts
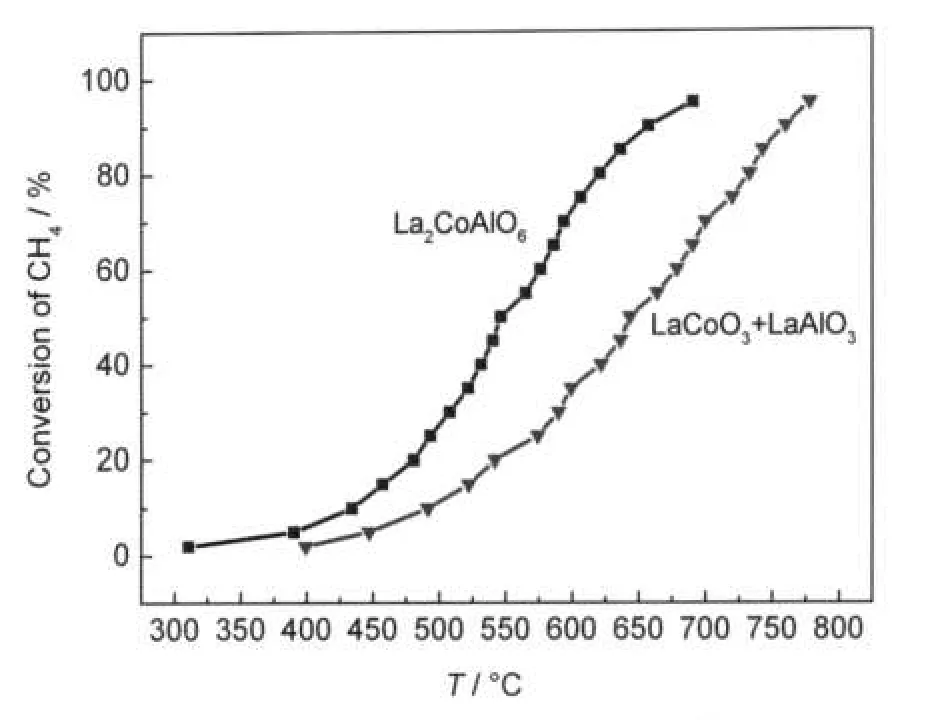
图3 La2CoAlO6和LaCoO3+LaAlO3样品的催化活性曲线Fig.3 Catalytic performance of samples La2CoAlO6and LaCoO3+LaAlO3
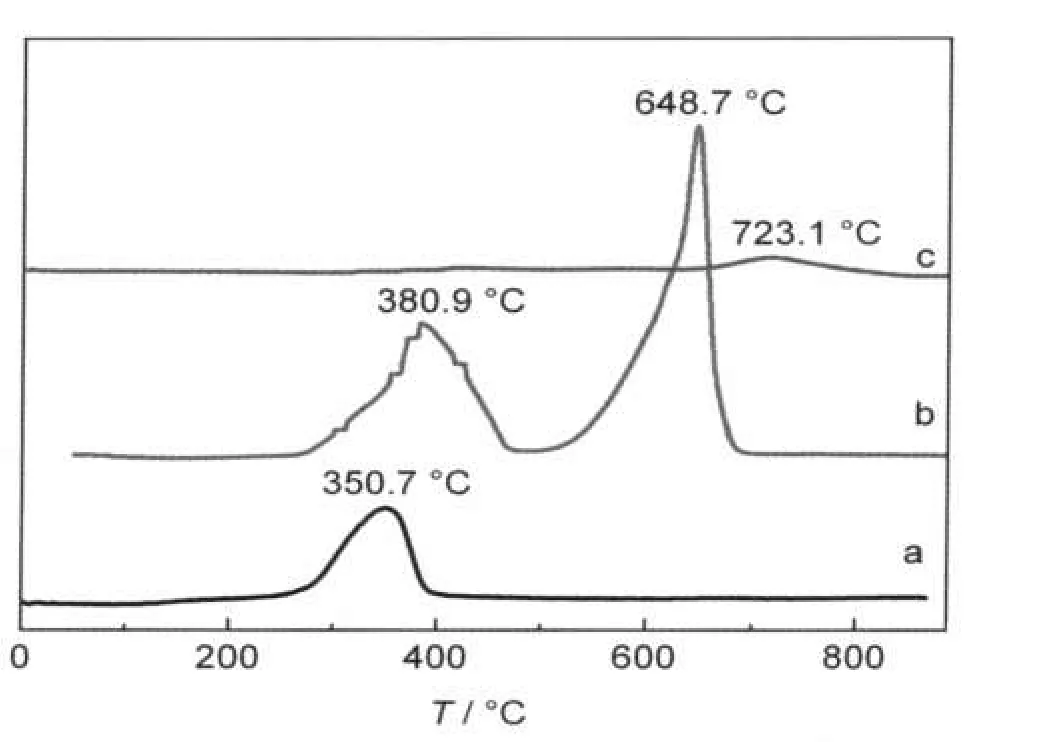
图4 样品的H2-TPR图谱Fig.4 H2-TPR spectra of samples(a)La2CoAlO6,(b)LaCoO3,(c)LaAlO3
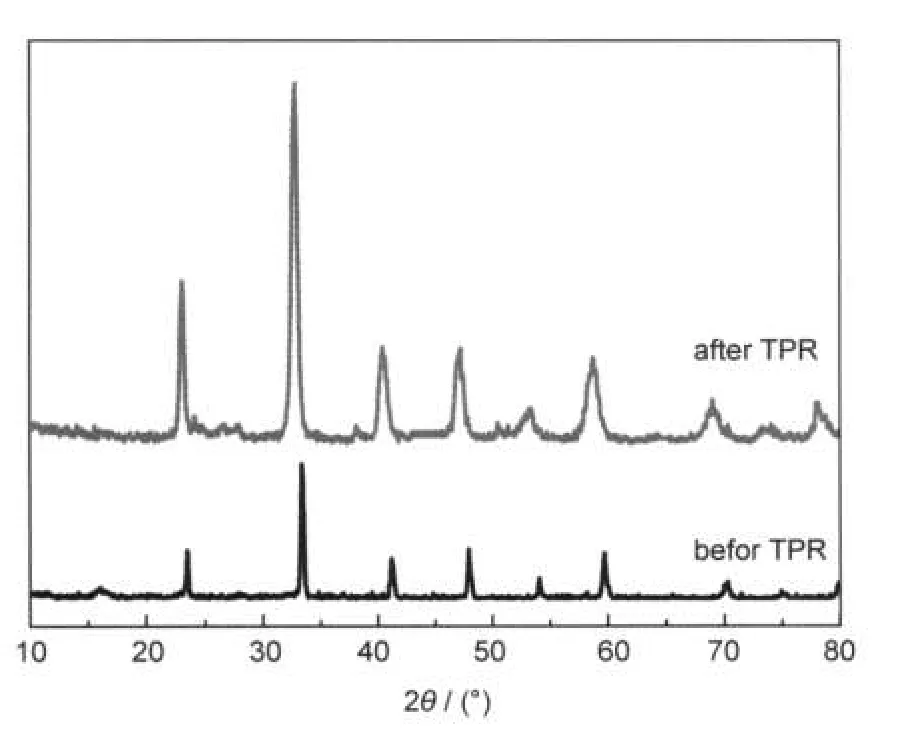
图5 H2-TPR前后La2CoAlO6催化剂的XRD谱图Fig.5 XRD patterns of the La2CoAlO6catalyst before and after H2-TPR
从图4中可以看出,三种催化剂的H2-TPR谱图有明显区别,稀土双钙钛矿型催化剂La2CoAlO6只在350°C左右出现了一个低温还原峰.值得注意的是,该峰比单钙钛矿型催化剂LaCoO3的低温还原峰降低了30°C左右(见图4).通常情况下,Co3+→Co2+对应的还原峰在400°C附近,Co2+→Co0的还原峰在630至670°C之间,23,24Al3+→Al0的还原则一般发生在900°C以上.25对比图中三种催化剂可知,稀土双钙钛矿型催化剂La2CoAlO6(1#样品)只在350.7°C处出现了一个还原峰,此还原峰可归属于体相Co3+→Co2+还原,而通常出现在630至670°C之间的Co2+→Co0的还原峰却没有出现,这很可能是由于在双钙钛矿型化合物La2CoAlO6中,Al3+离子的存在促进了Co3+→Co2+的还原使还原峰向低温方向产生了移动,同时抑制了Co2+→Co0的还原,这与Porta等人26报道的有关LaAl1-xMnxO3样品的H2-TPR结果相类似.稀土单钙钛矿型催化剂LaCoO3(2#样品)在380.9和648.7°C出现的还原峰可分别归属于Co3+→Co2+和Co2+→Co0的还原.稀土单钙钛矿型催化剂LaAlO3(3#样品)只在723.1°C处出现了一个较为微弱的还原峰,结合XRD测试结果可知,LaAlO3样品中未发现影响TPR结果的杂质样品,我们认为此还原峰可能是样品表面少量Al3+还原为Al0所致.25H2-TPR谱线上的还原峰温度的高低表征了样品中氧的移动性的难易程度,还原峰温越低说明氧的移动性越高.结合甲烷催化燃烧活性曲线分析,我们认为稀土双钙钛矿型催化剂La2CoAlO6有较好的甲烷燃烧活性与此催化剂有比较低的还原峰温度密切相关.
此外,为了更好地解释La2CoAlO6的H2-TPR结果,我们对经过H2-TPR反应以后的La2CoAlO6进行了XRD表征,结果如图5所示.从图中可以看出, La2CoAlO6样品在经过H2-TPR反应之后,其双钙钛矿结构未被破坏,没有明显金属钴的衍射峰出现,说明在还原产物中基本没有零价钴.但La2CoAlO6样品的所有衍射峰均向小角度方向发生了位移,大约为2°,根据晶体结构知识,衍射角度变小反映了d值和晶胞体积的增加,我们认为主要是由于双钙钛矿La2CoAlO6中半径较小的Co3+离子还原为半径较大的Co2+离子所导致的.
3.4 催化剂SEM分析
通常情况下,经高温焙烧后的催化剂均易烧结成块,进而影响催化剂活性.因此高焙烧温度是考察和评价甲烷燃烧催化剂的耐热性和稳定性的主要指标和依据.图6为经1100°C焙烧3 h后制备的三种催化剂的扫描电镜照片.从图中可以明显看出,三种样品具有不同的形貌特征,稀土双钙钛矿型催化剂La2CoAlO6(1#样品)呈薄片状形貌,且有较大空隙,烧结现象不太严重;稀土单钙钛矿型催化剂LaCoO3(1#样品)有严重的烧结现象,从而影响其催化活性;稀土单钙钛矿型催化剂LaAlO3(1#样品)表面有明显的孔状结构,但大小不均匀.
3.5 催化剂的FT-IR表征

图6 三种催化剂的SEM照片Fig.6 SEM images of the three catalysts(a)La2CoAlO6,(b)LaCoO3,(c)LaAlO3

图7 样品的FT-IR谱图Fig.7 FT-IR spectra of samples(a)La2CoAlO6;(b)LaCoO3;(c)LaAlO3
傅里叶变换红外(FT-IR)吸收光谱技术是检验和判断催化剂中的特征组分和基团的比较灵敏的表征手段之一,27因此我们对所合成的稀土钙钛矿型催化剂进行了傅里叶变换红外吸收光谱表征,结果如图7所示.从图7中可看出,三种催化剂的FT-IR图谱基本相似,均在400、600、1384、1620和3400 cm-1附近出现了红外光谱特征吸收峰.但三者也存在着明显不同(见图中*号处).我们把谱图上3400和1620 cm-1附近的宽吸收峰分别归属为水分子O-H键的伸缩和弯曲振动吸收峰,这是因为合成的粉末样品吸潮所致.图中1384 cm-1处左右出现的微弱的吸收峰,归属于痕量NO-3的N-O对称伸缩振动吸收峰,由焙烧过程中吸附在样品表面的硝酸盐所引起,尽管FT-IR中出现了硝酸盐的弱吸收信号,X射线粉末衍射中却不敏感,这可能是由于样品中硝酸盐的含量低于XRD的检出限.稀土双钙钛矿型化合物La2CoAlO6和稀土单钙钛矿型化合物LaCoO3、LaAlO3均在在600和400 cm-1附近出现了Co-O和Al-O键的红外特征吸收峰,值得注意的是,稀土双钙钛矿型催化剂La2CoAlO6(1#样品)在600 cm-1附近的吸收峰出现了劈裂,这是与单钙钛矿型催化剂LaCoO3和LaAlO3的红外吸收谱图最为明显的差别,也是双钙钛矿型催化剂La2CoAlO6的FT-IR光谱的主要特征之一.

图8 样品的室温磁滞回线Fig.8 Hysteresis loops of samples at room temperature(a)La2CoAlO6,(b)LaCoO3,(c)LaAlO3
3.6 催化剂的磁性测量结果及分析
图8为三种钙钛矿型催化剂在室温条件下的磁滞回线.通常,铁磁性样品的磁化强度(M)随外磁场(H)的增加迅速增加,增加到一定程度,继续增加外磁场H,磁化强度M也不再增加,变为恒量,表明磁化已达饱和,称之为饱和磁化强度.从图中可以看出,两种单钙钛矿型催化剂LaCoO3和LaAlO3的磁滞回线符合上述规律,但形成的滞后环面积较小.而稀土双钙钛矿型催化剂La2CoAlO6的磁滞回线较为特殊,在磁化强度已趋于饱和时,随着外磁场的增加磁化强度突然上升,达到一定值后又迅速下降,之后趋于平缓,在1.5 T时均达到了饱和,然后按照原趋势返回,形成了在两端带有倒V(V)字型的的磁滞回线.经过反复测试,其结果一致,说明这一特殊现象是由La2CoAlO6样品本身特有的性质所导致的,这反映了双钙钛矿La2CoAlO6的特殊性,对于这一特殊性与催化活性的的关联还有待进一步研究.
4 结论
(1)采用溶胶-凝胶法,在空气气氛中,经过1100°C焙烧3 h后,制备出了单相的新型稀土双钙钛矿型催化剂La2CoAlO6.其甲烷燃烧催化活性明显高于单钙钛矿型催化剂LaCoO3和LaAlO3.与单钙钛矿型催化剂LaCoO3、LaAlO3相比,其起燃温度T10分别降低了56.5和138.2°C,完全转化温度T90分别降低了84.6和108.9°C.
(2)稀土双钙钛矿型催化剂La2CoAlO6与稀土单钙钛矿型催化剂LaCoO3程序升温还原谱图具有明显的差别,稀土双钙钛矿型催化剂La2CoAlO6在350°C左右出现单一还原特征峰,而稀土单钙钛矿型催化剂LaCoO3分别在380.8和468.7°C出现了两个还原峰,稀土双钙钛矿型催化剂La2CoAlO6还原峰的出峰温度较低,与具有较低的甲烷完全转化温度相对应.
(1) Choudhary,T.V.;Banerjee,S.;Choudhary,V.R.Applied Catalysis A:General 2002,234,1.
(2) Xu,J.G.;Tian,Z.J.;Suo,Z.H.;Xu,X.F.;Qu,X.H.;Xu,Y.P.; Xu,Z.S.;Lin,L.W.Chin.J.Catal.2005,26,665.[徐金光,田志坚,索掌怀,徐秀峰,曲秀华,徐云鹏,徐竹生,林励吾.催化学报,2005,26,665.]
(3) Arosio,F.;Colussi,S.;Trovarelli,A.;Groppi,G.Applied Catalysis B:Environmental 2008,80,335.
(4)Xiao,L.H.;Sun,K.P.;Xu,X.L.;Li,X.N.Catal.Commun. 2005,6,796.
(5) Dai,H.X.;He,H.;Li,P.Y.;Zi,X.H.Journal of the Chinese Rare Earth Society 2003,21,1.[戴洪兴,何 洪,李佩珩,訾学红.中国稀土学报,2003,21,1.]
(6) Nguyen,S.V.;Szabo,V.;Trong On,D.;Kaliaguine,S. Microporous Mesoporous Mat.2002,54,51.
(7) Batiot-Dupeyrat,C.;Martinez-Ortega,F.;Ganneb,M.; Tatibouët,J.M.Applied Catalysis A:General 2001,206,205.
(8) Zhong,Z.Y.;Chen,K.D.;Ji,Y.;Yan,Q.J.Applied Catalysis A: General 1997,156,29.
(9) Kobayashi,K.I.;Kimura,T.;Sawada,H.;Terakura,K.;Tokura, Y.Nature 1998,395,677.
(10) Maignan,A.;Raveau,B.;Martin,C.;Hervieu,M.J.Solid State Chem.1999,144,224.
(11)Miao,Y.;Yuan,H.K.;Chen,H.Acta Phys.-Chim.Sin.2008, 24,448.[苗 月,袁宏宽,陈 洪.物理化学学报,2008,24, 448.]
(12)Arulraj,A.;Ramesha,K.;Gopalakrishnan,J.;Rao,C.N.R. J.Solid State Chem.2000,155,233.
(13) Huang,Y.H.;Dass,R.I.;King,Z.L.;Goodenough,J.B. Science 2006,312,254.
(14) Falcón,H.;Barbero,J.A.;Araujo,G.;Casais,M.T.;Martínez-Lope,M.J.;Alonso,J.A;Fierro,J.L.G.Applied Catalysis B: Environmental 2004,53,37.
(15) Pecchi,G.;Campos,C.;Peňa,O.;Cadus,L.E.Journal of Molecular Catalysis A:Chemical 2008,282,158.
(16)Wei,Z.X.;Xu,Y.Q.;Liu,H.Y.;Hu,C.W.Journal of Hazardous Materials 2009,165,1056.
(17) Shaheen,R.;Bashir,J.Solid State Sciences 2010,12,1496.
(18) Roa-Rojas,J.;Salazar,C.M.;Llamosa,D.P.;Leon-Vanegas,A. A.;Tellez,D.A.L.;Pureur,P.;Dias,F.T.;Vieira,V.N.Journal of Magnetism and Magnetic Materials 2008,320,104.
(19) Petrović,S.;Terlecki-Baričević,A.;Karanović,L.;Kirilov-Stefanov,P.;Zdujić,M.;Dondur,V.;Paneva,D.;Mitov,I.; Rakić,V.Applied Catalysis B:Environmental 2008,79,186
(20) Qin,S.;Wang,R.C.Acta Geologica Sinica 2004,78,345. [秦 善,王汝成.地质学报,2004,78,345.]
(21)Xu,X.F.;Suo,Z.H.;Li,D.L.;Qi,S.X.;An,L.D.J.Mol. Catal.2001,15,259.[徐秀峰,索掌怀,李大力,齐世学,安立敦.分子催化,2001,15,259.]
(22) Li,R.J.;Yu,C.C.;Dai,X.P.;Shen,S.K.Chin.J.Catal 2002, 23,549.[李然家,余长春,代小平,沈师孔.催化学报,2002, 23,549.]
(23)Tien-Thao,N.;Alamdari,H.;Zahedi-Niaki,M.H.;Kaliaguine, S.Applied Catalysis A:General 2006,311,204.
(24) Lago,R.;Bini,G.;Peňa,M.A.;Fierro,J.L.G.J.Catal.1997, 167,198.
(25) Ciambelli,P.;Cimino,S.;Lasorella,G.;Lisi,L.;De Rossi,S.; Faticanti,M.;Minelli,G.;Porta,P.Applied Catalysis B: Environmental 2002,37,231.
(26) Cimino,S.;Lisi,L.;De Rossi,S.;Faticanti,M.;Porta,P. Applied Catalysis B:Environmental 2003,43,397.
(27)Ruan,S.P.;Dong,W.;Wu,F.Q.;Wang,Y.W.;Yu,T.;Peng,Z. H.;Xuan,L.Acta Phys.-Chim.Sin.2003,19,17.[阮圣平,董 玮,吴凤清,王永为,于 涛,彭增辉,宣 丽.物理化学学报,2003,19,17.]
January 13,2011;Revised:March 3,2011;Published on Web:March 24,2011.
Preparation and Catalytic Activities of La2CoAlO6for Methane Combustion
ZHANG Hui-Min1HU Rui-Sheng1,*HU Jia-Nan1ZHANG Yu-Long2
(1Key Laboratory of Rare Earth Materials Chemistry and Physics,School of Chemistry and Chemical Engineering,Inner Mongolia University,Hohhot 010021,P.R.China;2Western Research Institute,365 N 9St,Laramie,Wyoming,USA)
A novel rare earth double perovskite-type catalyst(La2CoAlO6)was prepared by the sol-gel method using citric acid as complex agent.The catalyst was characterized by X-ray powder diffraction (XRD),H2-temperature-programmed reduction(H2-TPR),specific surface area(BET),scanning electron microscopy(SEM),Fourier transform infrared(FT-IR)spectroscopy,and magnetic property measurement. This catalyst was evaluated for methane combustion.The results showed that a single-phase rare earth double perovskite oxide La2CoAlO6could be formed by calcination at 1100°C for 3 h.La2CoAlO6gives good catalytic activity for methane combustion.It has a light-off temperature(T10)of 434.1°C and a total conversion temperature(T90)of 657.4°C.Compared with the single rare earth perovskite-type oxides LaCoO3and LaAlO3,the T10decreased by 56.5 and 138.2°C,and T90decreased by 84.6 and 108.9°C, respectively.The FT-IR results indicate that all the synthesized oxides possess perovskite-type structures. Furthermore,the La2CoAlO6samples showed excellent catalytic activity for methane combustion,which could be related to the decrease in reduction temperature that was observed in the H2-TPR experiments. This was probably because of the increased oxygen mobility that was promoted by the presence of aluminum.In addition,the rare earth double perovskite-type oxide La2CoAlO6has a platelet morphology and is resistant to sintering.We also found that the double perovskite oxide La2CoAlO6had special magnetic properties.
Rare earth;Double perovskite;Single perovskite;Methane catalytic combustion; Sol-gel method
O643
*Corresponding author.Email:cehrs@imu.edu.cn;Tel:+86-471-4990061-80606.
The project was supported by the National Natural Science Foundation of China(20763003)and Chun Hui Plans of the Ministry of Education of China(Z2007-1-01029)and Natural Science Foundation of Inner Mongolia,China(2008 0404 MS 0123).
国家自然科学基金(20763003),教育部春晖计划(Z2007-1-01029)及内蒙古自然科学基金(2008 0404 MS 0123)资助项目

