正癸烷热裂解实验和动力学模拟
焦 毅 李 军 王静波 王健礼 朱 权 陈耀强,* 李象远,*
(1四川大学化学学院,成都610065; 2四川大学化工学院,成都610065)
正癸烷热裂解实验和动力学模拟
焦 毅1李 军2王静波2王健礼1朱 权2陈耀强1,*李象远2,*
(1四川大学化学学院,成都610065;2四川大学化工学院,成都610065)
采用自制常压裂解装置,研究了正癸烷在温度范围为973-1123 K,停留时间为0.5-2 s时,热裂解主要气相产物氢气、甲烷和乙烯的分布情况.根据自主开发的机理生成软件ReaxGen,构建了正癸烷热裂解的详细机理,该机理包含1072步反应和281个物种.进一步进行动力学模拟,并用实验结果进行了初步验证.结果表明,在反应的温度区间内,短的停留时间有利于乙烯和氢气的生成.通过敏感度分析,确定了常压下973 K,停留时间为1 s时影响氢气、甲烷和乙烯产量的主要反应步骤是烷基的重排和β裂解反应.
热裂解;动力学模型;相对敏感度;正癸烷;ReaxGen
1 引言
再生冷却方法利用碳氢燃料(主要组分为烃类物质)的高热沉值来实现发动机的有效冷却.1利用燃料在较高温度条件下的裂解反应,生成燃烧性能优良的富能小分子产物,能为发动机热量的有效管理提供一条可能途径.2碳氢燃料热裂解反应的主要气相产物为小分子低碳烃如甲烷、乙烯、乙烷、丙烯、丙烷等,为了更好地了解该反应的详细过程,提高反应的转化率和选择性,需要对裂解过程的详细机理深入研究,预测产物分布和转化率,从而为评价燃料的冷却效果,提高化学热沉值等提供依据.
航空燃料组分非常复杂,包括上百种脂肪烃和芳香烃化合物,主要有直链烷烃、支链烷烃、环烷烃、芳香烃和烯烃,正癸烷是其中一种重要组分.在实验方面,对于烷烃的热裂解研究主要集中在正辛烷、正十二烷、正庚烷和甲基环己烷等,3对于正癸烷的研究则很少;4-6而在理论方面,正癸烷燃烧的研究已非常详细.7-13但关于正癸烷热裂解的研究则很少,只有Zeppieri等人14根据正庚烷机理模型发展了正癸烷的部分简化的骨架机理.
本文采用自制的常压裂解装置研究了常压、温度范围为973-1123 K和不同停留时间(0.5-2 s)下,正癸烷热裂解主要气相产物氢气、甲烷和乙烯的分布情况.同时,根据自主开发的机理生成软件Reax-Gen,构建了正癸烷热裂解的详细机理,通过动力学模拟,分析了主要气相产物氢气、甲烷和乙烯的分布情况,并通过相对敏感度分析确定了影响这些主要产物的步骤.
2 实验部分
2.1 原料及实验装置图
以正癸烷(分析纯,成都市科龙化工试剂厂,相对原子质量142.23,20°C时,正癸烷的密度与4°C水的密度比为0.729-0.732)为原料.实验采用实验室自制的常压裂解装置,装置包括进料系统、温度控制系统、预热部分、反应装置、冷凝装置、分析系统等六个子系统,反应管是Φ10 mm×70 mm的石英管,反应管预热段长250 mm,反应段长300 mm,恒温区150 mm,预热段和反应段采用程序控温装置控制温度,预热段控制在523 K恒温,反应段分别在973、1023、1073和1123 K停留进行反应.反应前用99.99%的N2吹扫反应管30 min.实验装置如图1所示.
2.2 产物分析
对裂解气相产物用六通阀直接进入GC2000-III气相色谱仪(上海技术计算研究所),选用50 mm HP-Al/S毛细管分离柱和氢火焰离子化检测器检测有机小分子烃类,常压下各个温度点裂解产物基本一致,气相产物主要有甲烷、乙烷、乙烯、丙烯、丙烷、1,3-丁二烯、丁烯、丁烷.用实验室自制的2 m填充柱(固定相是TDX-101)和热导检测器检测氢气等无机小分子.冷凝回收的液体采用色谱/质谱(GS/ MS)分析,对于积碳采用环己烷溶解,采用GS/MS分析.
3 ReaxGen程序构建详细机理
借助计算机辅助生成烃类物质燃烧或裂解反应的机理模型已经有30余年的历史了.1979年, Yoneda15报道了第一个自动生成程序GRACE.随后,不同小组发展了若干机理自动生成程序,16如Milan小组17发展的MAMOX+程序,可生成直链烷烃的初级反应机理;Nancy小组1880年代发展并持续维护的EXGAS软件,其生成直链和支链烷烃反应机理的模块对科学研究是免费的;德国Heidelberg大学的Warnatz教授19发展的MOLEC程序可以生成非常详细的大分子烃类物质的反应机理等.在前期工作中,我们曾开发了烃类油料的燃烧和裂解详细机理的自动生成软件ReaxGen.20ReaxGen基于SMILES21,22物种表示法、反应类思想和基团贡献法,23可以快速高效地自动生成烃类物质燃烧或裂解的详细机理.EXGAS将机理分为两步,即初级机理和次级机理,其中,初级机理采用详细的基元反应处理,而次级机理采用集总处理.ReaxGen则全部采用详细机理处理,下面简要介绍ReaxGen的机理生成程序.
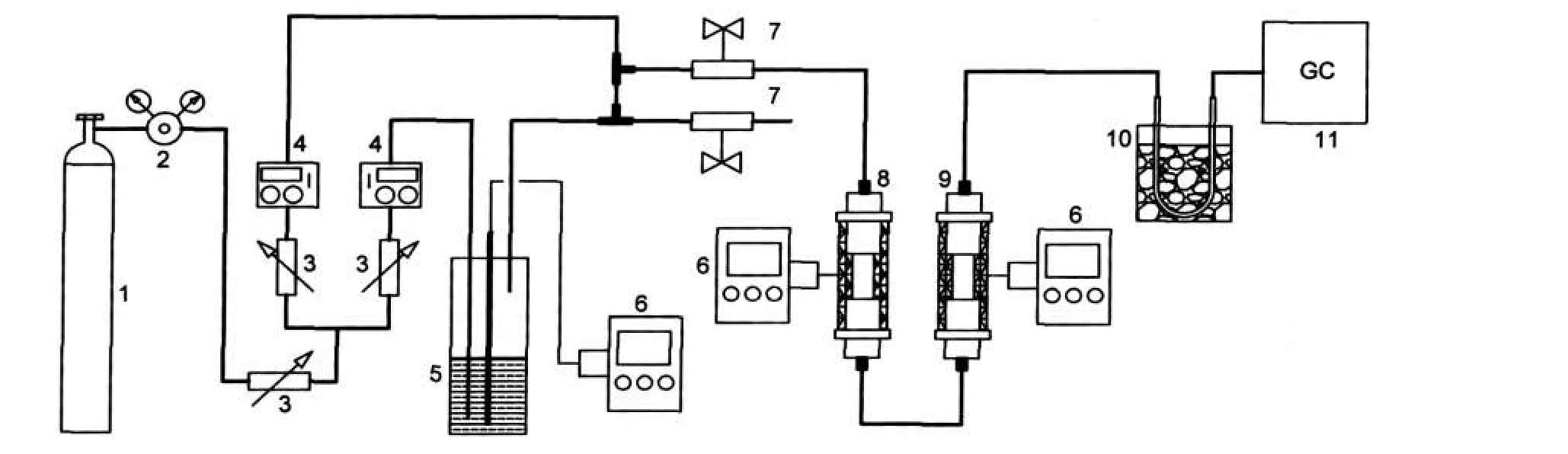
图1 实验装置示意图Fig.1 Schematic diagram of apparatus1-nitrogen;2-valve;3-needle valve;4-mass flow meter;5-feed tank;6-temperature controller; 7-off valve;8-pre-heater;9-heater;10-cold trap;11-gas chromatograph
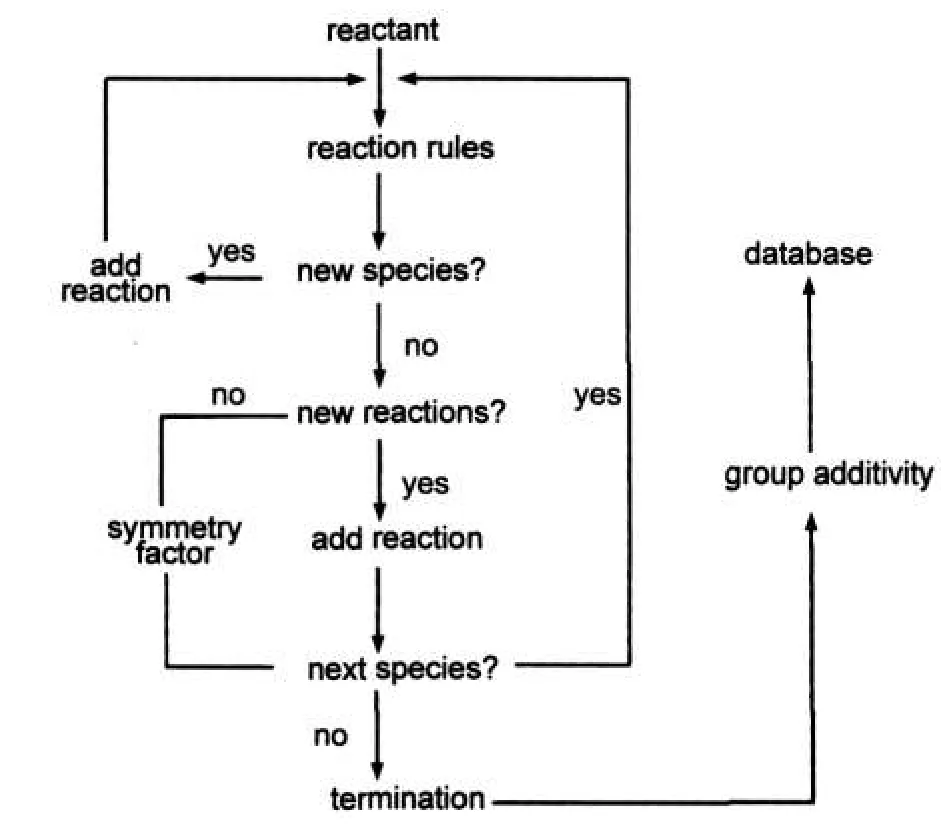
图2 ReaxGen程序主流程Fig.2 The main flow of ReaxGen program
如图2所示,ReaxGen机理生成过程可以分为两个主要步骤:(1)从一组初始反应物开始,迭代应用一系列反应规则.对于烷烃的热裂解过程,本文采用的反应类型和前期工作20中的相同.经过初始步骤产生物种,将这些物种采用正则算法唯一化后,判断此物种是否为新物种.如果是新的物种,添加这个物种和反应机理.如果不是新的物种,不必添加这个物种,判断这个反应是否是新的反应.如果是新的反应则添加这个反应,如果为否,则修改这个已存在反应的对称因子.然后对下一个物种应用这些反应规则,重复这一过程直到没有新的物种生成或者达到用户指定的标准.(2)计算热动力学参数.动力学机理必须包括物种的热力学数据和反应的动力学数据.这通常通过在数据库中搜索相应的数据或者通过即时计算得到.但是程序产生的物种和反应可能数以千计,几乎不可能在数据库中获得所有的热力学和动力学数据,所以必须通过即时计算得到这些数据.在ReaxGen程序中,热力学数据通过基团贡献法得到,对每一种反应类型的子类型采用同一动力学数据.物种的基团值由实验数据或大量高精度计算得到,准确度较高.ReaxGen程序的基团贡献法实现了对基团的准确识别,可以计算大多数含C、H、O、N元素物种的热力学数据.

图3 氢气、甲烷和乙烯产量随停留时间的实验观测变化趋势Fig.3 Experimentally observed variation tendency of hydrogen,methane,and ethylene yields with the residence time□H2,○CH4,△C2H4;Yield:the mole number of the product per n-decane
注意到上述自动生成机理中,其动力学数据是按反应类思想得到的,即相同反应类(反应中心)的动力学数据相同.显然,该思想认为反应是局域效应,反应的活性主要由反应中心决定,受分子尺寸的影响较小.这对于较大分子是合理的.而对于小分子,一方面其受分子尺寸的影响较大,而且小分子的实验数据或者高精度计算数据已有大量文献报道,另一方面小分子所涉及的反应复杂,且非常重要,必须包括反应规则之外的反应,因此,应当构建低碳物质(核心机理)的热动力学数据库.该核心机理数据库(本文为C0-C4)包括准确丰富的小分子的热动力学数据.
这样,ReaxGen生成的机理(生成C4以上的机理)和核心机理(C0-C4)构成了烃类物质的反应机理模型.当然,反应条件不同时,反应类型的相对重要性不同,因此可根据具体需要增加或删除反应,动力学数据也可以不断更新.本文构建的正癸烷热裂解机理由1072步反应和281个物种构成(动力学机理文件可向作者索取).
4 结果与讨论
4.1 产物分析
图3(a-d)给出了常压下,温度分别为1123、1073、1023、973 K时正癸烷热裂解的主要气相产物(氢气、甲烷和乙烯)随停留时间的实验观测分布情况.采用各种点标记了停留时间分别为0.5、0.8、1.0、1.5和2.0 s的实验结果.图4(a-d)则给出了对应的理论模拟结果.模拟计算用Chemkin II程序包24完成.在封闭均相恒温恒压的反应器模型内进行化学反应动力学模拟,反应压强恒定为p=101325 Pa在不同反应温度(1123,1073,1023,973 K)下进行动力学模拟.

图4 氢气、甲烷和乙烯产量随停留时间的理论预测变化趋势Fig.4 Theoretically predicted variation tendency of hydrogen,methane,and ethylene yields with the residence time -,H2;---,CH4;…,C2H4
从图3看出,实验上,在相同停留时间时,随着温度的升高,氢气、甲烷、乙烯各物质的产量(产量定义为每摩尔正癸烷生成的产物的摩尔数)均有所增加.根据阿仑尼乌斯公式可知,温度升高,反应速率增加,从而在相同时间内生成的产物量增加.25在整个温度区间内主要气相产物的量符合以下规律:乙烯>甲烷>氢气.在相同温度下,氢气、甲烷和乙烯首先大量生成,而后随停留时间的增加而减少.温度为973、1023 K,停留时间为0.8 s时,产生的甲烷量最多.而在较高温度下,1073、1123 K,停留时间为0.5 s时,产生甲烷最多.可见,随着温度的升高,裂解生成甲烷的速率明显提高,从而导致生成最大产量甲烷的停留时间明显缩短.对乙烯和氢气进行分析,也可得到类似结论.在1123 K停留时间为1.0 s时乙烯的产量最大;而在973 K下,停留0.8 s时乙烯的产量最大;在1023和1073 K下,停留时间为0.5 s时,乙烯的产量最大.
动力学模拟结果显示,在较高温度1123 K下,氢气和乙烯首先大量生成,达到峰值后随停留时间增加,缓慢下降直至趋于平衡.在温度1073和1023 K时,3种气相产物的量随停留时间延长逐渐升高,然后达到平衡.理论预测大体上能够反映出实验结果的定性结论,氢气、甲烷随停留时间的变化趋势与理论预测的趋势基本一致.通过比较可以看出,在温度高于1073 K时,乙烯和氢气在停留时间小于1.5 s时,实验观测点和理论预测曲线符合较好,而在停留时间较长时,甲烷的理论模拟结果和实验符合较好.
影响实验观测和理论预测之间偏离的原因主要来自两个方面:理论上,对高碳烃裂解这样一个复杂的反应体系,要得到准确的动力学结果十分困难,动力学模拟结果和实验能在定性和半定量上符合已经很好;其次,物种热动力学数据的获得未考虑非理想性校正也会带来误差.实验上,产物分析目前还做不到在线检测,而是将产物冷却之后分析组成的结果,且在本文的裂解反应条件下,反应物在反应管中的准确停留时间目前还无法检测,在管内流动时反应物的温度变化难以和理论模拟完全吻合,因而和理论模拟条件存在偏差.由于停留时间和温度对裂解产物分布影响很大,从而造成误差.因此,本文的实验只能是对理论模拟结果的初步验证.
4.2 敏感度分析
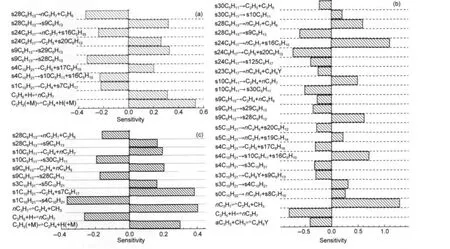
图5 重要反应对氢气(a)、甲烷(b)和乙烯(c)的相对敏感度Fig.5 Relative sensitivities of important reactions for H2(a),CH4(b),and C2H4(c)conditions:atmospheric pressure,973 K;the residence time,1 s
本文建立的正癸烷热裂解的动力学模型是基于SMILES表示,通过反应类思想借助计算机生成的详细模型.该方法尽可能地生成所有可能发生的反应,但是生成的机理模型非常庞大.其中有些反应是不重要的,可以忽略而使得机理简化.敏感度分析和反应路径分析常用来分析反应机理.其中敏感度分析可以确定影响某目标(如乙烯的产量)的决速步骤;反应路径分析则给出了反应的特征路径.这样,删除不重要的反应从而使得机理简化.图5 (a-c)给出了973 K时,停留时间为1 s(对应转化率约为55%),各个反应对产物氢气、甲烷和乙烯的敏感度分析.这里的敏感度为相对敏感度,没有单位,是指反应模型中各个反应的速率常数对目标函数如产物氢气量的影响程度,该值越大,则对应的反应对目标函数影响越大.
由图5(a)看出,该条件下影响产物氢气分布的反应主要是氢迁移重排和烷基β位断裂反应.其中C2H5(+M)⇌C2H4+H(+M)的敏感度最大,这是因为该反应会生成氢自由基从而加速氢气的生成.从图5 (b)看出,影响甲烷生成的主要反应为烷基β位断裂反应,如nC3H7⇌C2H4+CH3和s24C8H17⇌nC3H7+ s16C5H10,这是因为这些反应会生成甲基自由基,或者有潜力继续生成和消耗甲基自由基,从而对甲烷的生成有较大影响.从图5(c)看出,影响乙烯生成的主要反应为烷基自由基的β裂解和重排反应.这是因为烷基β裂解反应可以直接或间接地生成乙烯.而重排反应对乙烯生成有较大影响是因为1位烷基自由基的β裂解可直接生成乙烯,而重排反应则会使得1位烷基自由基发生重排从而对乙烯生成有较大影响.图5中的物种名称为ReaxGen程序中使用的简写名称,其物种说明参见详细机理文件.
5 结论
本文根据自主开发的机理生成软件ReaxGen,构建了新的正癸烷热裂解的详细机理,进一步进行了动力学模拟和敏感度分析.同时,采用自制的常压裂解装置对动力学模拟结果进行了初步验证.我们在温度范围为973-1123 K讨论了正癸烷热裂解的主要气相产物氢气、甲烷和乙烯的产量随停留时间(0.5-2 s)的变化情况.从理论和实验结果对比来看,两者在变化趋势和半定量描述上是符合的.但是,由于高碳烃裂解反应的复杂性,动力学机理的构建和模拟结果的准确性仍然是一个难题,加之目前在流动裂解和流动燃烧方面在线实验检测非常困难,复杂的反应过程和产物成分对基础和应用研究都带来极大挑战.尽管如此,由于其重要的应用背景,国内外学者仍然在这类复杂反应机理方面投入了大量精力.本文正是基于将基础研究服务于工程应用的目的而开展的工作.从本文研究结果看,我们构建的正癸烷热裂解机理能够较合理地描述燃料裂解过程,所得产物分布基本上可以和实验进行比较,但在精度方面,在较低温度下的结果不太理想,如在973 K时,乙烯产率和实验相差较大.另一方面,由于高温裂解过程在流动条件下进行,在反应物在裂解管中的流速、反应时间、裂解产物分布的精确测定等都还存在很大困难,因而实验结果本身也存在误差.对燃料裂解和燃烧这样的反应体系,实验误差往往较大,这也引起实验结果与理论模拟结果难以吻合.
本文研究涉及理论模拟和实验验证两方面,工作难度大,结果对指导应用和工程设计有重要意义.从我们实验结果看,在整个温度区间,氢气、甲烷和乙烯的生成量表现为:乙烯>甲烷>氢气;而理论预测结果表明在整个温度区间和停留时间内,乙烯的产量始终大于甲烷和氢气,但甲烷和氢气的产量有交叉情况出现.在温度高于1073 K时,乙烯和氢气在停留时间较短时,实验观测点与理论预测符合较好;而停留时间较长时,甲烷的理论模拟结果和实验符合较好.相对敏感度分析表明,973 K,停留时间为1 s时,影响反应产物氢气、甲烷和乙烯的主要反应步骤是烷基自由基的氢迁移重排反应和β裂解反应,说明了烷基自由基在烷烃热裂解机理模型中的重要性.
一个复杂反应的机理的优化和验证是一个长期的过程,正癸烷这样的高碳烃更是如此.我们将采用更多方式的实验验证(如超临界裂解、点火延时)等多种方式,进一步优化正癸烷的复杂反应机理,为换热设计等工程应用提供有价值的动力学模型.
(1) Herbinet,O.;Paul-Marie,M.;Battin-Leclerc,F.;Fournet,R. J.Anal.Appl.Pyrolysis 2007,78,419.
(2) Sobel,D.R.;Spadaccini,L.J.J.Engin.Gas.Turb.Power 1997, 119,345.
(3) Xie,W.J.;Fang,W.J.;Li,D.;Xing,Y.;Guo,Y.S.;Lin,R.S. Acta Chim.Sin.2009,67,1759.[谢文杰,方文军,李 丹,邢 燕,郭永胜,林瑞森.化学学报,2009,67,1759.]
(4) Yin,K.L.;Wu,G.Y.;Chen,Z.L.Acta Petr.Sin.2006,17,77. [殷开梁,邬国英,陈正隆.石油学报,2006,17,77.]
(5)Wang,Z.W.;Zheng,X.W.;Mi,Z.T.;Hao,W.H.Petrochem. Technol.2005,34,518.[王占卫,张香文,米镇涛,郝伟华.石油化工,2005,34,518]
(6) Billaud,F.;Chaverot,P.;Freund,E.J.Anal.Appl.Pyrolysis 1987,11,39.
(7) Glaude,P.A.;Warth,V.;Fournet,R.;Battin-Leclerc,F.; Scacchi,G.;Come,G.M.Int.J.Chem.Kinet.1998,30,949.
(8) Warnatz,J.;Nehse,M.Twenty-Sixth Symposium(International) on Combustion.The Combustion Institute,Pittsburgh,1996; p 773.
(9) Bales-Gueret,C.;Cathonnet,M.;Boettner,J.C.;Gaillard,F. Energy&Fuels,1992,6,189.
(10) Battin-Leclerc,F.;Fournet,R.;Glaude,P.A.;Judenherc,B.; Warth,V.;Come,G.M.;Scacchi,G.Twenty-Eight Symposium (International)on Combustion.The Combustion Institute, Pittsburgh,2000;p 1597.
(11) Delfau,J.L.;Bouhria,M.;Reuillon,M.;Sanogo,O.;Akrich,R.; Vovelle,C.Twenty-Third Symposium(International)on Combustion.The Combustion Institute,Pittsburgh,1991; p 1567.
(12) Bikas,G.;Peters,N.Combust.Flame 2001,126,1456.
(13) Bradley,D.;El-Din Habik,S.;El-Sharif,S.A.Combust.Flame 1991,87,336.
(14) Zeppieri,S.P.;Klotz,S.D.;Dryer,F.L.Twenty-Eighth Symposium(International)on Combustion.The Combustion Institute,Pittsburgh,2000;p 1587.
(15) Yoneda,Y.Bull.Chem.Soc.Jpn.1979,52,8.
(16) Ranzi,E.;Pierucci,S.Comput.Chem.Eng.2008,32,805.
(17) Ranzi,E.;Faravelli,T.;Gaffuri,P.;Pennati,G.;Sogaro,A. Combust.Sci.Technol.1994,100,299.
(18) http://www.Valerie.Conraud@ensic.inpl-nancy.fr/(accessed Mar 25,2008.
(19) Muharam,Y.Detailed Kinetic Modelling of the Oxidation and Combustion of Large Hydrocarbons Using anAutomatic Generation of Mechanisms.Ph.D.Dissertation,University of Heidelberg,Germany,2005.
(20) Li,J.;Shao,J.X.;Liu,C.X.;Rao,H.B.;Li,Z.R.;Li,X.Y. Acta Chim.Sin.2010,68,239.[李 军,邵菊香,刘存喜,饶含兵,李泽荣,李象远.化学学报,2010,68,239.]
(21) Weininger,D.J.Chem.Inf.Comput.Sci.1988,28,31.
(22)Weininger,D.;Weininger,A.;Weininger,J.J.Chem.Inf. Comput.Sci.1989,29,97.
(23) Benson,S.W.Thermochemical Kinetics,2nd ed.;John Wiley: New York,1976.
(24) Kee,R.J.;Rupley,F.M.;Miller,J.A.Sandia National Laboratories Report No.SAND89-8009B.Sandia National Laboratories,Albuquerque,NM,1989.
(25)Fu,X.C.;Shen,W.X.;Yao,T.Y.;Hou,W.H.Physical Chemistry;Higher Education Press:Beijing,2006;pp 191-197. [傅献彩,沈文霞,姚天扬,侯文华.物理化学.北京:高等教育出版社,2006:191-197.]
December 28,2010;Revised:March 3,2011;Published on Web:March 17,2011.
Experiment and Kinetics Simulation on the Pyrolysis of n-Decane
JIAO Yi1LI Jun2WANG Jing-Bo2WANG Jian-Li1ZHU Quan2CHEN Yao-Qiang1,*LI Xiang-Yuan2,*
(1College of Chemistry,Sichuan University,Chengdu 610065,P.R.China;
2College of Chemical Engineering,Sichuan University,Chengdu 610065,P.R.China)
In this work,atmospheric cracking equipment was used to study the distribution of the main gas products ofn-decane pyrolysis including hydrogen,methane,and ethylene between 973-1123 K and at different residence time of 0.5-2 s.The detailed mechanism for n-decane pyrolysis,which was composed of 1072 steps and 281 species,was automatically generated by the ReaxGen program that was developed in our laboratory.We thus carried out kinetic modeling and the results were compared with experimental observations.Using sensitivity analysis we identified the main reaction steps,the alkyl rearrangement and the β-cleavage reactions,which mostly influence the distributions of hydrogen, methane,and ethylene at atmospheric pressure and 973 K with a residence time of 1 s.
Pyrolysis;Kinetics model;Relative sensitivity;n-Decane;ReaxGen
O643
∗Corresponding authors.CHEN Yao-Qiang,Email:chenyaoqiang@scu.edu.cn.LI Xiang-Yuan,xyli@scu.edu.cn;Tel:+86-28-85405233.
The project was supported by the National Natural Science Foundation of China(91016002)and National High-Tech Research and Development Program of China(863)(2006AA01A119).
国家自然科学基金(91016002)和国家高技术研究发展计划(863)项目(2006AA01A119)资助

