Rab7基因沉默对LPS活化的巨噬细胞中NO/iNOS的影响①
刘 帅 谢基明 王玉珍 宋 亮 王 娜 李云旭 孙晓琳
(内蒙古农业大学生命科学学院,呼和浩特010018)
脂多糖(Lipopolysaccharide,LPS) ,是 G-菌的主要致病成分,巨噬细胞受到 LPS刺激时,可激活细胞内p38丝裂原激活的蛋白激酶,并促使诱导型一氧化氮合酶(iNOS)等的表达,催化产生大量NO,参与炎症反应[1,2]。
NO是体内L-精氨酸(L-arginine)在一氧化氮合酶作用下产生的一种结构简单的小分子气体化合物,它具有十分重要的生理功能。在人体内,NO的作用主要包括两个方面:一是信号分子作用;二是具有细胞毒性作用,NO直接或间接地作用于细胞膜、染色体及其他细胞内成分,引起细胞死亡或癌变的过程。此外,NO形成的自由基还能作用于细胞外基质,引起细胞外基质成分的改变,进而调节血管生成[3]。
一氧化氮合酶作为NO合成的关键酶,其表达直接影响NO的生成。一氧化氮合酶家族有3种亚型:诱导型(inducible NOS,iNOS),神经型(neural NOS,nNOS) 及内皮型(endothelial NOS,eNOS)。其中,iNOS通常在炎症或肿瘤等病理条件下诱导产生,为Ca2+非依赖性,在细胞因子及其他细胞毒性物质的作用下产生大量的NO,加重炎性反应过程或产生致癌作用[3]。
Rab7是Rabs(Ras related proteins in brain)蛋白的一个成员,是一种单体形式的 GTP结合蛋白,能够结合GTP并将GTP水解[4]。在囊泡形成、转运、粘附、锚定、融合等不同的运输阶段调控囊泡的运输。Rab7定位在晚期内体并调节胞吞途径的晚期环节,它与一些受体的转运和溶酶体的降解有关,如血管紧张素1A受体、表皮生长因子受体、神经生长因子受体TrkA[5-7]。Rab7还调控晚期内体/溶酶体的聚集和融合,也是维持核周溶酶体结构所必须的蛋白[8]。之前有研究证明 Rab7b参与TLRs信号通路且负向调控 TLRs信号通路[9],鉴于 Rab7b与Rab7有50%的一致性和65%的相似性,我们推测Rab7和Rab7b可能有相似的功能。
siRNA是一种转录后基因沉默的强大工具。siRNA是由21~23个碱基配对形成的双链,其调控的机制是通过互补配对而沉默相应靶位基因的表达,siRNA识别靶序列是有高度特异性的。
本实验是通过在RAW264.7细胞中瞬时转染靶向于 Rab7的 siRNA,分析 Rab7基因沉默后的RAW264.7细胞的生长特性,研究Rab7基因沉默后对LPS刺激的巨噬细胞中NO/iNOS表达的影响,本研究为进一步探索Rab7在调控TLRs信号通路中的作用奠定基础。
1 材料与方法
1.1 实验材料及试剂 小鼠巨噬细胞RAW264.7(购自北京协和细胞库);胎牛血清(购自兰州民海生物有限公司);DMEM培养基(Gibco,USA);MTT、LPS(均为 Sigma公司产品);TRIZOL、反转录试剂盒、Taq酶、Real-time PCR mix(均为宝生物公司产品);FuGENE MD Transfection Reagent(购自罗氏公司);NO测定试剂盒(购自南京建成生物公司);Rab7抗体、actin抗体(均为Santa Cruz公司产品)。
1.2 siRNA的设计合成 从GenBank中查找小鼠Rab7基因的序列,根据 siRNA的设计原则,利用Ambion公司提供的网上在线设计工具,设计出三对siRNA序列。经Blast比对其特异性后,由上海吉玛制药有限公司合成。同时合成阴性对照N-siRNA。siRNA1:sense sequence:5'-CCAGUACAAAGCCACAAUAtt-3',antisense sequence:5'-UAUUGUGGCUUUGUACUGGtt-3';siRNA2:sense sequence:5'-CAGAAGUGGAACUGUACAAtt-3',antisense sequence:5'-UUGUACAGUUCCACUUCUGtt-3';siRNA3:sense sequence:5'-GUGGAACUGUACAAUGAAUtt-3',antisense sequence:5'-AUUCAUUGUACAGUUCCACtt-3'。
1.3 RAW264.7的培养细胞及瞬时转染 RAW264.7细胞株混悬后接种于含10%胎牛血清的DMEM培养基中,置37℃,5%CO2培养箱培养,1~2天换液或传代一次。将适量的RAW264.7细胞接种于相应的细胞培养板(6孔板:5×105个/孔)细胞密度达到90%时进行转染。转染时将siRNA与FuGENE MD Transfection Reagen混合,充分混匀,室温静置15分钟,以形成siRNA-转染试剂复合物,随后将复合物加入待转染的细胞中,转染后6~8小时换液。通过Real-time PCR和Western blot验证相应的干扰效果。
1.4 MTT法检测基因沉默对RAW264.7细胞的影响 细胞计数,将 RAW264.7细胞以相同量(1×103个/孔)接种于96孔板,设3个复孔。5~6小时贴壁后血清饥饿12小时,转染siRNA,开始计时,置37℃、5%CO2培养箱培养。转染后24、48、72小时加入 MTT(0.5 mg/ml),37℃、5%CO2培养 4小时,然后每孔加入150 μl DMSO,低速振荡10秒,酶联免疫检测仪用OD570 nm检测。
1.5 NO含量测定 细胞计数,将正常细胞以相同量(5×105)接种于6孔板,siRNA转染后40小时,LPS刺激6小时和12小时,吸取上清,按照NO测定试剂盒测定NO含量。
1.6 总RNA提取及iNOS表达分析 TRIZOL法提取细胞的总 RNA。1%琼脂糖凝胶电泳检测 RNA完整性,并用RNA/DNA计算器对提取RNA进行定量。1 μg RNA反转录cDNA。以5'-TGGAGCGAGTTGTGGATTGT-3'(sense)和5'-CTCTGCCTATCCGTC TCGTC-3'(antisense)作为 iNOS引物进行 RT-PCR和Real-time PCR。后者通过ABI 7300(Applied Biosystems,USA) 和 SYBR RT-PCR kit分析。
1.7 统计学分析 应用SPSS17.0软件进行分析,P<0.05时认为具有显著性差异。
2 结果
2.1 基因沉默后Rab7的表达 利用脂质体转染一段阴性对照(N-siRNA)和三段干扰序列(S-1、S-2、S-3)到巨噬细胞中,通过Western blot方法检测各段干扰序列的干扰效果,如图1A所示,与无关干扰相比,S-3序列干扰后,Rab7的蛋白表达量明显降低。我们又做了 Real-time PCR进一步验证,如图1B所示,S-3的干扰效果在50%。之后的实验就确定用S-3序列作为干扰序列。
2.2 MTT检测转染细胞生长趋势 我们随后检测了RAW264.7细胞中Rab7干扰后细胞的生长特性。从MTT测定的细胞生长趋势(图2)中可以看出,在Rab7干扰后48小时,RAW264.7的生长显著加速,到72小时时仍高于对照。
2.3 Rab7基因沉默后对LPS刺激的巨噬细胞中iNOS/NO的影响 NO因参与杀灭微生物而且介导一系列病理生理反应过程而日益受到人们的关注。我们通过检测LPS刺激Rab7基因沉默的细胞不同时间的NO分泌量,初步分析Rab7在LPS/TLR4通路中的作用。Rab7基因沉默的巨噬细胞中,NO的含量随着LPS刺激时间增加而增加,在LPS刺激后12小时,Rab7的沉默显著促进了NO的生成(图3)。
前面的实验结果表明,Rab7基因沉默促进了LPS介导的NO的产生。我们进一步研究这种抑制作用是否通过抑制iNOS的活性导致。用LPS刺激Rab7基因沉默后的巨噬细胞不同时间,通过 RTPCR检测iNOS的含量,发现随着时间的增加,iNOS的表达量明显增加,12小时达到最大值(图4A)。
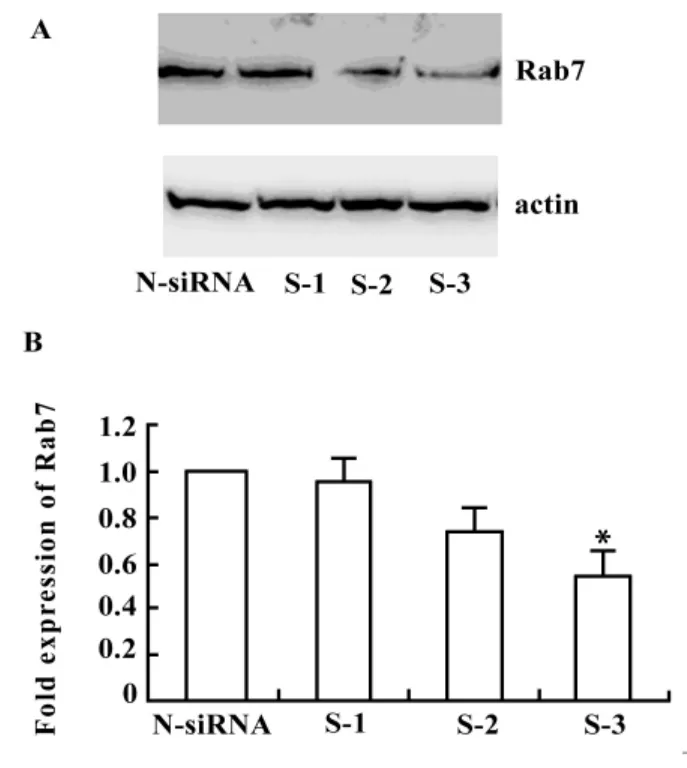
图1 Rab7在siRNA干扰后的表达Fig.1 Rab7 expression after silencing
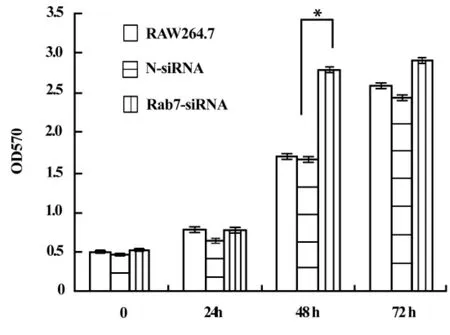
图2 Rab7干扰后细胞的生长趋势Fig.2 The growth trend of Rab7 silenced cells
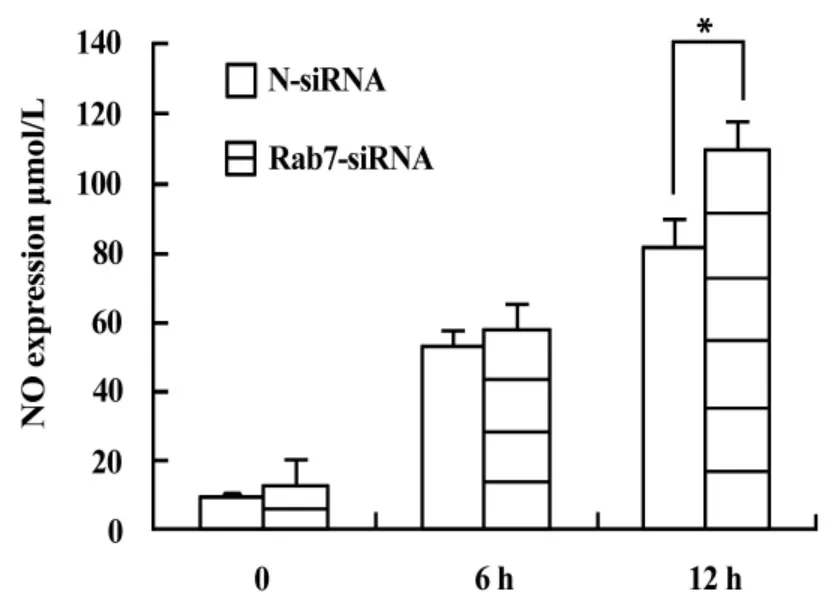
图3 NO含量测定Fig.3 NO determination
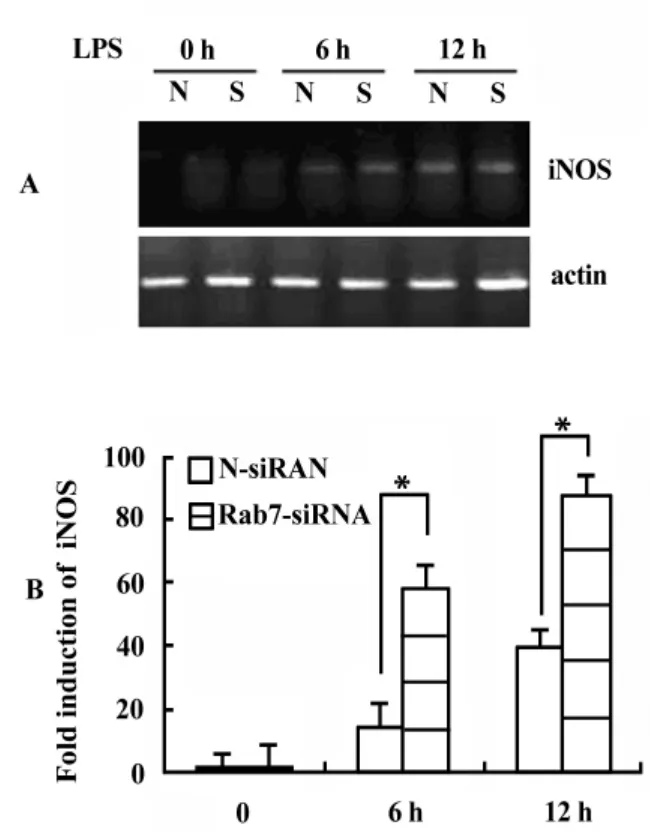
图4 iNOS含量测定Fig.4 iNOS determination
Real-time PCR(图4B)的结果显示,Rab7沉默后显著促进了LPS刺激的RAW264.7中iNOS的表达(P<0.01)以上的实验充分说明,Rab7基因沉默后促进了LPS诱导的RAW264.7细胞NO/iNOS的表达。
3 讨论
内源性NO参与了体内众多生理、病理过程,包括免疫调节、松弛平滑肌、神经递质及细胞毒作用等[10]。NO的生成过量与炎症发生密切相关。Poly I:C、LPS、IFN-γ、TNF-α、IL-1、IL-2、IL-6、IL-12 及粒细胞-巨噬细胞集落刺激因子(GM-CSF)等都能活化巨噬细胞,诱导iNOS表达及产生NO。NO是自由基性质气体,具有非常活泼的化学性质。正常情况下,NO维持时间长,具有重要的杀菌、抗病毒、杀伤肿瘤细胞等活性,但一旦失衡,就会导致体内自由基浓度过高及一系列自由基反应病理性加剧而诱发疾病。
通过NO和iNOS的含量测定表明Rab7基因沉默明显促进了LPS介导的NO和iNOS的生成。之前有实验结果表明稳定转染Rab7过表达质粒明显抑制了LPS介导的NO和iNOS的生成,并且Rab7失活突变基因的表达阻断了Rab7的抑制效应[11]。由此我们再次确定Rab7基因负向调控NO和iNOS的生成而且依赖其GTP酶的活性。
瞬时转染干扰RNA的成功为之后进一步研究Rab7对NO生成和Toll信号通路中的作用奠定基础。同时,炎症局部产生的多种细胞因子,可激活NO产生,NO又促进其中的多种细胞因子合成,进而引发瀑布式的炎症反应(Inflammatory cascade),所以我们可推测Rab7基因的沉默会正向调控IFN-γ、TNF-α和白介素等炎性因子的表达,也可能正向调控TLRs的信号转导通路。
1 Tinker A C,Wallace A V.Selective inhibitor of inducible nitric oxide synthase:potentianents for the treatment of inflammatory diseases[J].Curr Top Med Chem,2006;6(2):77-92.
2 夏晓东,吴立琴,徐 慧et al.罗红霉素通过诱导型一氧化氮合酶/一氧化氮途径抑制哮喘大鼠气道炎症[J].中国药理学通报,2009;25(9):1223-1236.
3 高 君.诱导型一氧化氮合酶与乳腺癌关系的研究进展[J].中国肿瘤,2007;16(12):991-993.
4 Hutagalung A H,Novick P J.Role of Rab GTPases in membrane traffic and cell physiology[J].Physiol Rev,2011;91(1):119-149.
5 Bucci C,Thimen P,Nicozizni P et al.Rab7:a key to lysosome biogenesis[J].Mol Biol Cell,2000;11:467-480.
6 Maximiliano G,Gutierrez,Daniela B et al.Rab7 is required for the normal progression of the autophagic pathway in mammalian cells[J].J Cell Sci,2007;117:2687-2697.
7 Wang Y,Chen T,Cao X et al.Lysosome associated small Rab GTPase Rab7b negatively regulates TLR4 signaling in macrophages by promoting lysosomal degradation of TLR4[J].Blood,2007;110(3):962-971.
8 Bingisser R M,Holt P G.Immuno-modulating mechanisms in the lower respiratory tract:nitric oxide mediated interactions between alveolar macrophages,epithelial cells and T-cells[J].Swiss Med Wkly,2001;131(13-14):171-179.
9 王宁飞,蔡富娟,刘 帅et al.过表达Rab7基因对LPS和Poly I:C活化的巨噬细胞RAW264.7中iNOS/NO的影响[J].中国免疫学杂志,2011;27(6):497-501.
10 Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010;11(5):373-384.
11 Manetti R,Annunziato F,Tomasevic L et al.Polyinosinic acid:polycytidylic acid promotes T helper type 1-specific immune responses by stimulating macrophage production of interferon-alpha and interleukin-12 Eur[J].Immunol,1995;25(9):2656-2660.

