反复发热、水肿、蛋白尿,突发腰痛
全军肾脏病研究所学术委员会
病例摘要
病史 患者男性,15岁,因“反复发热3月,水肿、蛋白尿2月,腰痛1周”于2010-01-27急诊入院。
患者2009年10月中旬在街头摊点“打耳洞”后出现伤口红肿、疼痛,并间断发热(体温不详),发热时间不规则,持续3~5 d,伴乏力,未予处理,自行好转,此后未监测体温。2009年11月下旬无诱因出现眼睑、双下肢水肿,当地医院尿检示“蛋白3+”,予青霉素静脉滴注1周症状无改善,继续予中药汤剂治疗1周,水肿较前加重,尿量减少至500~600 ml/d,并再次出现发热(自测体温 38.0℃左右),伴腹泻(黄色稀水样便,3~4次/d),偶有腹痛,至当地医院就诊测血压 100/70 mmHg,尿蛋白定量3.7 g/24h,血清白蛋白(Alb)8 g/L,血肌酐(SCr)90μmol/L,于2009-12-11始加服泼尼松50mg/d、低分子肝素皮下注射,体温降至37.0℃左右,腹泻好转,浮肿逐渐消退,尿量增加至约1 000 ml/d,未查尿检。2010-01-16尿量再次减少至800 ml/d左右,复查尿蛋白 5.7 g/24 h,Alb 16.4 g/L。2011-01-20凌晨无诱因出现腹部剧烈绞痛、持续左侧腰部胀痛,无放射痛,改变体位后无明显缓解,当地医院测体温 38.3℃,血压 140/89 mmHg,血淀粉酶、肾功能、电解质无异常,血常规示WBC 26.2 ×109/L,Hb 168 g/L,PLT 210 ×109/L,大量腹水。次日上午当地医院就诊,测血压150/87 mmHg,尿素氮(BUN)8 mmo/L,SCr 106 μmol/L,钾4.7 mmol/L,钠 126 mmol/L,TCO225.0 mmol/L,总胆固醇(Chol)15.1 mmol/L,三酰甘油(TG)2.00 mmol/L,血常规示 Hb 177 g/L,WBC 20 ×109/L,PLT 123×109/L,尿量偏少,行肾脏CTA示“左肾动脉栓塞”,予呋塞米、低分子肝素及头孢甲肟治疗1周,腰痛较前好转,体温仍在38℃左右,尿量波动于700~2 000 ml/d,为进一步诊治于2010-01-27收住我院。病程中无肉眼血尿、夜尿增多,无皮疹、关节痛、黑便、脱发、口腔溃疡,自觉无心慌、胸闷、心悸等不适。
相关病史 2009年8月时曾有左足外伤、出血史,当时未做局部消毒处理及抗感染治疗;个人史、家族史无特殊。
体格检查 体温38.1℃,脉搏79次/min,呼吸16次/min,血压 124/68 mmHg,发育正常,营养中等,慢性病容,平卧位,神清语利,颜面部及前胸多处散在痤疮,全身皮肤无皮疹、淤点、淤斑,未见Osler结节,未触及浅表淋巴结,结膜无充血,耳、鼻、口检查未见异常,咽部充血,扁桃体不肿大。双肺听诊呼吸音清晰,未闻及干湿啰音和胸膜摩擦音。心前区无隆起及凹陷,心前区未触及震颤和心包摩擦感,心相对浊音界正常,心率79次/min,心律齐,各瓣膜区未闻及杂音。腹部平坦,移动性浊音阴性,无压痛及反跳痛,未触及包块,左侧肾区轻度叩痛,双下肢轻度凹陷性浮肿。髋部、大腿外侧见大量紫纹,生理反射存在,病理反射未引出。
实验室检查
尿液检查 尿沉渣红细胞3万/ml(均一型),尿蛋白16.41~22.92 g/24 h(尿量 800~1 000 ml/d);C3 12.0mg/L,α2-MG 3.01mg/L,N-乙酰-β-葡萄糖苷酶(NAG)46.9 U/g·Cr,视黄醇结合蛋白(RBP)26.77mg/L,溶菌酶(Lyso)12.95mg/L,尿糖4+,中性粒细胞明胶酶相关脂质运载蛋白(NGAL)218.37μg/L(正常值 <20μg/L),肾损伤分子-1(KIM-1)93.69μg/L(正常值 <0.4μg/L),白细胞介素18(IL-18)1908.9 ng/L(正常值 <20 ng/L)。钠滤过分数0.33%,肾衰指数0.46。
血常规 Hb 111 g/L,WBC 7.9×109/L,N/L 0.72/0.19,PLT 300 ×109/L,CRP 51.8mg/L。
血生化 Alb 14.9 g/L,Glo 28.9 g/L,BUN 8.33 mmol/L,SCr 231.61 μmol/L,UA 279 μmol/L,CystatinC 2.71mg/L,ALT 13U/L,AST 59U/L,LDH 1106U/L,CK 20U/L,CK - MB 6 U/L,Chol 6.70 mmol/L,TG 1.31 mmol/L,钠 142.8mmol/L,钾 4.68 mmol/L,氯 115.9 mmol/L,TCO223.4 mmol/L,钙1.78 mmol/L,磷 1.24 mmol/L。
凝血功能 血浆纤维蛋白原解产物<5μg/ml,血浆 D二聚体测定 0.8mg/L(正常值 <0.5mg/L),3P试验阴性。
免疫学 ANA、A-dsDNA、ENA多肽抗体谱、ANCA,抗心磷脂抗体谱均为阴性,补体正常,IgG 4.44 g/L,IgA 2.56 g/L,IgM 1.22 g/L,IgE 320.9 IU/ml,ASO 51.0 IU/ml,RF < 20 IU/ml,ESR 87 mm/h,乙肝两对半:HbsAb(+),余(-),外周血淋巴细胞亚群 CD4+478 个/μl,CD8+772 个/μl,CD3+1 361 个/μl。
内皮细胞功能 抗内皮细胞抗体(AECA)1∶10,循环内皮细胞29个/ml(正常值<20个/ml),黏附分子 VCAM 4 530 ng/ml(正常值 300~1 000 ng/ml),血栓调节蛋白阴性。
影像学检查 胸片和肝胆胰脾B超:正常。心电图:1.窦性心律;2.T波V2-3略高尖。双肾彩超:左肾105 mm×51 mm×52 mm,右肾130 mm×60 mm×65 mm,双肾对比,右肾形态饱满,左肾轮廓欠规则,CDFI示:右肾血管树丰富,左肾血管树稀疏,双肾内未见肾盂肾盏扩张(图1A、B)。
肾脏ECT:左肾显影不清,滤过功能重度减低,GFR:15.1 ml/min;右肾滤过功能轻度减低,GFR:36.5 ml/min。
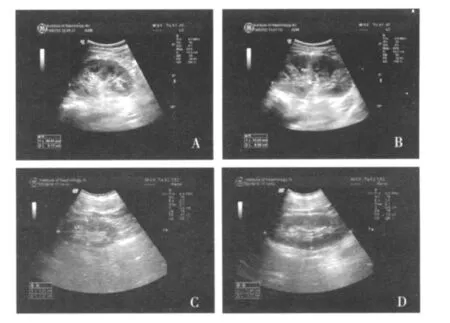
图1 双肾B超,右肾(B)体积明显大于左肾(A),左肾轮廓欠规则,右肾形态饱满(B);出院2个月后复查双肾B超,左肾体积明显缩小(C),右肾体积正常(D)
诊断分析
患者青年男性,临床表现为肾病综合征,经足量激素治疗2个月尿检持续不缓解,突发剧烈腹痛、左侧腰痛,伴有轻度发热、血压升高和急性肾损伤(AKI),结合临床表现和辅助检查,可以排除泌尿系结石和急腹症等疾病。根据患者持续肾病综合征不缓解,长期应用激素,未预防性抗凝治疗,突发急性腰腹痛,伴发热,AKI和高血压,D二聚体升高和右侧肾脏明显肿大,首先考虑右肾静脉血栓形成可能,但患者左侧腰痛明显,左肾体积如常,不支持该侧肾静脉栓塞,结合院外CTA检查结果,可以初步诊断为左肾动脉栓塞,右肾代偿性增大可能。
至此,临床上有必要进一步明确以下问题:(1)左肾动脉栓子来源于何处?性质如何?(2)是否还合并其他部位栓塞。
为此完善以下检查:(1)头颅MRI:右侧侧脑室旁、半卵圆中心异常信号,考虑缺血性改变。(2)复查肾脏CTA:左肾主干动脉梗塞(图2A、B),右肾多发局灶性动脉梗塞(图2C)。(3)心脏超声(2010-01-28):二尖瓣腱索及主动脉瓣所见赘生物形成,主动脉瓣上见长约7 mm条带状回声漂浮,二尖瓣后叶腱索见约6×7 mm团状强回声附着。

图2 A、B:双肾CTA检查示左肾动脉未显影(↑);C:右肾局灶性梗塞(↑)
围绕上述发现,需要考虑以下情形:(1)高凝状态致肾动脉栓塞:临床罕见,多在原有血管病变和损伤的基础上,继发性高凝状态导致血栓,如肾动脉狭窄、肾移植术后、肾动脉发育不良、抗磷脂抗体综合征、大动脉炎等。患者临床确实为典型的肾病综合征(NS),激素治疗长期不缓解,处于高凝状态。但无基础血管病变,为多部位多发血栓,这种可能性不大。(2)心脏来源的栓子致多部位栓塞:该患者有多发动脉栓塞,应高度考虑栓塞来源于大血管,尤其是左心腔,心脏超声证实主动脉瓣和二尖瓣多个赘生物存在,可以证实栓子的确来源于心脏,需要考虑感染性心内膜炎。
该患者在起病前3个月有明确感染诱因(左足外伤,打耳洞感染和反复发热),之后因NS服用足量激素治疗1月余,入院前因发热在当地医院使用抗菌素治疗后体温恢复正常。入院后患者仍有发热,CRP和ASO升高,合并轻度贫血、血沉增快等表现,故临床高度考虑感染性心内膜炎,但遗憾的是,入院后3次血培养均为阴性。
治疗经过
患者入院后即完善相关检查,诊断明确之后,给予抗感染、抗凝以及对症支持治疗。
减撤免疫抑制 患者为NS合并AKI,激素治疗不敏感,且合并感染及栓塞,故将激素快速撤减至甲泼尼龙16mg/d。
抗感染 患者入院时后体温和CRP偏高,首先考虑感染,留取血培养标本后即予哌拉西林/三唑巴坦(4.5 g,q8h)抗感染治疗,之后体温和CRP下降至正常,表明抗感染治疗有效。三次血培养均无菌生长。
抗凝 患者已有多个脏器栓塞,且NS、高凝状态尚未解除,予低分子肝素和华法林抗凝,氯吡格雷抗血小板聚集,并实时监测凝血功能,调整INR至稳定于2~3之间。
对症支持治疗 予优质低蛋白饮食加复方α酮酸,他汀类药物降脂、质子泵抑制剂护胃、EPO、虫草促进肾小管修复等治疗。
最后诊断
(1)感染性心内膜炎:左肾动脉(主干)栓塞、右肾多发性动脉栓塞、右侧脑室旁梗塞;(2)肾病综合征:急性肾损伤(1期)。
随 访
患者住院期间予哌拉西林/三唑巴坦(4.5g,q8h)抗感染,总疗程1个月,出院后予口服阿莫西林/克拉维酸,免疫抑制剂予甲泼尼龙16mg/d。出院后1个月后复诊,体温正常,未再出现腰痛,复查心脏超声赘生物消失,加用他克莫司3mg/d治疗。2个月后复查尿检达部分缓解,尿蛋白定量0.77 g/24h(参考值 <0.4 g/24h),Alb升至 36.5 g/L,SCr降至76.02μmol/L,双肾超声示左肾85 mm×33 mm×42 mm,右肾118 mm×47 mm ×54 mm(图1C、D),肾血管超声仍提示左肾各级动脉血流流速偏低,ECT示 GFR:左肾 13.1 ml/min,右肾 66.2 ml/min。随访至出院后3个月,复查尿检达完全缓解,尿蛋白定量 0.27 g/24h,Alb 47.0 g/L,SCr 61 μmol/L。此后患者每2个月随访1次,他克莫司血药浓度稳定,尿蛋白及Alb、SCr仍在正常范围。
讨 论
感染性心内膜炎的诊断 感染性心内膜炎(infective endocarditis,IE),指因细菌、真菌和其他微生物(如病毒、立克次体、衣原体、螺旋体等)循血液循环途径引起的心内膜、心瓣膜或临近大动脉内膜的感染并伴赘生物形成,有别于风湿热、类风湿、系统性红斑狼疮等所致的非感染性心内膜炎,其典型的临床表现包括发热、心脏杂音、贫血、栓塞、皮肤损害、脾大和血培养阳性等,但均不具有疾病特异性。
目前常用IE的诊断标准为1994年提出、2000年修订的 Duke 标准(表1)[1,2],修正后的 Duke 标准与原标准有相似的敏感性、特异性,但诊断时间上存在显著差异。本例患者具有以下特点:(1)经超声心动图检查证实有瓣膜赘生物;(2)有反复发热、贫血、多发动脉栓塞、肾小球肾炎等临床表现。(3)未闻及心脏杂音,无皮肤损害等表现。对照诊断标准,符合一项主要标准及三项次要标准,可确诊为感染性心内膜炎。遗憾的是,该患者在入院前1周已开始使用抗菌素治疗,入院后三次血培养(含厌氧菌培养,培养时间超过1周)都未取得阳性结果。文献报道血培养阳性率仅为23.7%~45.2%[3,4],血培养阴性最常见原因为:(1)已接受抗感染治疗;(2)有些特殊细菌需要培养较长时间(>6d),如HACEK菌群[即嗜血杆菌属(Haemophilus)、放线共生放线杆菌属(Actinobacillus)、人心杆菌(Cardiobacterium)、埃肯菌属(Eikenella corrrldens)和金氏菌属(Kingella)][5];(3)部分草绿色链球菌菌株存在营养缺陷,在普通培养基培养中生长不佳,需要在肉汤培养基中加入吡哆醇和半胱氨酸,采用普通培养基可能造成培养阴性[6];(4)部分患者为真菌感染,尤其是人工瓣膜置换,长时间静脉留置插管、导尿管,应用广谱抗生素、激素、免疫抑制剂的患者,此时如采用普通方法进行培养,可能造成培养阴性。

表1 感染性心内膜炎的Duke临床诊断标准
该患者起病初曾有一些非特异性侵袭症状,如全身不适、乏力、反复发热等,未引起重视,仅予抗感染治疗,此后肾脏病起病时因使用大量激素,可能掩盖了一些具有提示意义的症状。时至突发腰痛方才发现全身多发动脉栓塞,此时已无法用单纯的NS来解释,从而确立感染性心内膜炎的诊断。如果能够积极拓展诊断思路,尽量在使用抗生素或是肾动脉栓塞之前即进行全面系统的查体,或许可早期发现一些异常的体征,如脉压差增大、心脏杂音等,那么很容易诊断感染性心内膜炎,早期行血培养及心脏彩超等可能预防血栓发生。谢伟等[7]对一组IE患者的总结发现,随着卫生条件的改善及诊断手段的发展,IE的流行病学特点也在悄然改变,其血培养阳性率已逐渐下降,而超声心动图这一检查手段在IE的诊断中发挥了更为重要的作用。因此,对于一些非特异性症状的及时关注,早期的心脏超声检查,均有助于感染性心内膜炎的早期诊断。
感染性心内膜炎的肾脏损害 本例感染性心内膜炎患者,瓣膜赘生物脱落直接导致了左肾动脉主干梗塞及右肾多发性小梗塞,IE导致肾脏梗塞并不罕见,通常表现为腰部疼痛,肉眼血尿和肾功能急剧恶化,尸检发现42例感染性心内膜炎合并肾脏损害者中有19例肾脏有局灶梗塞[8]。但肾梗塞的误诊率非常之高,文献报道其从最初出现临床症状到确诊平均需4d[9],误诊的重要原因在于临床症状缺乏特异性的,常常导致延迟诊断甚至误诊。有证据表明,乳酸脱氢酶(LDH)升高是肾梗塞的敏感指标,在确诊的患者中有90%~100%存在LDH升高[10],另外一项研究亦证明谷丙转氨酶(ALT)和LDH在肾梗塞早期的患者都有升高[11]。本例患者有LDH和AST的升高,也符合肾梗塞。
IE的肾损害临床并不少见,抗生素临床应用前,约82%的亚急性细菌性心内膜炎合并肾小球肾炎,36%的急性细菌性心内膜炎合并肾小球肾炎。高瑞通等[12]报道了155例IE患者伴肾损害的比例高达88.4%。近年来随着心脏手术、介入治疗和肾移植的广泛开展,以及静脉吸毒人数的增加,IE导致肾损害的病例数呈逐年上升趋势,其临床表现多样[8,12],以无症状尿检异常最常见,其他还有急性肾炎综合征、NS、急进性肾炎综合征、肾梗塞等。
1910年Lohlein首次报告了IE伴肾脏损伤,并在病变肾小球内发现了致病性链球菌,从而认为IE所致肾损害本质上是感染性肾小球肾炎。致病菌以葡萄球菌和链球菌最常见。一般认为IE通过以下机制导致肾脏损害:(1)葡萄球菌毒素可直接损伤肾小球毛细血管或累及细胞而介导免疫反应;(2)肾小球内的微小细菌栓子;(3)赘生物脱落致肾各级动脉栓塞;(4)免疫复合物在肾脏沉积。基于以上四条途径,肾脏损害的病理表现多种多样[13],局灶节段性肾小球肾炎、新月体肾炎均可出现,可同时存在间质性肾炎。局灶节段性肾小球肾炎病理改变主要是节段内皮细胞、系膜细胞增生,少量中性粒细胞和单核细胞浸润,基膜正常。病情严重者病理改变为弥漫增生性肾炎,大量内皮细胞、系膜细胞增生,大量中性粒细胞和单核细胞浸润,或伴袢坏死,基膜双轨,同时存在细胞性或纤维细胞性新月体,肾小管间质病变重。急性肾小管环死、急性间质性肾炎在IE肾损害中也占相当比例,其主要原因是心力衰竭、脓毒症以及抗生素等药物的使用所致。ANCA相关的肾血管炎也有个别报道,临床非常罕见。而发生栓塞的患者病理表现为缺血性肾坏死。本例患者因多发栓塞需要抗凝、且单侧肾脏萎缩,未能行肾活检明确肾脏损害的病理类型及原发病因。
本例的肾脏损害是原发性NS、IE相关、抑或两者兼而有之?IE导致NS较为罕见,国内学者报道其在IE所致肾损害中仅占1.7%~2.9%[14,15]。本例患者出现NS及IE相关临床症状的时间间隔较短,且早期出现NS后激素治疗效果不佳,虽然IE导致肾损害并不常见,但仍应高度考虑,由于未行肾活检,故无法从病理角度进一步鉴别。但随访观察发现,随着IE得以控制,患者的肾脏病改善并不显著,而予泼尼龙+他克莫司治疗后尿检逐渐缓解,提示患者的肾脏病仍考虑为原发性肾小球疾病可能性大,而IE加重了原有病变。这也是加用抗凝治疗的一个重要依据。
感染性心内膜炎的泛发栓塞 栓塞为IE的常见并发症,仅次于心力衰竭。由于受损瓣膜上的赘生物被内皮细胞完全覆盖需6个月,因此栓塞可在发热开始后数天至数月内发生。IE的赘生物主要是由病原微生物、纤维蛋白、血小板、血细胞在心瓣膜表面附着而成,部分病原微生物可延伸至腱索、乳头肌和室壁内膜。随后感染病原体逐渐被巨噬细胞吞噬,赘生物被纤维组织包绕,发生机化、玻璃样变或钙化,最后被内皮上皮化,有些病变愈合后还会复发,重新形成病灶。赘生物其大小不一,单发或多发,质脆、易脱落,可形成大小不等的栓子随血流进入身体各器官产生栓塞,引起相应的脏器梗死或脓肿。何东权等[14]报道的我国IE患者栓塞的发生率为15.5%,心脏超声发现赘生物的比例达84.6%,最常见的栓塞部位为脑动脉及脾动脉,其次包括肺动脉、冠状动脉、肾动脉、下肢动脉、视网膜动脉等,其中心肌、肾、脾脏栓塞常不宜察觉,多在尸检中被发现。
IE的脑栓塞发病率国内文献报道其发病率达55%,居各器官之首[16]。2009年欧洲感染性心内膜炎防治指南中的提到,20%~40%的IE患者可发生神经系统栓塞事件[17],如脑卒中、出血性脑卒中、短暂性脑缺血发作、症状或无症状性感染性动脉瘤、脑脓肿、脑膜炎、中毒性脑病等。脑栓塞为本病严重并发症,病死率高,在早期突然出现者极易漏诊。一般好发于大脑中动脉及其分支,可导致偏瘫、口歪眼斜等明显的神经系统症状,如出现脑血管细菌性动脉瘤破裂,甚至可能导致蛛网膜下腔出血、颅内出血。其次是脾动脉栓塞,可突然出现左上腹或左肋下疼痛,导致腹膜炎甚至膈下脓肿。肠系膜栓塞亦可表现为急腹症,此时与脾动脉栓塞的鉴别诊断较为困难,需依赖于影像学。肺栓塞则多发于右侧心脏心内膜炎,如左侧心脏瓣膜上的细菌栓子通过未闭的卵圆孔时,可直达肺部造成肺栓塞,因此如IE患者出现呼吸道症状如咳嗽、咯血,应警惕是否有肺栓塞。冠状动脉发生急性栓塞可导致心绞痛、心肌梗塞、严重心律失常甚至猝死。视网膜动脉的栓塞可能导致突然失明。四肢动脉栓塞可引起肢体疼痛、苍白、发绀甚至坏死。此外,心内膜炎导致栓塞即便在痊愈后1~2年内,仍有再发栓塞可能,而并非病情复发,因此仍需长期随访观察。
本例患者以腰痛起病,首先发现肾梗塞,继而通过影像学检查发现右侧侧脑室旁、半卵圆中心缺血性改变,考虑梗塞可能,但没有脾梗塞、肺栓塞的依据。经治疗后复查左肾已萎缩,循环血流量较右侧明显偏低。虽然目前SCr正常,但未行肾脏的ECT检查,无法真正判断左侧肾功能及右侧代偿情况。该患者预后如何,仍需长期的随访观察。
抗凝治疗 一般而言,IE患者并不主张抗凝治疗,因为IE的特征性病变——赘生物,其本质上是大小不一的血小板和纤维素的非晶体形团块,其间网罗了丰富的病原微生物和炎性细胞,此时应更重视抗感染治疗,单纯的抗凝治疗反而可能导致栓子的脱落,并且增加颅内出血的风险。尤其是赘生物长度>10 mm或活动度大,更是新发栓塞的强烈的预测因素[18]。在 Chan等[19]针对在115例 IE 患者的研究中,加用阿司匹林并不能降低栓塞的风险,反而阿司匹林组的出血事件有增加趋势。
然而本例患者有其特殊之处。其多发栓塞是由IE所致,同时还合并NS和高凝状态(持续大量蛋白尿、低蛋白血症不缓解,高脂血症,血液浓缩)。而此类患者同时亦是静脉血栓的高危患者,部分患者甚至可能导致肺栓塞[20]。本例患者前期经积极地抗感染治疗后IE的临床表现好转,体温下降,复查赘生物消失而无明显瓣膜病变,血培养持续阴性,并非抗凝的禁忌症,而有明显的抗凝需求,因此给予华法林抗凝治疗。
小结:感染性心内膜炎临床表现多种多样,但都没有特异性,其诊断更多依赖于影像学和实验室检查,并且无论哪种诊断标准,都存在一定的漏诊率。因此,对一些非特异性症状加强早期针对性辅助检查,有助于感染性心内膜炎的早期诊断。栓塞是感染性心内膜炎的常见的并发症,对于已发现的脏器栓塞,应积极治疗,同时应警惕其他重要脏器的栓塞发生。尽早抗感染有助于控制原发病,但其预后如何,仍需长期随访观察。
1 Durack DT,LukesAS,Bright DK,et al.New criteria for diagnosis of infective endocarditis:Utilization of specific echocardiographic findings.Am JMed,1994,96(3):200 -209.
2 Li JS,Sexton DJ,Mick N,et al.Proposed modification tothe Duke criteria for the diagnosis of infective endocarditis.Clin Infect Dis,2000,30(4):633-638.
3 Dyson C,Barnes RA,Harrison GA.Infective endocarditis:An epide miological review of 128 episodes.JInfect,1999,38(2):87 -93.
4 Heiro M, Nikoskelainen J, Engblom E, et al. Neurologic manifestations of infective endocarditis:A 17-year experience in a teaching hospital in Finland.Arch Intern Med,2000,160(18):2781-2787.
5 Horstkotte D, Follath F, Gutschik E, et al. Guidelines on Prevention,Diagnosis and Treatment of Infective Endocarditis Executive Summary,European Heart Journal,2004,25(3):267-276.
6 Wilson WR,Zak O,Sande MA.Penicillin therapy for treatment of experimental endocarditis caused by viridans streptococci in animals.J Infect Dis,1985,151(6):1028 -1033.
7 谢 伟,孟 婕.感染性心内膜炎的临床变迁.中国现代医学杂志,2005,15(6):927-929.
8 Majumdar A,Chowdhary S,Ferreira MA,et al.Renal pathological findings in infective endocarditis.Nephrol Dial Transplant,2000,15(1):1782-1787.
9 Huang CC,Chen WL,Chen JH,et al.Clinical characteristics of renal infarction in an Asian population.Ann Acad Med Singapore,2008,37(5):416-420.
10 Hazanov N,Somin M,Attali M,et al.Acute renal embolism.Fortyfour cases of renal infarction in patients with atrial fibrillation.Medicine(Baltimore),2004,83(5):292-299.
11 Chu PL,Wei YF,Huang JW,et al.Clinical characteristics of patients with segmental renal infarction.Nephrology(Carlton),2006,11(4):336-340.
12 高瑞通,文煜冰,李 航,等.感染性心内膜炎的肾脏损害.中华肾脏病杂志.2005,21(8):4438 -4442.
13 李世军,刘志红.感染性心内膜炎的肾脏损害.肾脏病与透析肾移植杂志,2002,11(2):192-196.
14 何东权,陈知行,张尔永,等.感染性心内膜炎导致栓塞的临床分析.中华胸心血管外科临床杂志,2007,14(5):350-353.
15 王春艳,赵 烨,刘国平,等.感染性心内膜炎致肾脏损害临床观察.内蒙古医学杂志,2010,42(2):176-178.
16 肖志荣.39例感染性心内膜炎合并血管栓塞的临床研究.医学信息,2010,6(23):60-61.
17 Habib G,Hoen B,Tornos P,et al.Guidelines on the prevention,diagnosis,and treatment of infective endocarditis(new version 2009):the Task Force on the Prevention,Diagnosis,and Treatment of Infective Endocarditis of the European Society of Cardiology(ESC).Endorsed by the European Society of Clinical Microbiology and Infectious Diseases(ESCMID)and the International Society of Chemotherapy(ISC)for Infection and Cancer.Eur Heart J,2009,30(19):2369-2413.
18 Vilacosta I,Graupner C,San Roman JA,et al.Risk of embolization after institution of antibiotic t herapy for infective endocarditis.J Am Coll Cardiol,2002,39(9):1489 -1495.
19 Chan KL,Dumesnil JG,Cujec B,et al.A randomized t rial of aspirin on the risk of embolic event s in patient s with infective endocarditis.JAm Coll Cardiol,2003,42(5):775 -780.
20 吴 燕,刘志红.肾病综合征血栓的诊断处理.肾脏病与透析肾移植杂志,2010,19(5):449-450.

