果蝇血液标记基因srp原核表达质粒构建及多克隆抗体制备
鲁建鑫,雷孝锋,李 帆,江志刚,吴秀山,万永奇
(湖南师范大学蛋白质化学与发育生物学教育部重点实验室,心脏发育研究中心,中国 长沙 410081)
果蝇作为生物学研究的经典的模式动物之一,具有生命周期短,繁殖力强,子代数量多以及便于进行表型分析等其他模式动物无法匹及的优势.近年来果蝇更广泛地被应用于人类疾病的研究[1].
哺乳动物由造血干细胞产生各种血细胞谱系,通过形成特异的转录因子蛋白复合体,调控细胞由一个谱系到另一个谱系的分化,而这个过程是由分子水平决定的.小鼠的基因失活研究已鉴定出许多重要的生血转录因子,如GATA-1对红细胞系统的发育、GATA-2对血液的完全发育、GATA-3对T细胞的发育[2].在脊椎动物中,GATA家族的转录调节因子在分化和组织发育中都呈现出保守的功能特性.GATA-1,GATA-2和GATA-3对于血液的发育是不可或缺的,同时有研究表明果蝇中的serpent(srp)与脊椎动物中的Gata家族具有直接的同源性[3];值得注意的是,果蝇GATA的同源基因srp对胚胎血细胞的发育是必不可少的[4].
果蝇的成熟血细胞分化为3种不同的类型,分别是胞质融合细胞、含晶细胞和扁平细胞[5].在胚胎期果蝇血细胞首先从头部中胚层分化出来,并且能够在第5期通过GATA转录因子srp表达鉴定出来.srp表达的细胞被认为是血液前体细胞,是血细胞分化发育早期的一个标记基因.后期,srp又会与lz[6],ush[7]共同调节果蝇血细胞的分化和发育.
为了在果蝇等模式动物中进一步研究血液发育的进程及相关分子机制,作者克隆了果蝇中血液标记基因srp,成功实现原核表达并且制备了srp的多克隆抗体.srp基因全长17 884 bp,具有3个活性转录本,对应编码3种不同的多肽链,蛋白质具有锌指结构和GATA因子的特性.由于该基因全长过大,不便于进行基因全长的克隆和表达载体的构建,因此经生物信息学分析,选取srp基因中的540 bp进行克隆,该序列是其保守的特异性序列,且对应编码的蛋白有较强的亲水性,便于抗体制备过程中的纯化,在保证抗体特异性的前提下也利于实验本身载体的构建以及蛋白的表达,为利用果蝇研究血液发育奠定了基础.
1 材料与方法
1.1 材料
1.1.1 菌种、克隆表达载体 大肠杆菌E.coliDH5α,E.coliBL21菌株,由本实验室保种; pMD18-T克隆载体购自大连宝生物公司;pET28a原核表达载体菌种由本实验室提供.
1.1.2 酶及主要材料试剂 限制性内切酶EcoRⅠ和BamHⅠ,Taq DNA聚合酶,10×Loading buffer购自深圳晶美公司;连接酶购自大连宝生物公司;RNase购自Sangon公司;柱式DNA胶回收试剂盒购自TIANGEN;质粒提取试剂盒(离心柱型)购自OMEGA;Ni-IDA凝胶柱蛋白纯化试剂盒购自上海生工公司;蛋白胨、酵母提取物、氯化钠、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、IPTG(异丙基-β-D-硫代半乳糖苷)等购自上海生工公司;弗氏佐剂购自 Sigma公司.新西兰大白兔购自中南大学湘雅附一医院.
1.1.3 引物 用 Primer Premier 5.0 软件设计根据巢式PCR的原理和flybase网站提供的srp基因的序列设计引物,第一对引物:srp上游引物: 5′GAAAGTGGTTCATTGGTGACC 3′;下游引物:5′CGTAATGGAGTTCGGCAGCAGTT 3′.第二对带有酶切位点的引物:srp上游引物: 5′GATGGATCCGACGATATGAAA 3′BamHⅠ,下游引物: 5′CTGGAATTCGCTGGTGGAGCC 3′EcoRⅠ由上海生工公司合成.
1.2 方法
1.2.1srp基因ORF克隆及扩增 选取野生型成体果蝇30只,置于液氮中冷冻0.5 h,用Trizol法提取总RNA[8],并以之为模板进行反转录PCR扩增,构建cDNA文库.用第一对引物以反转录得到的cDNA文库为模板进行PCR扩增,用第二对引物以第一对引物的PCR产物为模板进行特异的序列扩增,反应条件为:95 ℃变性4 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,反应30个循环;72 ℃延伸8 min.所得PCR产物长540 bp,经纯化连接pMD18-T克隆载体,转化DH5α大肠杆菌,挑取克隆,提取质粒经BamHⅠ和EcoRⅠ双酶切鉴定后,送阳性克隆至上海生工生物有限公司测序.
1.2.2srp原核表达载体构建及蛋白诱导表达 选取测序正确的克隆质粒 pMD18-T-srp用BamHⅠ和EcoRⅠ双酶切后胶回收插入片段与同样经BamHⅠ和EcoRⅠ 双酶切回收的线性化表达载体 pET28a 连接构建表达质粒pET28a-srp转化 DH5 宿主菌,挑取克隆,提取质粒双酶切鉴定.把构建好的表达质粒pET28a-srp转化大肠杆菌 BL21感受态细胞.挑取单克隆菌落接种于 LB 培养基中,37 ℃摇荡过夜,转接扩大培养至菌液 OD600≈0.6时,37 ℃ 条件下,分别以0.2、0.4 mmol/L IPTG浓度诱导0、4、6、8 h,各取菌液制备电泳样品进行SDS-PAGE分析.
1.2.3 srp融合蛋白的纯化 通过各时段取样比较,选取0.4 mmol/L IPTG于37 ℃摇床诱导8 h的条件进行大量诱导.用液氮反复冻融将细菌超声裂解,离心取上清.4 ℃下与经Binding Buffer漂洗活化后的Ni-IDA凝胶柱结合,Washing Buffer洗去杂蛋白,Elution Buffer洗脱目的蛋白,获得纯化的His-srp融合蛋白,-80 ℃保存备用.
1.2.4 srp多克隆抗体制备 选取1只成年健康新西兰大白兔,耳缘静脉取血约5 mL,制备免疫前正常血清,作为阴性对照.将纯化得到的His-srp蛋白质按体积比1∶1与弗氏完全佐剂(购自Sigma公司)在注射器中推成乳剂后,对大白兔进行背部皮下免疫注射,分散15~20个点;注射速度尽量慢而均匀,其分布位置则尽量均匀分布于大白兔身体背部的各个部位;在第14、21、28天再将溶于0.5 mL生理盐水中的0.5 mg抗原蛋白与弗氏不完全佐剂按体积比1∶1在注射器中推成乳剂,进行背部皮下多点注射.第40天主动脉取血.兔血放在4 ℃冰箱静置过夜,随后3 000 r/min离心10 min,取血清分装保存于 -80 ℃.
1.2.5 srp多克隆抗体效价检测 将pET28a-srp转化大肠杆菌 BL21感受态细胞,诱导表达srp蛋白,收集总蛋白,SDS-PAGE电泳分离,用自制抗体srp的兔血清进行Westernblotting检测鉴定,设置抗体稀释浓度分别为1∶1 000、1∶1 500、1∶2 000、1∶3 000.同时,用空白血清作为对照.
2 结果
2.1 srp基因克隆至表达载体
以 cDNA 为模板,以巣式PCR,用Taq DNA 聚合酶扩增出的 DNA 经10 g/L琼脂糖凝胶电泳,大小为 540 bp,扩增的srp基因片段经BamHⅠ和EcoRⅠ双酶切鉴定,送至上海生工测序正确后,克隆于原核表达载体 pET28a中,再次经BamHⅠ和EcoRⅠ双酶切鉴定,片段大小相符(图 1), 成功构建pET28a-srp原核表达载体(图2).
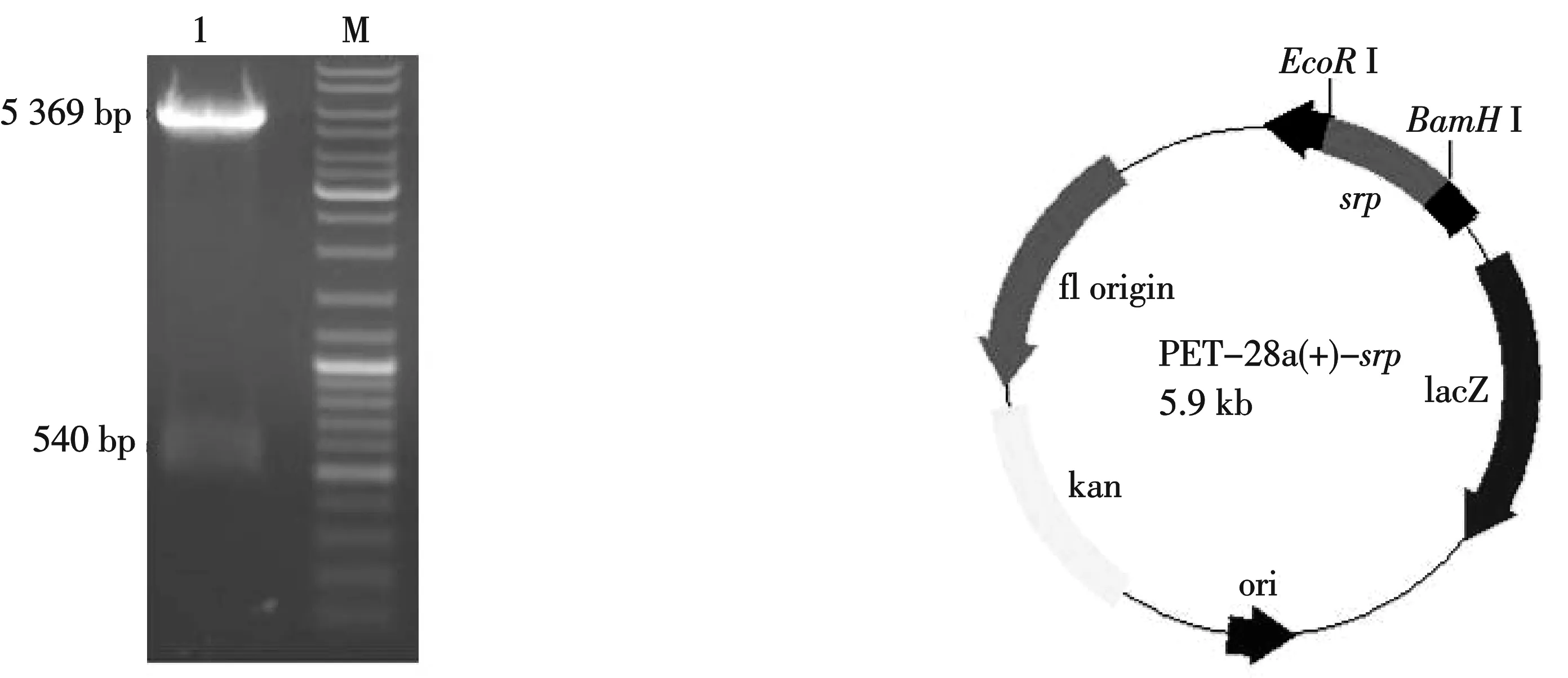
1:pET28a-srp质粒BamHⅠ和EcoRⅠ双酶切样品 Mark: DNA Maker 0331 10 000 bp 图1 重组质粒pET28a-srp双酶切鉴定 图2 质粒pET28a-srp示意图
2.2 srp融合蛋白的表达及纯化
把构建好的表达载体pET28a-srp 转化到大肠杆菌 BL21感受态细胞后,分别以0.2、0.4 mmol/L IPTG进行诱导表达,并在0、4、6、8 h分别取样,其表达产物进行 SDS-PAGE 电泳分析(图 3),可明显观测到一条相对分子质量约为35 000大小的特异蛋白,与预期的srp融合蛋白相对分子质量一致.
融合蛋白经Ni-IDA凝胶柱亲和纯化后,SDS-PAGE电泳,最后经考马斯亮蓝染色,显示为单一的条带,纯度为85%以上,并且为可溶性蛋白(如图4).
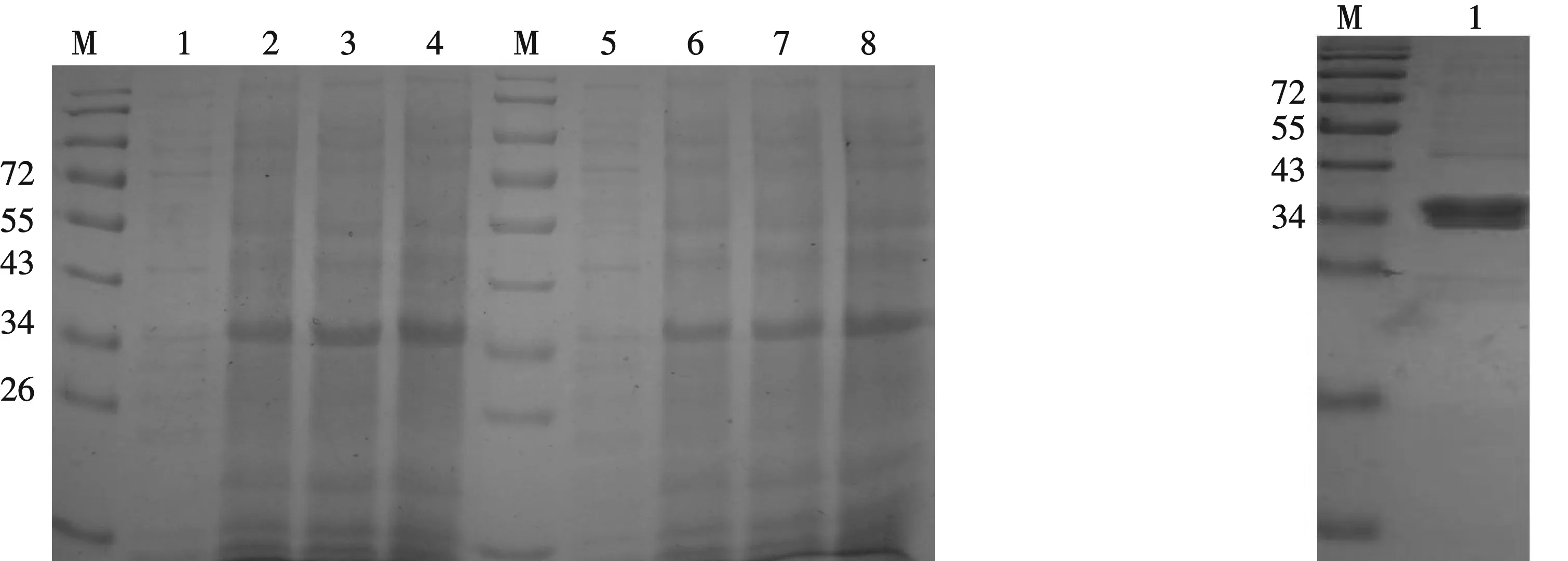
M:0671蛋白 Mark M:0671蛋白 Mark1,2,3,4分别为0.2 mmol/L IPTG诱导下0、4、6、8 h取样表达情况 1:纯化后的srp融合蛋白5,6,7,8分别为0.4 mmol/L IPTG诱导下0、4、6、8 h取样表达情况图3 重组质粒pET-28a-srp在BL21中的诱导表达 图4 srp融合蛋白的纯化
2.3 srp多克隆抗体效价检测
将pET-28a-srp转化BL21菌株诱导表达的总蛋白进行Western blotting检测,用自制srp的多克隆抗体分别用PBS进行1∶1 000、1∶1 500、1∶2 000、1∶3 000梯度稀释作为一抗进行检测,同时用空白血清作为阴性对照,检测结果如图5所示,srp抗体有显著的特异性.

图5 srp多克隆抗体效价检测鉴定
3 讨论
试验中选用的pET-28a原核表达载体与其他表达载体不同之处在于其C、N两端均含编码His-tag标签的蛋白序列,如一端有移码突变,能保证目的蛋白仍带有Histag标签蛋白,并且不论目的蛋白在上清或沉淀表达,都可用Ni-IDA凝胶柱亲和纯化获得有活性目的蛋白,使用便捷.同时此方法检测 His-tag融合蛋白时会出现相对分子质量偏大的状况,估测出的相对分子质量比按核苷酸顺序所推导计算出的值有不同程度(5 000~10 000)的偏差,产生偏差的原因是由于 His-tag中的碱性氨基酸的作用造成蛋白在 SDS-PAGE中迁移变慢[9].
此外,在多克隆抗体的制备过程中,诱导表达的蛋白容易以包涵体的形式进行表达[10],包涵体的形成是由于范氏引力、疏水作用力和二硫键等作用力形成的,破坏这些作用力比较困难,溶解包涵体需要加入强的变性剂破坏多肽链之间的作用力,并且包涵体的复性水平往往很低,因此需要变性、复性等复杂过程才能得到可溶性的融合蛋白.实验过程中可以通过降低诱导温度的方法减少包涵体的形成,尽量使融合蛋白在上清中表达,简化蛋白纯化的过程,也利于对动物进行免疫注射.注意免疫结束后一周内及时进行取血,本次试验中由于取血时间比正常的一周时间晚了5天,造成抗体的效价稍有降低,但是对于抗体的使用并不造成影响.
目前,国内外对于血液发育的研究关注日益增加,srp作为果蝇这一经典模式动物中血液发育早期标记基因,血液前体表达GATA因子srp,并诱导胞质融合细胞和含晶细胞的生成.胞质融合细胞散布在整个淋巴腺中且充当巨噬细胞的角色,而含晶细胞中含晶状内含物在血淋巴中参与致病物质的黑化.最新研究表明srp对于血液前体细胞的休眠状态的调整也起着关键的作用[11],srp具有非常重要的研究意义.本文实验所构建的srp原核表达载体以及srp基因的多克隆抗体则为日后深入研究奠定了基础.
参考文献:
[1] 万永奇,谢 维.科学与人类疾病研究的重要模型——果蝇[J]. 生命科学,2006, 18(5):425-429.
[2] LEBESTKY T, CHANG T, HARTENSTEIN V,etal. Specification of drosophila hematopoietic lineage by conserved transcription factors[J]. Science, 2000, 288(5463):146-149.
[3] REHORN K P, THELEN H, MICHELSON A M,etal. A molecular aspect of hematopoiesis and endoderm development common to vertebrates and Drosophila[J]. Development,1996,122(12):4023-4031.
[4] CORY J E, VOLKER H, UTPAL B. Thicker than blood:conserved mechanisms in drosophila and vertebrate hematopoiesis [J]. Dev Cell, 2003(5):673-690.
[5] CROZATIER M, MEISTER M. Drosophila haematopoiesis[J]. Cell Microbiol, 2007,9(5):1117-1126.
[6] WALTZER L, FERJOUX G, BATAILLL,etal. Cooperation between the GATA and RUNX factors serpent and lozenge during drosophila hematopoiesis[J].EMBOJ, 2003,22(24):6516-6525.
[7] MURATOGLU S, HOUGH B, MON S T,etal. The GATA factor Serpent cross-regulates lozenge and u-shaped expression during drosophila blood cell development[J]. Dev Biol, 2007, 311(2):636-649.
[8] 刘 红,任笑蒙,李 君,等.果蝇组织总RNA的电泳谱型鉴定[J].医学研究通讯,2004, 33(4):48-49.
[9] 唐威华,张景六,王宗阳,等.SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J].植物生理学报, 2000, 26(1):64-68.
[10] 朱 婷,黄 文,王跃群,等.斑马鱼hand2基因的克隆,抗体制备及分析[J].湖南师范大学自然科学学报,2010,33(1):108-113.
[11] TOKUSUMI Y, TOKUSUMI T, STOLLER-CONRAD J,etal. Serpent, suppressor of hairless and U-shaped are crucial regulators of hedgehog niche expression and prohemocyte maintenance during drosophila larval hematopoiesis[J].Development, 2010, 137(21):3561-3568.
[12] 吴秀山,王跃群,袁婺洲,等.心脏发育概论[M].北京:科学出版社,2006.

