新型2-(2-氨基噻唑-4-基)-2-(Z)-甲氧亚胺基乙酸酯类衍生物的合成及其抑菌活性*
张 剑, 周思泓, 徐 聪, 乔 柱, 周文明, 马希汉
(西北农林科技大学 理学院,陕西 杨凌 712100)
甲氧基丙烯酸酯类杀菌剂具有作用机制独特、杀菌谱广、杀菌效果优良,以及对环境的相容性好等特点,但近年来已有病菌对其产生了抗药性[1~3]。为寻找新的具有良好生物活性的此类化合物,可以将其与低毒、生物活性高的噻唑环[4]结合,形成含有噻唑环的甲氧丙烯酸酯类化合物——2-(2-氨基噻唑-4-基)-2-(Z)-甲氧亚胺基乙酸酯(A)。 A是重要医药中间体[5],广泛应用于头孢噻肟钠、头孢地嗪钠、头孢曲松钠、头孢匹美、头孢匹罗等第三,第四代半合成头孢菌素的合成中,但鲜有将A用于农药研发的报道。
本文以乙酰乙酸甲(乙)酯(1a,1d),醛(3a~3d)和酰氯(4f~4h)为主要原料,合成了8个2-(2-氨基噻唑-4-基)-2-(Z)-甲氧亚胺基乙酸酯类衍生物(5a~5e,6f~6h, Scheme 1),其中6个为新化合物,其结构经1H NMR, IR和MS表征。通过测定其生物活性,希望发现生物活性高的化合物,进而进行新农药的开发和研制。

Scheme1
1 实验部分
1.1 仪器与试剂
XT-4型显微熔点仪(温度计未校正);Bruker Avance DPX300型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet Avatar 330 FT-IR型红外光谱仪(KBr压片);Thermo Finnigan LCQ Advantage型质谱仪。
所用试剂均为分析纯。
1.2 合成
(1) 2-(2-氨基噻唑-4-基)-2-(Z)-甲氧亚胺基乙酸甲酯(2a)的合成[5~7]
在反应瓶中加入乙酰乙酸甲酯(1a)26.7 g(230 mmol),亚硝酸钠17.1 g(250 mmol)和蒸馏水100 mL,剧烈搅拌下于0 ℃~5 ℃缓慢滴加稀硫酸[V(浓硫酸)∶V(蒸馏水)=1.0∶4.5]50 mL(1 h内),反应2 h(TLC跟踪)。用5%NaOH溶液调至pH 7~8得2-羟基亚胺基乙酰乙酸甲酯溶液。剧烈搅拌下于室温缓慢滴加硫酸二甲酯25 mL(260 mmol)(25 ℃~30 ℃),滴毕,继续反应3 h(TLC跟踪,用5%NaHCO3溶液维持反应液pH 7~8),用二氯甲烷(3×30 mL)萃取,合并有机相,用水洗至中性,无水硫酸钠干燥过夜,过滤得2-甲氧基亚胺基乙酰乙酸甲酯的二氯甲烷溶液。加入冰乙酸3 mL,搅拌下于40 ℃~50 ℃极缓慢滴加溴素27 g(170 mmol),滴毕,继续反应5 h~6 h(TLC跟踪)。用5%碳酸氢钠溶液(3×30 mL)洗涤,水洗至中性,无水硫酸钠干燥过夜;减压蒸除溶剂得淡黄色油状液体4-溴-2-甲氧基亚胺基乙酰乙酸甲酯(B)。
在反应瓶中加入硫脲19.0 g(0.25 mol),无水乙酸钠20.5 g(0.25 mol),甲醇100 mL及蒸馏水50 mL,剧烈搅拌使其完全溶解。于室温缓慢滴加B,滴毕,缓慢升至30 ℃~35 ℃,反应4 h(TLC跟踪)。冷却至室温,过滤,滤液加入500 mL冰水中,用3%NaOH溶液调至pH 5~6。析出大量黄色沉淀,静置,抽滤,合并两次滤饼,用水洗涤。合并滤液与洗液,用乙酸乙酯(3×30 mL)萃取;合并萃取液,用无水硫酸镁干燥,减压蒸除溶剂,残余物用混合溶剂{V(二氯甲烷)∶V[石油醚(60 ℃~90 ℃)]=4∶5}重结晶得淡黄色晶体2a21.4 g, m.p.166 ℃~168 ℃,总产率43.2%(以1a计);1H NMR(DMSO)δ: 3.80(s, 3H, CO2CH3), 3.87(s, 3H, NOCH3), 6.94(s, 1H, 5-H), 7.26(s, 2H, NH2); IRν: 3 446, 3 254, 3 129, 1 736, 1 616, 1 542, 1 265, 1 034 cm-1。
用1d替代1a,用类似的方法制备黄色晶体2-(2-氨基噻唑-4-基)-2-(Z)-甲氧亚胺基乙酸乙酯(2d)(环合反应中用乙醇替代甲醇),总收率42.1%(以1d计), m.p.162 ℃~164 ℃;1H NMR(DMSO)δ: 1.24~1.28(t, 3H, CH3), 3.86(s, 3H, NOCH3), 4.24~4.31(q, 2H, COCH2), 6.90(s, 1H, 5-H), 7.25(s, 2H, NH2); IRν: 3 442, 3 262, 3 130, 1 728, 1 619, 1 541, 1 266, 1 029 cm-1。
(2) 亚胺类衍生物的合成(以5a)为例[8]
在三口瓶中依次加入2a646 mg(3 mmol),对甲氧基苯甲醛(3a)562 mg(4 mmol),六氢吡啶3~5滴及甲苯10 mL,搅拌下回流(110 ℃)反应3 h。减压蒸除溶剂,残余物经硅胶柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=10∶1]分离得5a。
用类似的方法合成5b~5e。
(3) 酰胺类衍生物的合成(以6f)为例[9,10]
冰浴冷却下,向装有氯化钙干燥管的三口瓶中加入2d430 mg(2 mmol),三乙胺0.4 mL(3 mmol), 4-二甲氨基吡啶(DMAP)15 mg和二氯甲烷20 mL,搅拌下于0 ℃~5 ℃滴加丙酰氯(4f) 0.7 mL(6 mmol),滴毕,继续反应2 h(TLC跟踪)。用饱和食盐水(3×30 mL)洗至中性,无水硫酸钠干燥过夜,经硅胶柱层析(洗脱剂:A=8∶1)分离得6f。
用类似的方法合成6g和6h。
1.3 抑菌活性测定
采用生长速率法,即将供试药剂与未凝固的培养基混合均匀接上菌种,用带药培养基培养病菌。通过病菌培养速度快慢来判断药剂毒力的大小,以十字交叉法测出菌落直径[菌落扩展直径/cm=菌落直径平均值-0.4(菌饼直径)],计算抑制率[菌丝生长抑制率/%=(直径对照菌-直径受试菌)/直径对照菌×100%]。
2 结果与讨论
2.1 合成
在2的合成中,溴化反应是关键环节。该反应有一个很长的诱导期,本研究采用加入冰乙酸缩短诱导期,加快了反应进程;溴素的量稍微过量即可,避免生成多溴取代物。环合过程是放热反应,伴随溴化氢的产生,温度过高、酸性过强,产物会部分转化为反式异构体,使其纯度下降,故需加入一定的碱中和生成的溴化氢。本文采用乙酸钠作碱,既可以有效吸收生成的溴化氢,也可避免碱性过强对化合物酯结构造成破坏。
在5的合成中,采用以甲苯为溶剂,哌啶为催化剂,回流的反应条件,既克服了文献[8]方法中使用乙醇和DMF为溶剂时的缺点,又避免了使用毒性较大的苯;提高产率,后处理方便,反应效果较理想。在6的合成中,采用DMAP作为催化剂,缩短了反应时间,减少了副产物的生成。
5和6的实验结果和质谱数据见表1,1H NMR和IR数据见表2。
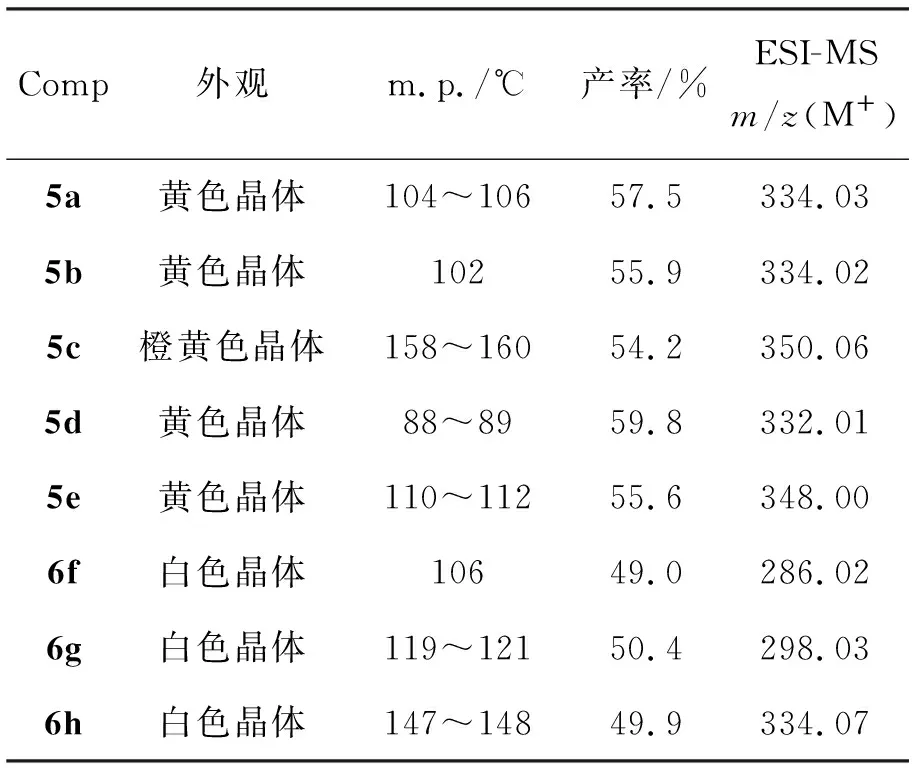
表1 5和6的实验结果
2.2 抑菌活性
以等量丙酮为空白对照,给药量200 mg·L-1,以小麦赤霉病菌(Ⅰ),马铃薯干腐病菌(Ⅱ),白菜黑斑病菌(Ⅲ),棉花枯萎病菌(Ⅳ),烟草赤星病菌菌(Ⅴ)和水稻稻瘟病菌(Ⅵ)为供试菌种,对5和6进行抑菌活性测试,结果见表3。由表3可见,亚胺类化合物(5)的抑菌活性无明显规律,只是个别化合物表现出较好的抑菌活性(例如,5a对Ⅱ的抑制率71.7%)。而酰胺类化合物也具有一定的抑菌活性,其中含苯环结构化合物(6h)的抑菌活性明显好于脂肪烃和环脂肪烃化合物(6f,6g)。以此推断,我们可以利用含苯环结构,且邻、对位上取代有其他基团(如卤原子)的化合物对中间体进行衍生,并进一步的对其生物活性进行测定研究。
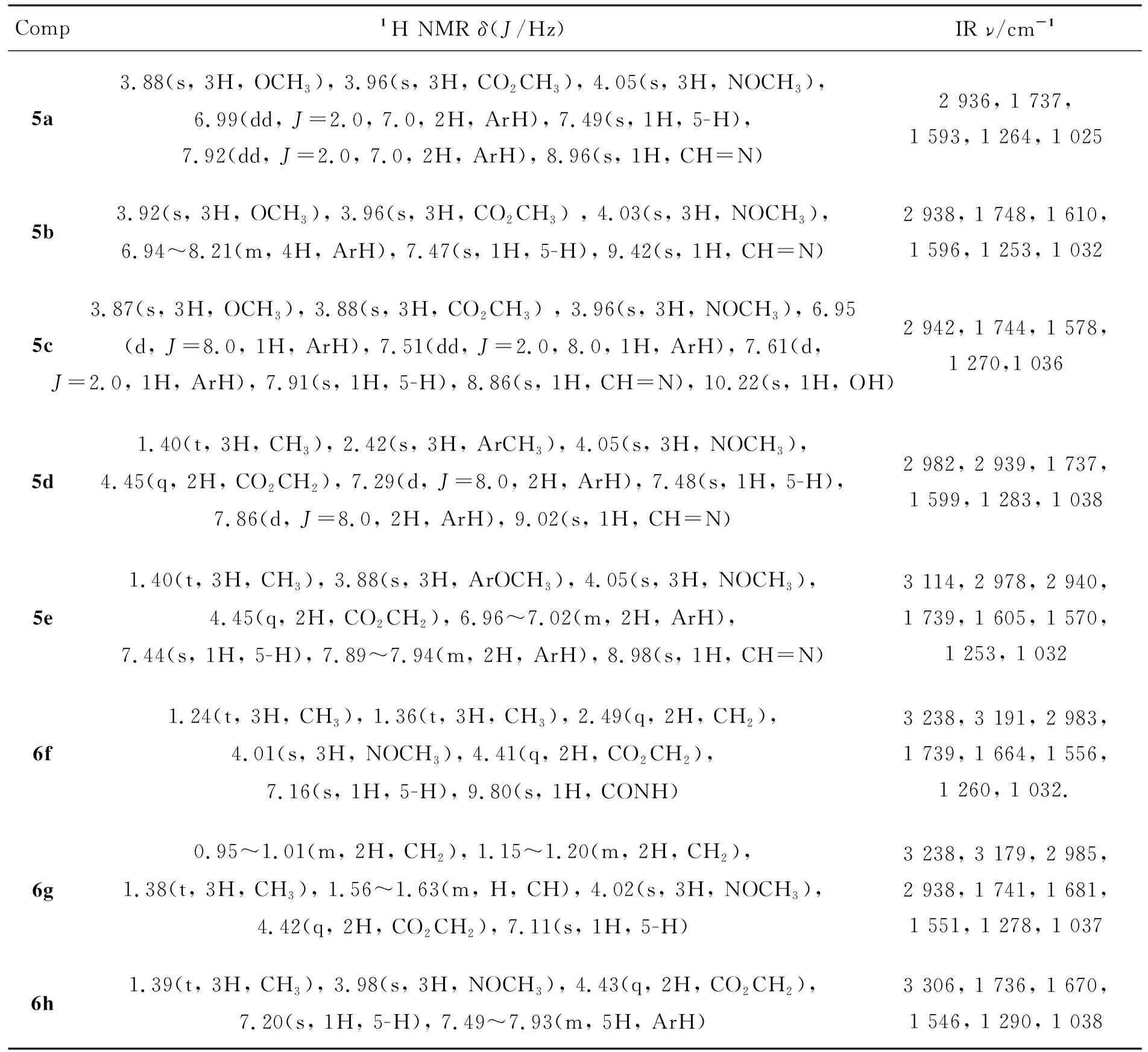
表2 5和6的1H NMR和IR数据
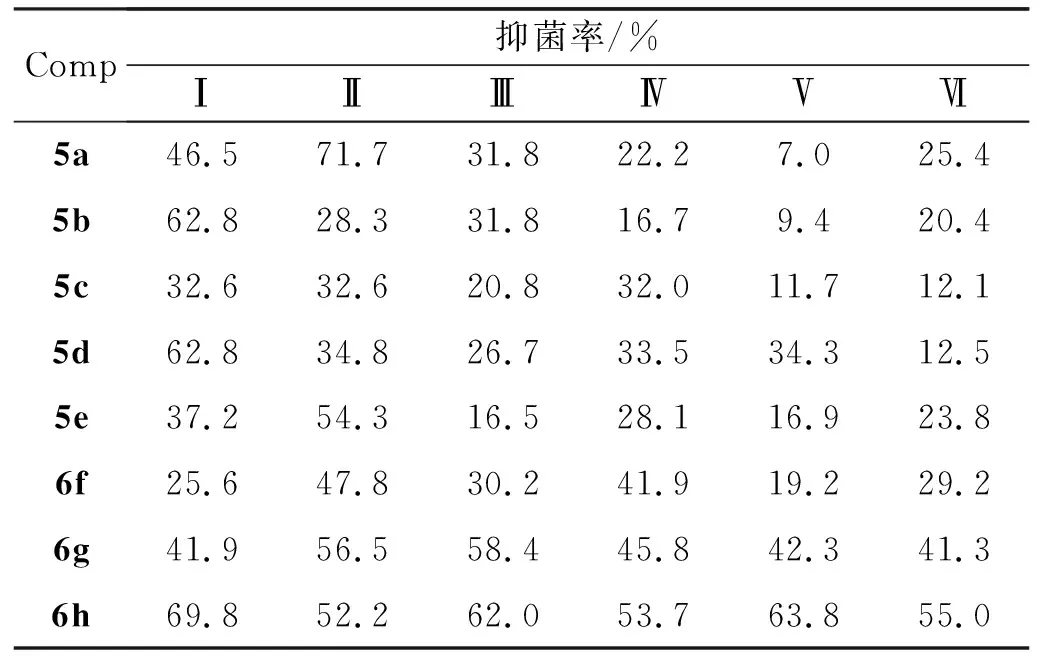
表3 5和6的抑菌率*
*Ⅰ:小麦赤霉病菌;Ⅱ:马铃薯干腐病菌; Ⅲ:白菜黑斑病菌;Ⅳ:棉花枯萎病菌;Ⅴ:烟草赤星病菌菌;Ⅵ:水稻稻瘟病菌
3 结论
合成了8种2-(2-氨基噻唑-4-基)-2-(Z)-甲氧亚胺基乙酸酯类化合物。初步的抑菌测试结果表明,他们对小麦赤霉病菌,马铃薯干腐病菌,白菜黑斑病菌,棉花枯萎病菌,烟草赤星病菌菌和水稻稻瘟病菌均表现出一定的抑菌活性。为今后进行更多类型基团衍生物的合成,以期找到活性更好的新化合物提供依据。
[1] 刘长令,张立新,汪灿明,等. 甲氧基丙烯酸酯类杀菌剂的研究进展[J].农药,1998,37(3):1-6.
[2] 张一宾. 世界农药新进展[M].北京:化学工业出版社,2006.
[3] 骆焱平,李元祥,赵培亮,等. 甲氧丙烯酸酯类杀菌剂的研究进展[J].中国科技论文在线,2006,1(1):20-26.
[4] 罗晓艳,任叶果,黄明智. 具杀菌活性噻唑类化合物的研究进展[J].农药研究与应用,2006,10(3):5-8.
[5] 李爱军,周雪琴,刘东志. 2-(2-氨基噻唑-4-基)-2-(Z)-甲氧亚胺基乙酸苯并噻唑硫酯合成工艺的改进[J].精细化工,2005,22(10):792-794.
[6] Liu C L, Li Z M, Zhong B. Synthesis and biological activity of novel 2-methyl-4-trifluoromethyl-thiazole-5-carboxamide derivatives[J].Journal of Fluorine Chemistry,2004,125:1287-1290.
[7] 杨柏青,耿东涛,屈海涛. 2-(2-氨基噻唑-4-基)-(Z)-甲氧亚氨基乙酸乙酯合成方法的改进[J].黑龙江医药,2004,17(2):128-129.
[8] 邵玲,张青,周欣,等. 新型含噻唑和三唑环的亚胺类化合物的合成及生物活性研究[J].高等学校化学学报,2007,28(2):270-273.
[9] Christoph G. 4-Dimethylamino-pyridine(DMAP)[J].Synlett, Spotlight 68,2003,10:1568-1569.
[10] Michihiko Ochiai, Akira Morimoto, Yoshihiro Matsushita. Ester of 7-[2-(2-aminothiazol-4-yl)-2-(syn)-methoxyiminoacetamido]-3-methyl-ceph-3-em-4-carboxylic acid[P].US 4 680 390,1987.

