新型异噁唑啉类化合物的合成及其抗肿瘤活性
刘冰妮, 刘 默, 刘登科, 刘 巍, 祁浩飞
(1. 天津药物研究院 天津市分子设计与新药发现重点实验室,天津 300193;2. 天津工业大学 材料科学与工程学院,天津 300160)
异噁唑啉化合物因具有广泛的生物活性,如抗菌、抗炎、抗肿瘤[1~3]等而成为重要的医药中间体及先导化合物。对异噁唑啉类化合物的结构改造一直是该领域的研究热点之一[4]。
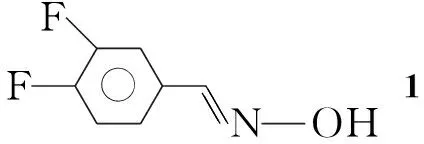
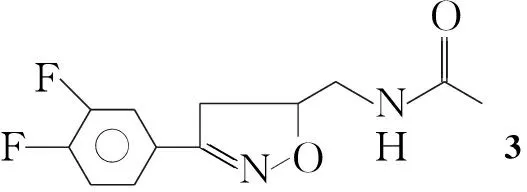
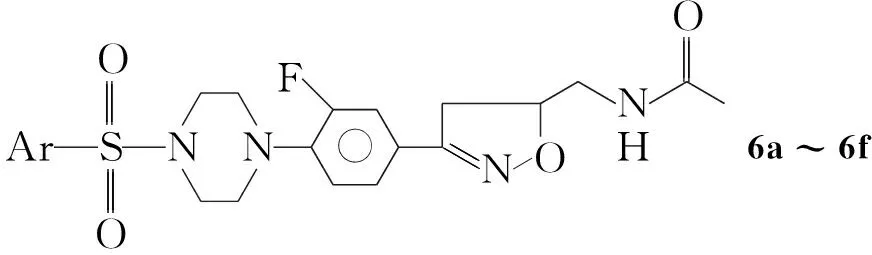
为寻找抗肿瘤药物提供筛选目标,本文在文献[1]方法的基础上,以3,4-二氟苯甲醛为起始原料,依次合成了3,4-二氟苯肟(1), 3,4-二氟苯肟氯化物(2),N-5-(乙酰胺甲基)-3-(3,4-二氟苯基)异噁唑啉(3)和N-【{3-[3-氟-4-(1-哌嗪基)苯基]-4,5-二氢-5-异噁唑}甲基】乙酰胺(4)等重要中间体。4与取代苯磺酰氯(5a~5f)经亲核取代反应合成了6个新型的异噁唑啉类化合物(6a~6f, Scheme 1),其结构经1H NMR和MS表征。采用MTT法测试了6a~6f对骨肉瘤细胞(U2OS)和结肠癌细胞(HT-29)的抑菌活性,结果表明,6a~6f的IC50值均小于5-Fu,表明其具有较好的抑制U2OS和HT-29的作用,特别是6a,6c和6e表现出较强的抗肿瘤细胞的活性。
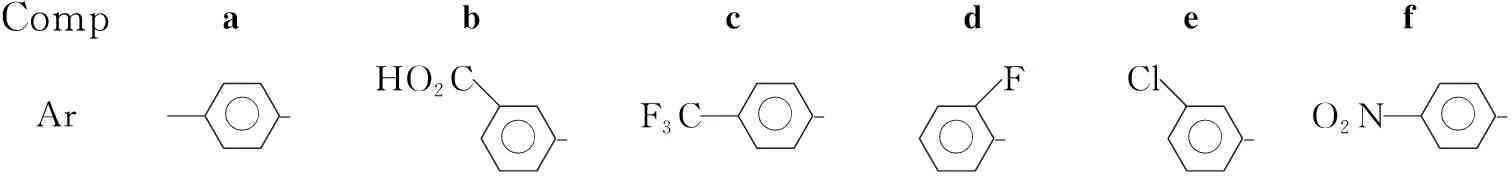
CompabcdefAr - HO2C- F3C- F- Cl- O2N-
Scheme1
1 实验部分
1.1 仪器与试剂
Bruker AV400型核磁共振仪(DMSO为溶剂,TMS为内标);LCQ AD MAX型质谱仪;Sunrise型酶联免疫检测仪。
3,4-二氟苯甲醛,工业品;N-烯丙基乙酰胺,自制;其余所用试剂均为分析纯;5-Fu注射液,天津金耀氨基酸有限公司;MTT, Amresco公司;DMEM培养基,Gibco公司;U2OS和HT-29,中科院上海细胞研究所。
1.2 合成
(1) 4的合成
在反应瓶中加入3,4-二氟苯甲醛20 g(140 mmol),盐酸羟胺12.8 g(180 mmol)和无水乙醇50 mL,搅拌使其溶解;加蒸馏水2 mL,缓慢滴加53%NaOH溶液25 mL,滴毕,于室温反应4 h。倾入冰水中析晶,过滤,滤饼干燥得白色固体1 18.5 g。
在反应瓶中加入1 18 g(110 mmol)的二氯甲烷(180 mL)溶液,搅拌下分批加入NCS 16.8 g(120 mmol),加毕,回流反应2 h(TLC检测)。自然冷却至室温,加入N-烯丙基乙酰胺11 g(110 mmol),冰水浴冷却至0 ℃,滴加三乙胺,滴毕,反应至终点(TLC检测)。用饱和食盐水洗涤,无水Na2SO4干燥,减压蒸除溶剂,残余物干燥得淡黄色固体3 12 g,收率42.9%(以1计),m.p.138.6 ℃~139.2 ℃;1H NMRδ: 1.80(s, 3H), 3.05~3.48(m, 4H), 4.71~4.77(m, 1H), 7.47~7.73(m, 3H), 8.09~8.12(t,J=5.6 Hz, 1H)。
在反应瓶中加入3 12 g(47 mmol),无水哌嗪40.6 g(470 mmol)和碳酸钾8.4 g(60 mmol),搅拌下于100 ℃~140 ℃反应5 h(TLC检测)。降至室温,加入适量二氯甲烷及蒸馏水搅拌,分液,有机层用水洗涤,无水Na2SO4干燥;减压蒸除溶剂,残余物干燥得白色固体4 14.1 g,收率93%, m.p.160.5 ℃~161.3 ℃;1H NMRδ: 1.79(s, 3H), 3.03(m, 1H), 3.10~3.19(m, 8H), 3.22(t,J=5.6 Hz, 2H), 3.40(m, 1H), 4.66~4.70(m, 1H), 7.33~7.54(m, 3H), 8.06~8.09(t,J=5.6 Hz, 1H)。
(2) 6的合成(以6a为例)
在反应瓶中加入4 2 g(6 mmol)的二氯甲烷(50 mL)溶液,搅拌下加入碳酸钾1.3 g(9 mmol),冰水浴冷却至10 ℃,缓慢滴加对甲苯磺酰氯(5a)1.18 g(6 mol)的二氯甲烷(15 mL)溶液,滴毕,于室温反应2 h~3 h(TLC检测)。用蒸馏水洗涤,无水Na2SO4干燥,减压蒸除部分溶剂后于低温放置析晶,过滤,滤饼干燥得白色固体6a。用类似的方法合成白色固体6b~6f。
6a: 收率63%,纯度99.9%(HPLC,下同),m.p.182.1 ℃~182.5 ℃;1H NMRδ: 1.79(s, 3H), 2.41(s, 3H), 3.01~3.40(m, 8H), 4.68~4.69(m, 1H), 7.03~7.66(m, 7H), 8.08(t,J=5.6 Hz, 1H); MSm/z: 475.2{[M+H]+}。
6b: 收率49%,纯度99.1%, m.p.195.1 ℃~196.7 ℃;1H NMRδ: 1.81(s, 3H), 3.01~3.40(m, 12H), 4.68(m, 1H), 7.02~8.13(m, 7H), 8.20(t,J=5.2 Hz, 1H); MSm/z: 505.2{[M+H]+}。
6c: 收率61%,纯度99.5%, m.p.155.9 ℃~156.4 ℃;1H NMRδ: 1.80(s, 3H), 3.02~3.41(m, 12H), 4.67(m, 1H), 7.05~7.99(m, 7H), 8.10(t,J=5.2 Hz,1H); MSm/z: 529.3{[M+H]+}。
6d: 收率78%,纯度99.7%, m.p.141.6 ℃~142.3 ℃;1H NMRδ: 1.80(s, 3H), 3.03~3.42(m, 12H), 4.68(m, 1H), 7.05~7.83(m, 7H), 8.08(t,J=5.2 Hz, 1H); MSm/z: 479.1{[M+H]+}。
6e: 收率56%,纯度99.2%, m.p.206.2 ℃~207.1 ℃;1H NMRδ: 1.80(s,3H), 3.02~3.12(m, 12H), 4.67(m, 1H), 6.99~7.64(m, 7H), 8.09(t,J=6.0 Hz, 1H); MSm/z: 563.2{[M+H]+}。
6f: 收率57%,纯度99.4%, m.p.175.9 ℃~176.7 ℃;1H NMRδ: 1.79(s, 3H), 3.01~3.40(m, 8H), 4.66(m, 1H), 7.07~7.54(m, 7H), 8.06(t,J=5.6 Hz, 1H); MSm/z: 506.5{[M+H]+}。
1.3 抗肿瘤活性测试
采用MTT法测试6对U2OS和HT-29的体外药效。以5-Fu为阳性对照药,6用DMSO助溶,再用无血清DMEM细胞培养基稀释到所需浓度待用。将对数生长期的肿瘤细胞以(6~10)×104个·mL-1的浓度接种于96孔板,每孔90 μL。在37 ℃, 100%相对湿度, 5%CO2和95%空气的培养箱培养24 h。每孔加10 μL药液,药液浓度为40.0 μg·mL-1, 20.0 μg·mL-1, 10.0 μg·mL-1, 5.0 μg·mL-1和2.5 μg·mL-1。各药物各浓度设6个复孔,并设空白组(不加细胞)和阴性对照组(加等浓度DMSO),药物作用24 h后加5 mg·mL-1MTT溶液10 μL/孔,置培养箱培养4 h后加100 μL DMSO/孔,置酶标仪上于492 nm测OD值,计算细胞生长抑制率{抑制率/%=[1-(OD药液-OD空白)/(OD对照-OD空白)]×100%},根据细胞生长抑制率,以直线回归方法计算IC50值。
2 结果与讨论
2.1 合成
在2的合成中,要控制好NCS分批加入的量和速度,以便控制反应液的温度。温度上升过快,易使溶剂剧烈沸腾,发生溢出。
合成3时反应的副产物较多,产率较低。本文对其工艺进行了优化,发现反应温度是最大的影响因素,并确定0 ℃和n(2) ∶n(N-烯丙基乙酰胺)=1 ∶1为最佳反应条件。
在4的合成中,无水哌嗪既是反应物料,又是溶剂,需过量加入,最佳投料比为:n(3) ∶n(无水哌嗪)=1 ∶10。
合成6时,考虑到5的活性较强,改变加料方式,采用缓慢滴加5的二氯甲烷溶液,避免了副反应的发生。后处理时保留部分溶剂使产物以结晶析出方式得到,纯度达99%以上。
2.2 抗肿瘤活性
6的抗肿瘤活性结果见表1。由表1可见,其IC50值均小于阳性对照药物5-Fu,表明6a~6f对U2OS和HT-29均有较好的抑制作用,特别是6a,6c和6e表现出较强的抑制U2OS和HT-29肿瘤细胞的活性。

表1 6的抗肿瘤活性Table 1 Anti-tumor activities of 6
[1] Barbachyn M R, Morris J, Wishka D G,etal. Substituted aminophenyl isoxazoline derivatives useful as antimicrobials[P].WO 9 941 244,1999.
[2] Cohan V L, Kleinman E F. Isoxazoline comounds as inhibitors of TNF release[P].US 6 114 367,2000.
[3] Li Q, Woods K W, Claibome A,etal. Synthesis and biological evaluation of 2-indolyloxazolines as a new class of tubulin polymerization inhibitors.Discovery of A-289099 as orally active antitumor agent[J].Bioorg Med Chem Lett,2002,12(3):465-469.
[4] Rakesh Sun D, Lee R B, Tangallapally R,etal. Synthesis,optimization and structure-activity relationships of 3,5-disubstituted isoxazolines as new anti-tuberculosis agents[J].Eur J Med Chem,2009,44(2):460-472.

