有机硅试剂在药物合成中的应用
菅美云, 杨 慧, 景云荣, 赵 岩, 周 微
(1. 内蒙古医学院 药学院,内蒙古 呼和浩特 010059; 2. 天津天士力集团研究院化学药物研究所,天津 300402; 3. 沈阳药科大学 制药工程学院,辽宁 沈阳 110016)
近年来,有机硅试剂在有机合成中的应用发展很快,越来越引起更多有机及药物化学家的重视。研究表明,含硅取代基的某种有机化合物,能起活化、定向、稳定中间体以及保护官能团等作用,现已成为有机合成中不可缺少的重要试剂。有机硅试剂在药物合成中的应用也愈来愈普遍,不仅限于在药物合成中作为一类有效的保护试剂应用,而且己成为一类有效的中间体合成试剂,广泛用于天然产物和合成药物中[1~3]。
常用的有机硅保护剂有三甲基氯硅烷(TMSCl),三甲基溴硅烷(TMSBr),三乙基氯硅烷(TESCl),三异丙基氯硅烷(TIPSCl),叔丁基二甲基氯硅烷(TBSCl或TBDMSCl),叔丁基二苯基氯硅烷( TBPSCl),六甲基二硅氮烷(HMDS)以及三氟甲基磺酸三甲基硅烷酯(TMSOTf)等。本文主要介绍了了他们作为保护剂对药物结构中含有羟基、羧基、不饱和键、氨基、羰基及其它官能团的保护及应用情况,以及在合成中间体烯醇硅醚等方面应用。
1 保护剂
1.1 保护羟基
羟基本身易被氧化、脱水、烷基化和酰化,对含羟基化合物的其他基团进行氧化、酰化、脱水化时,均须对羟基进行保护[4]。保护羟基,一般可将其制成醚、醛缩醇、酮缩醇,也可以将其转化为酯。在羟基保护的衍生物中,硅基保护最为稳定,其中三甲基硅醚(TMS)最活泼。
在抗癌药物的合成中,常用氯硅烷来保护其中的羟基[5]。例如在紫杉醇的半合成中,10-去乙酰巴卡亭Ⅲ(10-DAB)的羟基就是用有机硅保护剂进行保护的(Scheme 1)。

Scheme 1
合成前列腺素类化合物时,用TBSCl保护羟基后,用二异丁基铝还原羰基而不影响生成的硅醚,之后用正丁基氟化铵脱去保护基(Scheme 2)。
TBSCl属位阻型硅烷化试剂,其特点是形成的中间体硅醚由于空间体积较大,在弱酸弱碱介质中比较稳定,并且对氢化锂铝等还原剂稳定。在合成辛伐他汀时,用TBSCl有选择地进行保护羟基和脱去硅烷基的反应[7](Scheme 3)。
在Eupomatilones的全合成过程中,中间体(1)结构中的羟基也是用TBSCl保护的,反应结束后使用正丁基氟化铵脱去保护剂,而且保护与脱保护的产率都非常高,分别达到95%和94%[8](Scheme 4)。
Scheme2

Scheme3
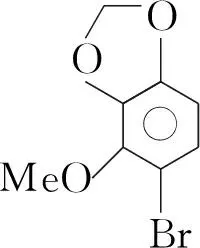

Scheme4

R=Ph or PhO-
Scheme5
Scheme6
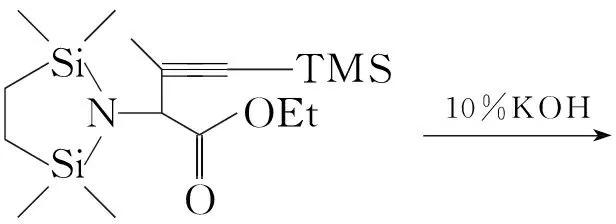
Scheme7

Scheme8
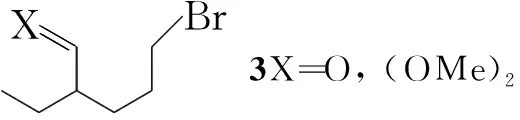
Scheme9
1.2 保护羧基
羧基存在于许多具有生物活性和合成价值的化合物中,如氨基酸、青霉素、大环内酯抗菌素的前体药物等。就其结构和性质而言,羧基没有氨基、醛基那么活泼,但在合成中也经常需要保护,以便分子其它部位进行特定反应。保护羧基的方法主要是酯化法即一般生成烷基酯加以保护,在某些情况下,也可以用形成酰胺或酰肼等方法来进行保护。但是对于一些结构中含有对水敏感基团的化合物时,其羧基的保护则要形成硅烷基酯。例如,在由青霉素V(或青霉素G)化学法去酰基生成6-氨基青霉烷酸(6-APA)过程中[9],可用TMSCl对羧基进行保护(Scheme 5)。在对各种头孢菌素的半合成过程中,以7-氨基头孢烷酸(7-ACA)为起始物对其3-位进行改造以合成各种有用的头孢中间体时,为避免7-ACA分子间的反应,需对分子中的羧基或氨基加以保护,此时用HMDS对其进行保护[10]。
1.3 保护不饱和键
末端炔烃在有机金属合成中往往需要保护,这是由于炔烃基上的氢原子有较强的酸性。此时即可运用有机硅保护剂对末端炔烃进保护。 例如,在由对位溴代苯乙炔与镁反应时,所得格氏试剂会自然重排成苯乙炔镁溴,其中芳环功能基(对位的溴)消失,反应活性部位就转移到炔的末端位置上。若先将苯乙炔镁溴与一个卤代三烷基硅烷偶合,在下一步形成格氏试剂时炔硅键将不受影响,但最后可用稀碱处理脱去[11](Scheme 6)。
1.4 保护氨基[12]
有机硅试剂作为氨基的保护剂具有对有机试剂稳定、氨硅化物的生成和除去条件温和等特点。例如,L-蛋氨酸和L-亮氨酸拮抗剂α-氨基-4-炔-戊酸(2)的合成[13](Scheme 7),是甘氨酸合成其他α-氨基酸的典型例子。李增春等[14]在合成某氨基酸时,应用TMSOTf为试剂保护氨基,该反应进行迅速完全,转化率高。保护伯氨基以形成环状二硅氨烷更稳定,其他氨基如内酰胺基也可以用有机硅试剂保护。如在β-内酰胺抗生素硫霉素的合成中,用TBS基团保护内酰胺基后,再进行氯化、取代等反应,而对内酰胺环无影响,且分子中手性碳原子的立体构型不变[15,16]。
1.5 保护羰基
在有机合成中,为避免羰基参与反应必须对其加以保护,以对抗各种试剂的进攻,诸如包括有机金属试剂在内的强的或中等强度的亲核试剂,酸性、碱性试剂、催化试剂、氢化物还原剂,以及某些氧化剂等。非环状与环状的醛缩醇和酮缩醇以及非环状的硫代醛缩醇和酮缩醇是最常用的保护剂。不过,随着有机合成科学的发展,已经出现了一些新型的官能团保护剂,有机硅保护剂便是其中之一。靳立人等[17]最近以四乙酰核搪和胸腺嘧啶为原料,经中间体5-甲基尿苷合成抗艾滋病药物司他夫定就是用HMDS来保护羰基的(Scheme 8)。由瑞士罗氏(Roche)制药公司开发的卡培他滨, 在中间体的合成过程中与司他夫定有类似步骤,用HMDS不仅保护5-氟尿嘧啶的羰基,而且结构中的氨基也得到同样的保护[18]。
除上述几种官能团外,有机硅保护剂在有机合成中还可以用于硫、磷等杂原子的保护,如对硫醇的保护等[19,20]
2 合成中间体
近年来,有机硅化合物的应用得到迅速发展。它不仅限于作为一类有效的保护试剂应用于有机合成,而且已成为一类非常效的中间体合成试剂,广泛应用于天然化合物和药物的合成中。烯醇硅醚是目前在合成中应用较广泛,而又易于制备的合成中间体的有机硅试剂[21]。由于烯醇硅醚中有C=C键存在,Si-O键强度削弱,所以烯醇硅醚以负碳离子进行亲核反应,亲电试剂E+进攻O-C键的α-位。烯醇硅醚在烷基化反应,Mannich反应,醛醇缩合反应,Diels-Alder反应中都得到广泛的应用[22,23]。
烯醇硅醚在合成反应中的行为与烯醇相当,因而能进行Mannich反应。长春胺的新合成法即应用了有烯醇硅醚参与的分子内Mannich反应。二氢-β-咔琳(5)以烯醇硅醚(4)烷基化得亚胺盐(6); 6经分子内的Mannich反应以70%收率制得长春胺合成中的关键中间体7(Scheme 9)。如直接用游离的溴代醛与5反应,收率仅10%。
除烯醇硅醚外还有其他的含硅原子的合成中间体[24],如羟基硅烷(8, Chart 1),环氧硅烷(9, Chart 1),碱代三甲基硅烷,硅取代碱,炔基硅烷等,他们都是合成中重要的中间体或试剂,参与高选择,专一的反应。

Chart1
3 催化作用
TMSCl或TMSOTf和三氟甲磺酸镱[Yb(OTf)3]联合可以催化亚烯胺。在该催化剂存在下,N-甲基乙烯胺和取代的丙烯反应得到单一的烯丙胺(10, Scheme 10)。联合催化剂已经成功适用于亚烯胺与各种各样的含有双键的醛亚胺的反应。

Scheme10
催化剂中的硅试剂不只是限于TMSCl和TMSOTf,其他的硅试剂(TESCl, TESOTf, TBDMSCl, TBDMSOTf)也有同样的催化效果[25]。另外在TMSOTf和胺基碱的催化下,各种酮、酯、酰胺、硫酯可以高产率地得到缩醛芳香化合物,不饱和直链醛类[26](Scheme 11)。
R1=Ar, OR, SR, NH2; R2=Ar, alkyl, slkenyl
Scheme11
4 结束语
有机硅试剂及其应用只是近年来发现的新试剂,新反应之一,新品种仍在不断涌现,应用范围也在日益扩大[27]。就保护活性基团而言,在一些具与生命现象相关的一些物质如在糖类、甾体、核苷、氨基酸、大环内酯抗菌素前体等的合成中将会有更加深入的研究。在药物合成中,寻求高选择性,专一性的合成中间体及试剂也将成为另一个全新的研究方向。相信随着现代社会人类对健康的关注,随着现代有机合成工业特别是现在医药工业的发展,有机硅试剂必将迎来又一个新的发展时期[28]。
[1] 孙明宇,刘少杰,毕研英,等. 硅烷化技术在制药上的应用[J].有机硅材料,2001,15(5):18-20.
[2] 邓锋杰,罗六保,龚劭刚. 有机硅保护剂及其在有机合成中的应用[J].精细化工中间体,2005,3(35):11-13.
[3] 周秀芹. 探析有机硅保护剂及其应用[J].内蒙古科技与经济,2006,15:87-88.
[4] 邱志强. 有机物官能团保护[J].科技信息(学术版),2006,(11):324-326.
[5] Chihiro Tsukano, Makoto Ebine, Makoto Sasaki. Convergent total synthesis of gymnocin-A and evaluation of synthetic analogues[J].J Am Chem Soc,2005,127(12):4326-4335.
[6] 邓锋杰,陈萍华,温远庆,等. 位阻型硅烷化试剂在药物合成中的研究与应用[J].精细化工中间体,2005,10(35):6-9.
[7] 米长虹,李丽,张震. 硅烷化试剂在药物合成中的应用[J].化学与生物工程,2009,10(26):87-88.
[8] Soumya Mitra, Srinivas Reddy Gurrala, Robert S. Cole man total synthesis of the eupomatilones[J].J Org Chem,2007,72(23):8724-8736.
[9] Parmar A, Kumar H, Marwaha S S,etal. Advances in enzymatic transformation of penicillins to 6-aminopenicillanic acid(6-APA)[J].Biotechnology Advances,2000,18:289-301.
[10] Walker D G, Brodfuehrer P R, Brudidge S P,etal. Use of bistrimet hylsilylated Intermediates in the preparation of semisyntheic 7-amino-3-substitued cephems.Expedient syntheses of a new 3-[(1-methyl-1-pyrrolidinio)mehyl]cephalosporin[J].J Org Chem,1988,53:981-991.
[11] 罗六宝. 有机硅保护剂的合成及其应用研究[D].南昌:南昌大学,2005.
[12] Michael J, Barany Robert P, Hammer R B,etal. Efficient synthesis of 1,2,4-dithiazolidine-3,5-diones[dithiasuccinoyl-amines] from bis(chlorocarbonyl)disulfane plus bis(trimethylsilyl)amines[J].J Am Chem Soc,2005,127(2):508-509.
[13] Stevan Djuric, John Venit, Philip Magnus. Silicon in synthesis:stabase adducts-a new primary amine protecting group:Alkylation of ethyl glycinate[J].Tetrahedron Letters,1981,22(19):1787-1790.
[14] 李增春,Simchen G. 2-(N-三氟乙酰-N-三甲基硅烷基)氨基-3-三甲基硅烷氧基羧酸三甲基硅烷酯和2-(N-三氟乙酰)-2,3-脱氢氨基酸的合成[J].有机化学,1992,(12):294-297.
[15] Sandor Karady, Joseph S Amato, Robert A Reamer,etal. Stereospecific conversion of penicillin to thienamycin[J].J Am Chem Soc,1981,103(22):6765-6767.
[16] Jean d'Angelo, Françoise Pecquet-Dumas. Aldolisations stereoselectives en serieβ-lactame controlle simultane detrois centres asymetriques parles enolates dezirconium[J].Tetrahedron Letters,1983,24(13):1403-1406.
[17] 靳立人,蒋洪平,侯鹏翼. 司他夫定的合成[J].厦门人学学报(自然科学版),2002,41(2):207-210.
[18] 朱仁发,陈仕云,何勇. 合成卡培他滨的新方法[J].合成化学,2008,16(1):120-122.
[19] Lalonde M, Chan T H. Use of organosilicon reagent s as protective groups in organic synthesis[J].Synthesis,1985,(9):817-845.
[20] Rücker C. The triisopropylsilyl in organic chemistry:Just a protective group or more[J].Chem Rev,1995,95(4):1009-1064.
[21] 胡圣愉. 烯醇硅醚在药物合成中的应用[J].国外药学,1986,1(7):22-26.
[22] Haruhiko Fuwa, Makoto Ebine, Makoto Sasaki. Total synthesis of the proposed structure of brevenal[J].J Am Chem Soc,2006,30(128):9648-9650.
[23] Donald Craig, Fabienne Grellepois. Decarboxylative claisen rearrangement reactions of allylic tosylmalonate esters[J].Org Lett,2005,7(3):463-465.
[24] 徐福培. 几种重要的有机硅试剂[J].化学试剂,1984,4(6):210-214.
[25] Masamichi Yamanaka, Atsushi Nishida, Masako Nakagawa. Mino ene reaction catalyzed by ytterbium(Ⅲ) triflate and TMSCl or TMSOTf[J].J Org Chem,2003,68:3112-3120.
[26] C Wade Downey, Miles W Johnson, Kathryn J Tracy. One-pot enol silane formation-mukaiyama Aldol-type addition to dimethyl acetals mediated by TMSOTf[J].J Org Chem,2008,73:3299-3302.
[27] Shuichi Oi, Akio Taira, Yoshio Honma,etal. Asymmetric 1,4-addition of organosiloxanes toα,β-unsaturated carbonyl compounds catalyzed by a chiral rhodium complex[J].Org Lett,2003,5(1):97-99.
[28] 罗六宝,曲铭海,浦家齐. 三甲基硅基作为保护基在有机反应中的应用[J].上海大学学报:自然科学版,2006,(2):157-164.

