山鸡椒植物源抑菌成分的筛选研究
殷帅文,朱 峰,刘丽萍,陈春霞,高小燕,党兵涛,何旭梅
井冈山大学生命科学学院,吉安343009
山鸡椒植物源抑菌成分的筛选研究
殷帅文*,朱 峰,刘丽萍,陈春霞,高小燕,党兵涛,何旭梅
井冈山大学生命科学学院,吉安343009
以山鸡椒为植物材料,以活性追踪的方法测定了不同组分对几种植物病原菌的抑制活性,并从中分离纯化出一种有效抗菌物质L1。实验结果表明:粗提物不同萃取相中,乙酸乙酯相的抑制作用最好,其对杨树溃疡病菌和苹果霉心病菌抑制率达到75%以上;乙酸乙酯相各个组分对几种植物病原真菌均有一定的抑制活性,其中组分6和组分7抑菌效果强,组分6对苹果霉心病菌抑制率达到100%,组分7对番茄灰霉病菌抑制率达到100%;而对抑菌活性物质L1的抑菌活性研究中,随着L1浓度逐渐升高,对几种病原菌的抑制作用也依次增强,尤其是对苹果霉心病菌的抑制效果更加明显,在供试浓度为0.1 mg/mL时,抑制率达到100%;活性成分L1最终通过波谱学方法和文献对比确定为5,8-二羟基-6,7-二甲氧基黄酮。
山鸡椒;抑菌活性;筛选
随着人们环保意识的逐渐增强以及对生活质量的要求愈来愈高,化学农药的使用所导致的社会和生态问题受到人们的日益关注。20世纪80~90年代,国内外许多专家认为,化学农药的使用将走到尽头,逐步取而代之的将是生物防治、物理防治和综合防治等[1,2]。所谓植物源农药,就是利用植物的某些部位或提取其有效成分制成具有杀虫或杀菌作用的农药。植物源农药在我国常被称为土农药,具有高效、无公害、能与环境相容、作用机理独特及开发费用低廉等特点,具有明显的生态效益、经济效益和社会效益,利用植物资源对有害生物进行防治,开发研究新农药已成为当前农药化学和农药毒理学研究的热点。当前,有关植物源农药的研究,主要集中在植物源杀虫剂方面,而植物源杀菌剂的研究相对要薄弱得多,但由于近几年农作物菌害加重,据FAO统计,每年因植物病害造成的农作物损失占总产量的10%~15%,约为700亿美元,因此有关植物源杀菌剂的研究也发展十分迅速[3-5]。前人于2005年对井冈山47种植物的丙酮提取物进行了5种病原菌抗菌活性研究,结果表明:在供试浓度为0.05 g/ mL时,山鸡椒提取物抑菌效果最好,对所有供试菌抑制率均在90%以上,其中对小麦纹枯病菌表现强烈抑制作用,抑制率为100%[6]。本研究选择这种初试具有明显抗菌活性的植物以活性追踪的方法进行进一步系统的抑菌活性研究,并从中找到具有明显抑菌活性的单体化合物L1。
1 材料与方法
1.1 材料
1.1.1 供试菌种
小麦赤霉病菌(Fusarium graminearum)番茄灰霉病菌(Botrytis cirerea)、杨树溃疡病菌(Dothiorella gregaria)、稻瘟病菌(Pyricularia grisea)、油菜菌核病菌(Sclerotinia sclerotiorum)、苹果霉心病菌(Trichoticum roseum)均由井冈山大学植物病理研究室提供。
1.1.2 样品及处理
山鸡椒(Litsea cubeba)枝条采自井冈山自然保护区。常温下阴干,粉碎备用。
1.2 实验方法
1.2.1 植物提取物的制备
将粉碎的山鸡椒用95%的乙醇分别提取3次,每次72 h后过滤,合并3次滤液,减压浓缩得粗提取物浸膏。
1.2.2 不同萃取相的制备
将上述提取物浸膏用水分散,分别用石油醚、乙酸乙酯、正丁醇进行萃取,重复三次,减压浓缩,分别得到石油醚相、乙酸乙酯相、正丁醇相和水相萃取物,分别对不同相萃取物和粗提取物进行抑菌活性测定。
1.2.3 不同极性组分的制备
将抑菌效果好的乙酸乙酯相采用硅胶层析柱进行分离。固定相采用100~200目的硅胶填充。流动相采用石油醚乙酸乙酯混合溶剂进行梯度洗脱,得到9个组分,分别对9个组分进行抑菌活性测定。将抑菌效果较好的第6组分和第7组分采用硅胶层析柱进行分离。固定相采用200~300目的硅胶填充。用氯仿∶乙酸乙酯=12∶1的洗脱液进行洗脱。分别得到A、B、C、D、E和F、G、H、I、J、K共11个组分。用小麦赤霉病菌分别对这11个组分进行抑菌活性测定。
1.2.4 晶体的制备
将上述抑菌效果好的组分C和G、H合并后采用硅胶层析柱进行分离。固定相采用200~300目的硅胶填充。用氯仿:乙酸乙酯=12∶1的洗脱液进行洗脱。最后分离得到结晶性物质(L1)。对结晶物质L1设定5个浓度,分别为0.01、0.025、0.05、0.1、0.2 mg/mL,分别进行抑菌活性测定。
1.2.5 山鸡椒提取物不同组分抑菌活性测定
山鸡椒提取物不同组分对病原菌菌丝生长的作用采用生长速率法测定[7]。在无菌的条件下,取1.2制备的样品溶液0.5 mL于灭菌的10 mL试管中,加入9.5 mL 50℃左右的PDA培养基,摇匀,倒入灭菌培养皿中制成平板,平板凝固后放入生长一致的菌饼(直径6 mm),每处理重复3次,27℃下培养4 d观察结果。同时采用溶解样品的相应溶剂作为对照。用十字交叉法测量供试真菌菌落的生长直径,用下述公式计算抑制率。
菌丝生长抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%
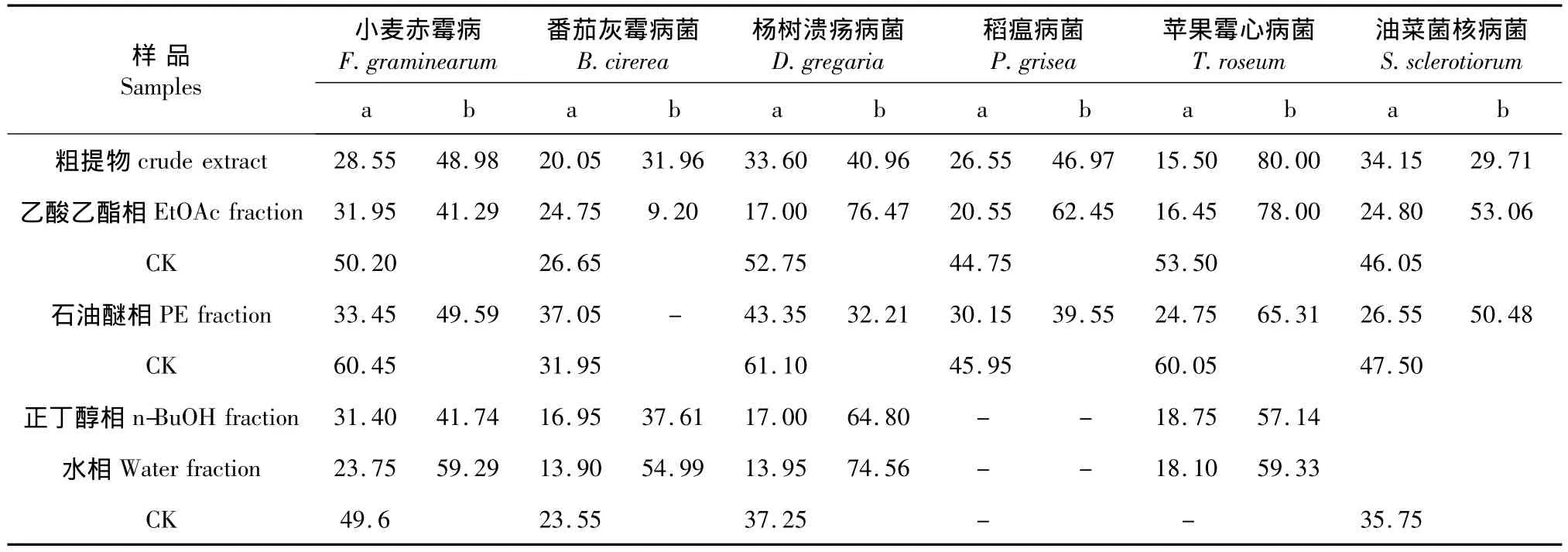
表1 山鸡椒粗提取物和不同相萃取物对6种病原菌菌丝生长的抑制作用Table 1 Inhibition rate of crude extract and different soluble fractions isolated from ethanol extracts of Litsea cubeba on hypha of 6 kinds of pathogen
2 结果与分析
2.1 粗提物和不同萃取相对6种病原菌菌丝生长的抑制作用
粗提物和不同萃取相对6种病原菌菌丝生长的抑制作用结果如表1。结果表明:在供试浓度为1 mg/mL时,不同萃取相和提取物对几种植物病原真菌均有一定的抑制活性,但是乙酸乙酯相的抑制效果最好,对杨树溃疡病菌和苹果霉心病菌抑制率达到75%以上。
2.2 乙酸乙酯相不同极性组分对6种病原菌菌丝生长的抑制作用
不同极性组分对6种病原菌菌丝生长的抑制作用结果如表2。结果表明:在供试浓度为0.5 mg/ mL时,组分6和组分7抑菌效果较明显,其中组分6对苹果霉心病菌抑制率达到100%,对小麦赤霉病菌和杨树溃疡病菌抑制率分别为 73.72%和85.18%,组分 7对番茄灰霉病菌抑制率达到100%,对小麦赤霉病菌和杨树溃疡病菌抑制率分别为68.06%和71.29%。
2.3 组分6和组分7中不同组分对小麦赤霉病原菌菌丝生长的抑制作用
组分6和组分7中不同组分对小麦赤霉病原菌菌丝生长的抑制作用结果如表3、表4。结果表明:在供试浓度为0.2 mg/mL时,组分C,组分G和组分H抑菌效果较好,对小麦赤霉病菌抑制率为分别为68.10%,70.93%和68.10%。

表2 乙酸乙酯相不同极性组分对6种病原菌菌丝生长的抑制作用Table 2 Inhibition of different fractions of ethyl acetate soluble fractions isolated from ethanol extracts on hypha of 6 kinds of pathogen fungi
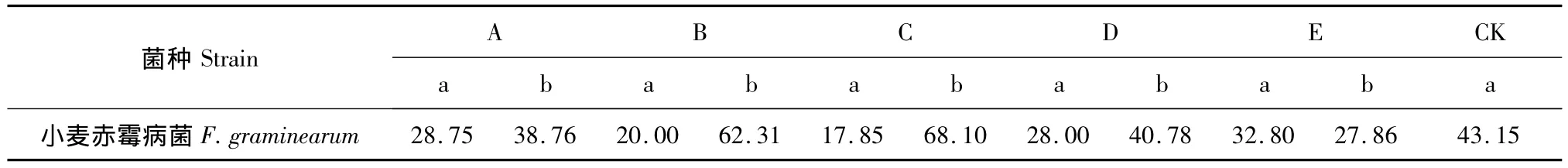
表3 组分6中不同组分对小麦赤霉病原菌菌丝生长的抑制作用Table 3 Inhibition of different fractions from the sixth on hypha of F.graminearum
2.4 不同浓度下L1对几种病原菌菌丝生长的抑制作用
不同浓度下L1对几种病原菌菌丝生长的抑制作用结果如表5、表6。结果表明:随着L1浓度逐渐升高,对小麦赤霉病菌、杨树溃疡病菌、苹果霉心病菌、油菜菌核病菌这4种病原菌的抑制作用也依次增强,尤其是对苹果霉心病菌的抑制效果更加明显,在供试浓度达到0.1 mg/mL时,抑制率达到100%。在供试浓度达到0.2 mg/mL时,除稻瘟病菌外其余5种病原菌抑制率均在50%以上。
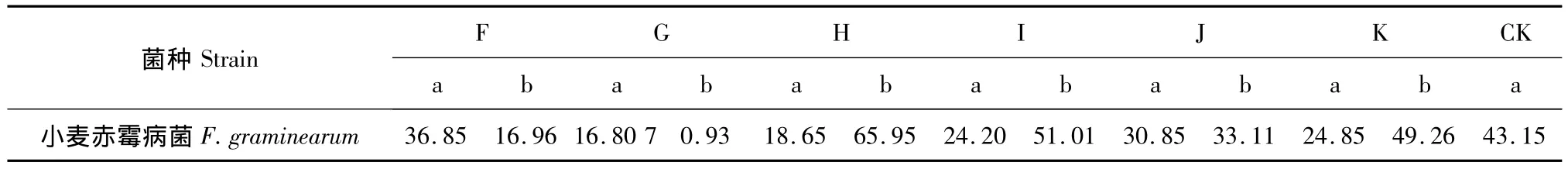
表4 组分7中不同组分对小麦赤霉病原菌菌丝生长的抑制作用Table 4 Inhibition of different fractions from the seventh on hypha of Fusarium graminearum

表5 在0.2 mg/mL浓度下L1对6种病原菌菌丝生长的抑制作用Table 5 Inhibition of the L1 on hypha of 6 kinds of pathogen fungi under the concentration of 0.2 mg/mL

表6 4种不同浓度下L1对4种病原菌菌丝生长的抑制作用Table 6 Inhibition of the L1 on hypha of 4 kinds of pathogen fungi under the four different concentrations
2.5 L1的鉴定
对获得的结晶L1进行了核磁共振及质谱等分析,同时与文献对照[2,8],确定其结构为5,8-二羟基-6,7-二甲氧基黄酮(5,8-dihydroxy-6,7-dimethoxyflavone)。其结构式如图1,波谱数据如下:ESIMS m/z (rel.int.):315[M+H]+;1H NMR(400 MHz,CDCl3):6.69(1H,s,H-3),7.94(2H,m,H-2',6'),7.56(3H,m,H-3',4',5'),4.05(3H,s,OCH3),4.03 (3H,s,OCH3),12.71(2H,s,OH);13C NMR(100 MHz,CDCl3):163.5(C-2),104.6(C-3),183.0(C-4),144.6(C-5),128.4(C-6),141.4(C-7),136.2 (C-8),148.2(C-9),106.5(C-10),130.7(C-1'),126.6(C-2',6'),129.0(C-3',5'),132.1(C-4'),60.4(OMe),61.1(OMe).
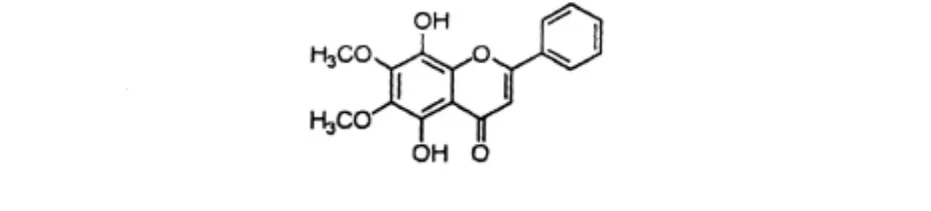
图1 L1的结构式Fig.1 Structure of compound L1
3 讨论
当前有关植物源杀菌剂的研究,主要可以分为两方面:一方面是直接研究植物中的粗提取物,此类研究过程简单,投资少,而且能够发挥粗提取物中各种成分的协同作用,但研究的深度不够。目前,我国学者在这方面做的工作较多[9,10]。另一方面是间接研究,即研究粗提取物中活性物质的结构、作用机制、结构与活性间的关系,进而人工模拟合成筛选,从中开发新型植物源农药制剂。间接研究是当前国外植物源杀菌剂研究开发的重点,也是我国植物源杀菌剂研究发展的方向。随着我国各级政府和企业对新农药研制的投入加大以及研究队伍的扩大,我国的研究重点正从植物的粗提取物研究转向更深层次的活性先导化合物的发现和优化、活性成分的构效关系、作用机制、分子毒理学、制剂加工和工艺水平上。本研究通过抗菌活性追踪,从山鸡椒中分离纯化出1种有效抗菌成分L1,在供试浓度达到0.2 mg/mL时,L1对小麦赤霉病菌,番茄灰霉病菌,杨树溃疡病菌,油菜菌核病菌,苹果霉心病菌5种植物病源真菌具有超过50%的抑制率,特别是对苹果霉心病菌的抑制在供试浓度为0.1 mg/mL时抑制率达到100%,L1可进一步开发为苹果霉心病菌的专一性植物源杀菌剂。
江西省地处亚热带,是近代植物区系的起源中心之一,植物系统演化中各个阶段的代表植物江西均有分布,同时,独特的环境条件能使生物产生大量结构复杂、新颖、生理活性特异的代谢产物。江西省植物资源丰富,因此,从江西省植物资源中寻找植物源杀菌剂的先导化合物颇具潜力。然而,根据我们的文献资料,除我们研究小组于2005年对井冈山47种植物的丙酮提取物进行了5种病原菌抗菌活性研究外[6],尚未见其他有关江西省植物杀菌剂活性成分的研究报道。因此,我们的对山鸡椒抑菌活性的成分研究具有重要的理论意义。在此先导化合物基础上,配合适当的结构修饰、优化改造以及系统的结构-活性关系研究,可以进一步研制具有自主知识产权的、高效、低毒的植物源杀菌剂新药。而且山鸡椒在我国大部分地区均有分布,其中江西分布广泛,其中井冈山和庐山分布较多。实验结果进一步为江西省丰富的植物资源的开发利用提供科学依据。
1 Heinrichs EA,Mochida O.From secondary to major pest status:The case of insecticide-induced rice planthopper Nilaparvata lugens,resurgence.Prot Ecol,1984,7:201-208.
2 Horie T,Kawamura Y,Yamamoto H,et al.Syntheses of 5,8-dihydroxy-6,7-dimethoxyflavones and revised structructures for some natural flavones.Phytochemistry,1995,39:1201-1210.
3 Abdelgaleil SA,Hashinaga F,Nakatani M.Antifungal activity of limonoids from Khaya ivorensis.Pest Manag Sci,2005,61: 186-190.
4 Fico G,Panizzi L,Flamini G,et al.Biological screening of Nigella damascena for antimicrobial and molluscicidal activities.Phytother Res,2004,18:468-470.
5 Kordali S,Kotan R,Mavi A,et al.Determination of the chemical composition and antioxidant activity of the essential oil of Artemisia dracunculus and of the antifungal and antibacterial activities of Turkish Artemisia absinthium,A.dracunculus,A.santonicum,and A.spicigera essential oils.J Agric Food Chem,2005,53:9452-9458.
6Zhang YL(张应烙),Yin CP(尹彩萍),Lai WM(赖伟明),et al.Antifungal activity of forty common plant extracts from Jinggangshan region against plant fungi.Jiangsu Agric Sci (江苏农业科学),2005,4:51-53.
7 Yin SW(殷帅文),Wang QX(王庆先),Nie S(聂森),et al.Antifungal activity of twenty common plant extracts against two plant fungi.Nat Prod Res Dev(天然产物研究与开发),2009,21:306-311.
8 Rossi MH,Yoshida M,Mais JGS.Neolignans,styrylpyrones and flavonoids from an Aniba species.Phytochemistry,1997,45:1263-1269.
9Li WY(李文英),Liu XQ(刘贤谦),Dai JQ(戴建青),et al.Preliminary studies on fungistasis of extracts from Tagetes patula.Pesticides(农药),2002,41(10):41-42.
10 Cao HQ(操海群),Yue YD(岳永德),Peng ZH(彭镇华),et al.Antifiingal activities of extracts from bamboo.Acta Phytophyl Sin(植物保护学报),2003,30:35-39.
Screening Antifungal Component from Litsea cubeba
YIN Shuai-wen*,ZHU Feng,LIU Li-ping,CHEN Chun-xia,GAO Xiao-yan,DANG Bing-tao,HE Xu-mei
School of life sciences,Jinggangshan University,Ji'an 343009,China
The bioactivity-guided screening of different fractions of Litsea cubeba extract was tested with several kings of fungi which result in an antifungal compound L1.The results showed all fractions exhibited inhibitory action on tested different fungi,and the ethyl acetate soluble fractions showed more significant inhibition than other soluble fractions isolated from ethanol extracts to Dothiorella gregaria and Trichoticum roseum.Fractions 6 and 7 of ethyl acetate soluble fractions isolated from ethanol extracts showed stronger antifungal bioactivity than others.The inhibiting effect on tested fungi was enhancing as the concentration of compound L1 rising.And L1 showed 100%inhibition ratio to Trichoticum roseum at the concentration of 0.1 mg/mL.The structures of L1 was identified as 5,8-dihydroxy-6,7-dimethoxyflavone on the basis of extensive spectral analysis and comparison with the literature.
Litsea cubeba;antifungal activity;screening
1001-6880(2011)04-0734-05
2010-02-24 接受日期:2010-06-12
江西省自然科学基金(2007GQN1687),江西省教育厅项目(赣教技字[2007]327号)
*通讯作者 E-mail:shwyin@jgsu.edu.cn
Q946.33
A

