槲皮素在介孔分子筛孔道中的组装与缓释研究
李 华,高天宇,卢 婧,吴 辉,王文蜀
中央民族大学生命与环境科学学院,北京100081
槲皮素在介孔分子筛孔道中的组装与缓释研究
李 华*,高天宇,卢 婧,吴 辉,王文蜀
中央民族大学生命与环境科学学院,北京100081
采用后组装法将非水溶性的治疗冠心病药物槲皮素组装进入MCM-41介孔分子筛的孔道中,药物组装率达37%[m(药物)/m(药物总量)],用XRD,扫描电镜和IR对药物组装体进行了表征;通过测定组装体在体外模拟人工小肠液中的溶出速率,表明制得了槲皮素/MCM-41缓释体系。
MCM-41;槲皮素;组装;缓释
2001年,西班牙Vallet-Regi M等率先报道了以分子筛作药物缓释载体的研究[1],不久,有几个研究小组相继报道了以分子筛作为药物载体、基因转换器、药物缓释器[2]等方面的研究成果。本研究中所用介孔分子筛为MCM-41,其机械性能稳定,热稳定性较高,无药理活性和毒性,可用于食品行业,并且具备作为药物载体的基本条件,但尚未见到将MCM-41分子筛与天然产物槲皮素进行组装的研究。槲皮素(Fig.1)是临床上具有较高疗效的治疗出血性疾病、循环障碍、动脉粥样硬化等的天然药物,而常规的加压机械混合通常难以使药物均匀分散在载体基质上,直接影响到样品的溶出速率。MCM-41分子筛具有高比表面积(800~1000 m2/g)和大吸附容量(0.7 mL/g),表面的硅羟基作为活性位点,可与有机客体分子结合,使其均匀分散在介孔分子的孔道内,从而克服传统方法的弊端。本研究中将槲皮素组装进MCM-41孔道中,应用多种方法对组装体进行表征,并研究组装体在体外人工模拟肠液中的溶出速率。结果表明,我们得到了槲皮素/ MCM-41缓释体系,开辟了介孔分子筛作为非水溶性药物缓释载体的新应用,延长了药物作用时间,一定程度上解决了槲皮素在人体内吸收困难的问题,从而达到更好的治疗效果。

图1 槲皮素结构Fig.1 Structure of quercetin
1 实验部分
1.1 试剂与仪器
十六烷基三甲基溴化铵(CTAB分析纯,上海惠世生化试剂有限公司),水玻璃(SiO2:253.8 g L-1,Na2O:77.8 g L-1,d=1.33 g·mL-1,湖南长岭催化剂厂),硫酸(H2SO4,化学纯,北京化工厂),无水乙醇(分析纯,北京化工厂),氢氧化钠(分析纯,北京化工厂),槲皮素(国药集团化学试剂有限公司)。
F-4500型红外光谱仪,V-550型紫外分光光度计,Siemens D5005型X-射线衍射仪,Cu-Kα(λ= 0.15418 nm),管电压40 kV,管电流30 mA,扫描速度0.3°/min。
1.2 MCM-41的合成[3]
将2.4 g十六烷基三甲基溴化铵加入20 mL H2O中,温热使其溶解,在搅拌情况下慢慢加入4 g水玻璃,搅拌均匀后再滴加10%硫酸使反应体系pH=10,继续搅拌30 min,然后将该凝胶放入反应釜中,于100℃恒温静止晶化3 d。将所得产物洗涤、抽滤、自然干燥。采用煅烧法,将合成所得MCM-41在马弗炉中煅烧,升温至550℃(每10 min升温15℃),并在550℃下保持5 h,自然冷却至室温。
1.3 槲皮素在MCM-41中的组装
1.3.1 槲皮素乙醇溶液标准曲线的建立
以乙醇为溶剂,配制槲皮素标准溶液,浓度分别为5.94,11.88,15.83,23.76,30.08 μg/mL。以无水乙醇为参比,紫外扫描范围100~300 nm,在258.0 nm处有最大吸收。标准曲线方程:Abs=0.0697*Conc,线性范围为5.94~30.08 μg/mL。
1.3.2 最大载药量浓度的确定
将0.1 g MCM-41分别置于浓度为11.88、15.83、19.00、24.06、30.08 μg/mL的10 mL槲皮素乙醇溶液中,磁力搅拌4 h,过滤,测滤液体积,取适量滤液用紫外法测定药物的残留量,用差减法计算出组装体中槲皮素的含量。
1.3.3 最大载药量时间的确定
将0.1 g MCM-41分别置于10 mL 15.83 μg/ mL的槲皮素乙醇溶液中,搅拌1、2、3、4、5 h,过滤,测滤液体积,取适量滤液用紫外法测定药物的残留量,用差减法计算出组装体中槲皮素的含量。
1.4 组装体中槲皮素溶速率的确定
1.4.1 槲皮素模拟肠液溶液标准曲线的测定
用NaOH、无水乙醇及蒸馏水配制pH为7.8的模拟肠液(加入乙醇的量为模拟肠液总量的4%(V∶V)),称量槲皮素药品0.03 g,以模拟肠液为溶剂,计算并配制一组浓度分别为9,14,19,24,29 μg/mL的标准溶液,紫外扫描范围100~300 nm,在波长为206.0 nm处有最大吸收,标准曲线方程A=0.118 +0.0198*C,r=0.9927,线性范围9~29 μg/mL。
1.4.2 溶出率的确定
将0.1 g槲皮素/MCM-41组装体用3 MPa压片,于室温下放入模拟肠液进行缓释,定时吸取释放液,每次吸取释放液后及时补充等量的模拟人工肠液,测定紫外光谱。
2 结果与讨论
2.1 X射线粉末衍射(XRD)
将已合成的MCM-41样品进行XRD表征,得到如Fig.2的MCM-41 XRD衍射谱图,可以观察到明显的(100),(110)和(200)衍射峰,说明其结构有序性很高,具有规则的孔道结构。

图2 MCM-41样本XRD扫描图Fig.2 XRD pattern of MCM-41
2.2 扫描电子显微镜(SEM)
Fig.3a和Fig.3b分别是煅烧去除模板剂的介孔分子筛MCM-41和组装药物分子后的MCM-41的扫描电镜照片。可以观察到所合成的MCM-41为球形形貌,其粒径大约分布在200~300 nm范围内。从图3b中我们可以看出MCM-41组装药物分子后的样品仍然保持良好的形貌。这是由于MCM-41具有良好的水热稳定性,在经过加热、回流、搅拌后仍能保持形貌的完整。

2.3 药物分子组装量的测定
Fig.4是槲皮素乙醇溶液浓度与组装量的关系曲线。当MCM-41的质量为0.1 g时,在一定范围内,槲皮素的组装量随着槲皮素乙醇溶液药物总量(溶液体积相同)的增大而增加,当槲皮素乙醇溶液中药物总量达到150.68 μg(此时浓度为23.76 μg/ mL)时,槲皮素的组装量基本保持不变。因此,23.76 μg/mL为最佳组装浓度。
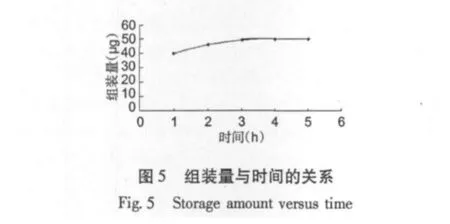
如Fig.5所示,在一定的时间范围内,槲皮素的组装量随时间的增加而增加,在3 h左右组装量达到最大,基本保持不变。因此,3 h为最佳组装时间。
用0.1031 gMCM-41和5 mL浓度为23.76 μg/ mL的槲皮素乙醇标准溶液磁力搅拌3 h,组装后过滤,用液体紫外法测得滤液的吸光度A=0.5430,将其带入标准曲线方程,并用差减法求得组装进MCM-41的槲皮素质量为 44.016 μg,组装率为37%。将MCM-41与槲皮素组装起来,利用载体的包蔽作用,延缓药物被氧化,增加药物稳定性,同时使药物得以缓慢释放。

2.4 红外表征
组装体系(Fig.6a)及槲皮素药物分子(Fig.6b)红外光谱谱图对比[4]。槲皮素的羟基、羰基和C-OC键的伸缩振动峰分别出现在3291.07、1612.62 cm-1和1094.20 cm-1处,在载药后的组装体系中,三个峰值均有体现,其中羟基的峰位发生蓝移,这一蓝移现象是由于药物分子的羟基和介孔分子筛孔壁的硅羟基间发生氢键作用的结果[5]。以上的红外光谱分析说明药物分子已经负载到介孔分子筛上。
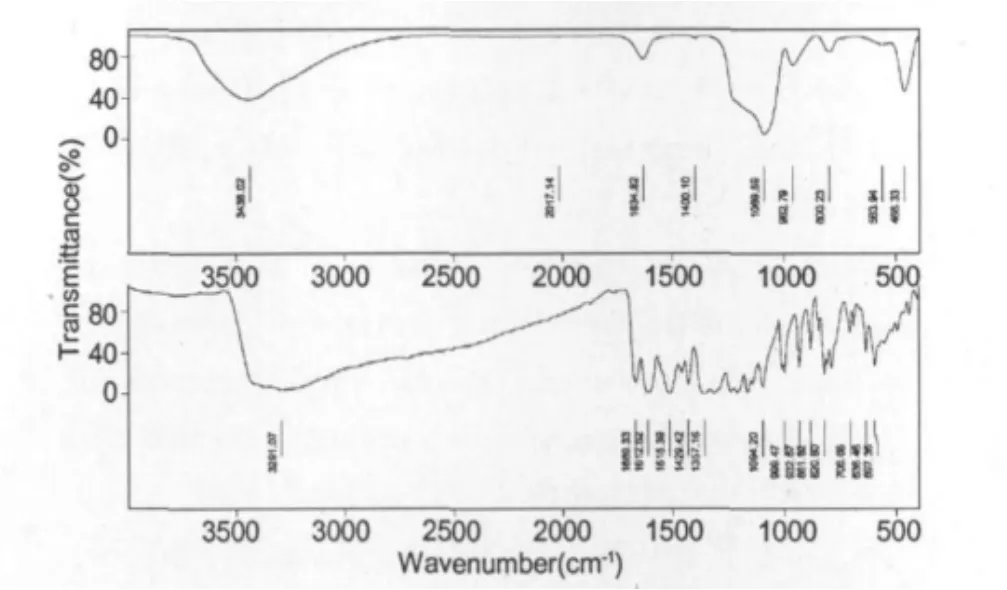
图6 槲皮素/MCM-41组装体系(a)和槲皮素药物分子(b)Fig.6 IR of the quercetin-MCM-41(a)and quercetin(b)
2.5 槲皮素的组装与缓释
Fig.7为槲皮素药物分子溶出率随时间的变化曲线。在一定的时间范围内,组装体的溶出率随时间的增加而增加,到达一定时间后保持不变,说明缓释趋近完毕。
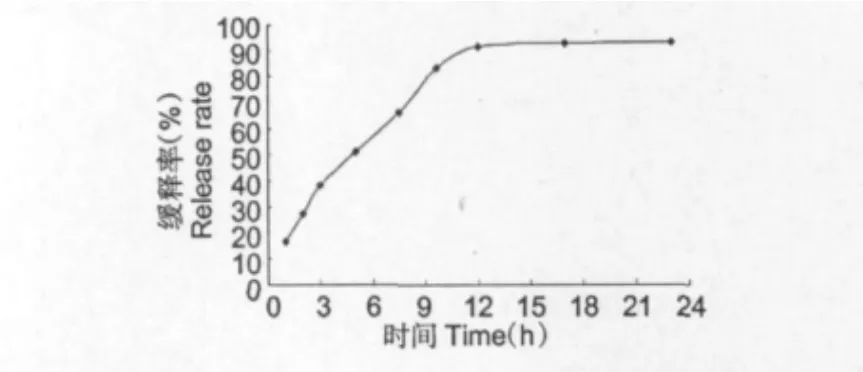
图7 槲皮素药物分子溶出率随时间变化Fig.7 Release ratio of quercetin
缓释初期由于组装体中槲皮素浓度比外界大,缓释速度快,溶出率随时间逐渐增大;随组装体中槲皮素浓度和外界浓度差逐渐减小,缓释速度减小,溶出率基本稳定,缓释完毕。
槲皮素不溶于水,不易于吸收,阻碍了其药理作用的发挥。而在模拟肠液碱性溶液中,槲皮素/ MCM-41组装体释放速度缓慢,释放体系在2 h总共只有27.35%的药物释放出,在9 h内可以释放出87.256%的药物,12 h后基本不再释放。溶出速率减慢,可以有效减少服药的次数,降低副作用,促进药物的充分吸收,提高药物利用率。
致谢:感谢中央民族大学111创新引智计划和985工程的资助;感谢周珊珊、惠岑怿、张琳霞老师和蓝晓聪同学为本论文的仪器表征及合成方面提供的重要帮助。
1 Vallet-Regi M,Ramila A,DelReal RP,et al.A new property of MCM-41:Drug delivery system.Chem Mater,2001,13: 308-311.
2 Cheng YL,Brian Trewyn G,Dusan M,et al.A mesoporous silica nanosphere-based carrier system with chemically removable CdS nanoparticle caps for stimuli-responsive controlled release of neurotransmitters and drug molecules.Chem Soc,2003,125:4451-4459.
3Qu FY(曲凤玉),Zhu GS(朱广山),Huang SY(黄世英). The research of the new system about water-soluble drug Captopril/Si-MCM-41 containing and releasing.Chem J Chin Univ(高等学校化学学报),2004,3(12):25-27.
4 Wang YF(王艳芳),Wang XH(王新华),Zhu YT(朱宇同).Progress in pharmacological studies on quercetin natural products’research and development.Nat Prod Res Dev(天然产物研究与开发),2003,15:12-15.
5 Qu FY(曲凤玉).The study of drug molecules in mesoporous moculecular sieve in the assembly,self-assembly and slow/controlled release.Changchun:Ji Lin University(吉林大学),PhD.2006.
Assembling and Sustained-release of Quercetin Encapsulated in Mesoporous Molecular Sieve
LI Hua*,GAO Tian-yu,LU Jing,WU Hui,WANG Wen-shu
Life and Environment Science College,Minzu University of China,beijing 100081,China
Using ethanol solution method to assemble non-water-soluble drug for coronary heart disease quercetin into the pores of MCM-41,drug-assembling rate reached 37%[m(drug)/m(total drug)].The characterization of quercetin-MCM-41 was analyzed by XRD,SEM and IR techniques,and the release rate of the assemblies was measured in the artificial intestinal fluid.The results indicated that quercetin/MCM-41 sustained-release system was established.
MCM-41;quercetin;assembing;sustained-release
1001-6880(2011)05-0909-04
2010-04-30 接受日期:2010-11-09
中央民族大学高等学校111学科创新引智计划(B08044);中央民族大学985工程(CUN985-03-03)
*通讯作者 E-mail:lihuamuc@gmail.com
O614
A

