紫叶李树叶中山奈酚的提取工艺研究
吴 波,张维农,严建芳,张寒俊
1武汉工业学院分析测试中心;2武汉工业学院食品科学与工程学院;3武汉工业学院化学与环境工程学院,武汉430023
紫叶李树叶中山奈酚的提取工艺研究
吴 波1*,张维农2,严建芳3,张寒俊1
1武汉工业学院分析测试中心;2武汉工业学院食品科学与工程学院;3武汉工业学院化学与环境工程学院,武汉430023
该文测定了紫叶李树叶中各黄酮苷元的含量,并对其中山奈酚的提取工艺进行了研究,重点探讨了采用乙醇法提取紫叶李树叶中山奈酚的最佳工艺条件,试验结果表明:紫叶李树叶中各黄酮苷元主要是槲皮素和山奈酚,乙醇提取紫叶李树叶中山奈酚的最佳工艺参数为浸提剂乙醇浓度为70%﹑浸提温度为50℃、料液比为1∶15、浸取时间为1.5 h。紫叶李树叶中山奈酚的浸取率为92.7%,经浸取、浓缩、水解、萃取、结晶工艺后,其紫叶李树叶中山奈酚的总得率为56.6%,山奈酚的纯度为90.6%。
紫叶李树叶;山奈酚;提取工艺
山奈酚(又名黄芪苷元,山奈黄素,Kaempferol)的结构为5,7,4'-三羟基黄酮醇,近年来,对其抗肿瘤、抗炎、抗氧化及抗菌等作用研究的比较多,它可逆转肿瘤细胞多药耐药性,保护神经细胞等研究中表现出显著的活性[1-5]。蔷薇科(Rosaceae)植物紫叶李(Prunus cerasifera)又叫红叶李,是多年生落叶小乔木。原种产于亚洲西南部,较耐湿,有一定耐寒力,以叶色闻名,在整个生长期满树红叶,尤其春秋两季叶色更艳,现在我国广泛种植,资源丰富[6]。其树叶,经检测,紫叶李树叶中含较丰富的黄酮类物质,其中以山奈酚较为突出[7]。传统的山奈酚制备一般采用醇提法、超声波法、逆流色谱法等从姜科植物山奈(kaempferia galangal L.)的根茎、百蕊草(Thesium chinense Turcz.)的全草、槐树(Sophora japonica L.)的果实、高良姜(Alpinia officinarum Hance)的根茎提取,山奈酚也是银杏与沙棘等植物有效部位中主要的黄酮苷元之一[8,9]。笔者首次以紫叶李树叶为原料,采用醇提法提取山奈酚,对提取工艺、相关影响因素等进行了一番探讨,为其今后合理的开发提供科学依据。
1 材料与方法
1.1 仪器与材料
电热恒温水浴锅:上海博讯实业有限公司医药设备厂;HS80A恒温振床:中科院武汉科学仪器厂; RE52CS旋转蒸发器:上海亚荣生化仪器厂;SHZ-III型循环水真空泵:上海亚荣生化仪器厂;GZX-9140ME数显鼓风干燥箱:上海迅达实业有限公司医疗设备厂;JB90-D型强力电动搅拌机:上海标本模型厂;VARIAN ProStar 210泵;7725I型手动进样器;VARIAN363荧光检测器;Waters柱后衍生系统。
槲皮素(Quercetin)(含量≥98%国药集团化学试剂有限公司),桑色素(Morin hydtate)(含量≥98%购于Fluka),山奈酚(Kaempferol)(含量≥98%上海友思);无水乙醇(分析纯);水(自制双重蒸馏水);其它试剂为分析纯。紫叶李树叶采于武汉工业学院,3月和4月采叶,在60℃烘干、粉碎,10℃下储存备用。
1.2 试验方法
1.2.1 紫叶李树叶及提取步骤中黄酮苷元的测定
1.2.1.1 紫叶李树叶中黄酮苷元的测定:称取粉碎的树叶约5 g于250 mL碘量瓶,准确加入70%乙醇100 mL,50℃振荡浸取两个小时后,补足70%乙醇,摇匀。取5.00 mL浸取液,加入1 mL浓HCl(含0.2 g苯酚/mL)通N2、封口,在80℃下水解两小时后,用无水乙醇用定容于10 mL,然后离心(10000 r/ min,40 s),待测。
1.2.1.2 提取步骤中黄酮苷元的测定:准确移取各工序中的浸取液5.00 mL,按1.2.1.1加1 mL浓HCl、封口、水解、定容、离心、待测。以上样液中黄酮苷元的HPLC测定方法及条件见文献[7]。紫叶李树叶中黄酮苷元的含量按下列公式计算:

式中:Y为黄酮苷元按线性回归方程计算的进样液的浓度(g/ml);w紫叶李树叶的称样量(g)提取率(%)=提取黄酮苷元的绝对量/(原料中相应黄酮苷元的含量×称样量)×100%
1.2.2 紫叶李树叶提取山奈酚最佳工艺正交优化试验设计
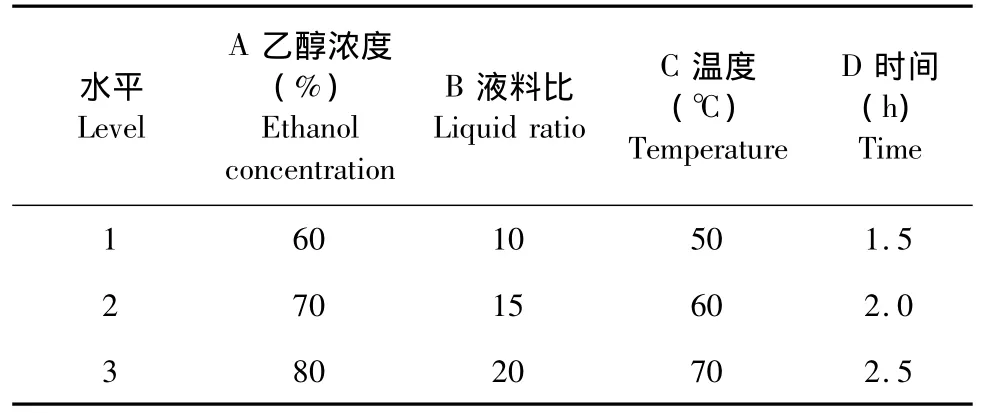
表1 L9(34)正交试验因素水平设计表Table 1 Design of L9(34)orthogonal test
1.2.3 试样溶液的制备
称取100 g的粉碎的紫叶李树叶,按15∶1的液料比加70%乙醇,在50℃水浴下搅拌1.5 h,过滤,滤饼用适量的70%乙醇冲洗,合并滤液,将其减压浓缩后,加浓HCl,调节HCl浓度为2 mol/L,添加还原剂(0.5%w/v),抽真空、通N2、封口,在80℃下水解2 h,冷却后用200 mL乙醚萃取(三次),将乙醚萃取液减压浓缩后用无水乙醇溶解,过滤,结晶得山奈酚产品,按原色谱条件测其相应峰的面积,由标准曲线计算其含量,其谱图见图1。

图1 样品的高效液相色谱图(1.槲皮素;2.山奈粉)Fig.1 HPLC chromatogram of sample(1.Quercetin;2. Kaempferol)
2 结果与分析
2.1 紫叶李树叶中各黄酮苷元的测定结果
按照“1.2.1.1”的方法测定紫叶李树叶中槲皮素和山奈酚的平均含量分别为1.02%和3.21%,山奈酚占其总黄酮苷元为75.8%。本结果以紫叶李树叶中山奈酚实际的“真实”含量,作为以下计算提取效果的依据。
2.2 提取剂及提取方式的选择
分别用碱性水溶液(pH=9.00)、70%乙醇、70%甲醇、70%丙酮溶液按“1.2.1.1”的方法分别提取、测定,其山奈酚的提取率分别为65.2%、92. 1%、91.4%和90.8%,从试验结果可以看出,碱性水溶液提取率较低,故弃之,乙醇、甲醇、丙酮其提取率差不多,从生产安全因素考虑,采用70%乙醇较适宜,所以以下研究均以乙醇为溶剂。
在提取方式上,目前采用超声波、微波的比较多,而超声波其作用面和深度是有限的,而微波其反应罐体积不大,这两种方式并不适合于大规模生产制备,在本试验中选择搅拌结合控温的方式进行。
2.3 乙醇浓度对浸取效果的影响
分别用不同的乙醇浓度(40%、50%、60%、70%、80%和90%),按上述试验操作步骤,在50℃下,搅拌回流提取时间为2 h,液料比为15∶1,提取,按“1.2.1.2”步骤进行测定,试验结果见图2。从图2可以看出,当乙醇浓度大于70%以后,其提取率大幅下降,这可能与其所连结的糖苷键有关。考虑到后面的过滤工序及提取剂极性增大会给后序的纯化带来不利,因此乙醇浓度≤70%为好。

图2 乙醇浓度对紫叶李树叶中山奈酚浸提效果的影响Fig.2 Effect of ethanol concentration on the extraction efficiency of kaempferol from P.cerasifera leaves
2.4 温度对浸提效果的影响
分别用不同的温度(30、40、50、60、70℃和80℃),按上述试验操作步骤,以70%乙醇为提取剂,搅拌回流提取时间为2 h,液料比为15∶1,提取,按1.2.1.2步骤进行测定,试验结果见图3,图中可以看出,提取温度在50℃为宜,温度太高可能导致山奈酚的氧化。

图3 温度对紫叶李树叶中山奈酚浸提效果的影响Fig.3 Effect of extracting temperature on the extraction efficiency of kaempferol from P.cerasifera leaves
2.5 液料比对浸提效果的影响
分别用不同的液料比(5∶1、10∶1、15∶1、20∶1、25∶1和30∶1),按上述试验操作步骤,以70%乙醇为提取剂,在50℃下,搅拌回流提取时间为2 h,提取,按1.2.1.2步骤进行测定,测定结果见图4。从图中可以看出液料比为15∶1时,浸提已达到较好的效果,再增加溶剂的量对提取率影响不大,故以液料比为15∶1时较好。
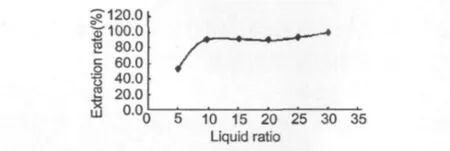
图4 液料比对紫叶李树叶中山奈酚浸提效果的影响Fig.4 Effect of the ratio of material weight to solvent volume(w/v)on the extraction efficiency of kaempferol from P.cerasifera leaves
2.6 浸提时间对浸提效果的影响
分别用不同的浸提时间(1、1.5、2、2.5、3、3.5 h),按上述试验操作步骤,以70%乙醇浓度为提取剂,在50℃下,液料比为15∶1时,提取,按1.2.1.2步骤进行测定,测定结果见图5.从图中可以看出浸取时间在1.5 h就可以达到比较好的效果。

图5 浸提时间对紫叶李树叶中山奈酚浸提效果的影响Fig.5 Effect of extracting time on the extraction efficiency of kaempferol from P.cerasifera leaves
2.7 正交试验确定提取的最佳条件
在单因素试验的基础上,选取对山奈酚得率影响较大的4个因素(每个因素取三个水平):溶剂乙醇浓度(%)、液料比、温度(℃)、浸提时间(h)进行正交试验考察,见表1。正交试验方案及结果见表2。从表2试验结果可以看出:极差分析为C>A>D>B,提取紫叶李树叶中山奈酚的最佳条件为A2B2C1D1,即乙醇浓度为70% ,料液比为1∶15,温度为50℃ ,浸提时间为1.5 h。经验证性试验结果表明:山奈酚提取率可达92.7%。
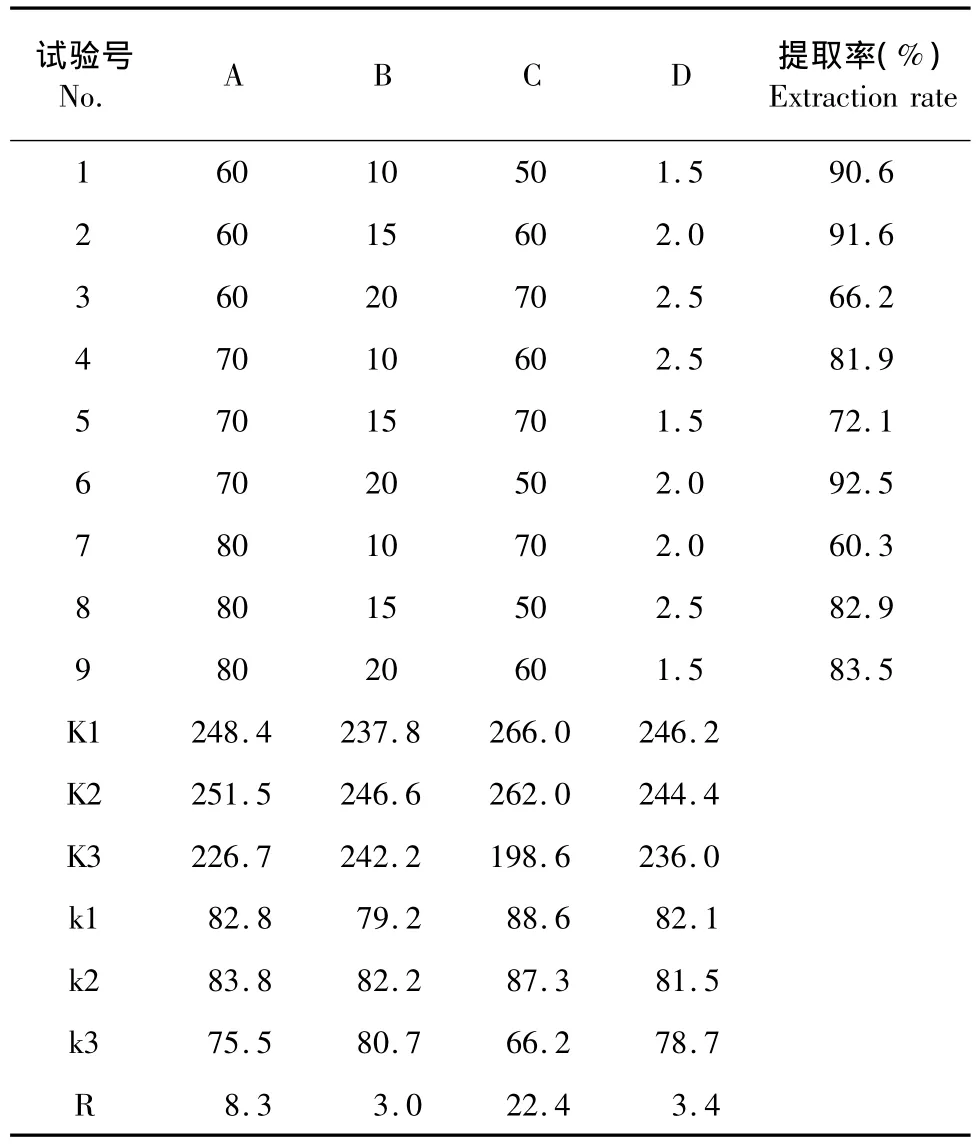
表2 Lg(3)正交试验设计方案及结果Table 2 Design and results of orthogonal experiment(n=3)
2.8 浸出物的水解
紫叶李树叶的浸出物,其黄酮主要以其苷的形态存在[7],需经水解变成苷元,目前,水解方式一般有酶解和酸水解两种。β-糖苷酶水解时,其反应条件温和,对黄酮的形态影响不大,但反应中转化率不高,易形成多种产物。酸水解,主要以2 mol/L的氢质子的盐酸、硫酸在一定温度下进行[10,11],反应中要注意对黄酮的保护,黄酮在反应中可完全转化成苷元。本试验采用2 mol/L的盐酸,在80℃下水解,通过添加还原剂(0.5%w/v)、抽真空、通N2、封口来保护黄酮,经检测,山奈酚在水解过程中其提取率可达90%以上。
2.9 在最佳条件下提取紫叶李树叶中山奈酚的重现性
按步骤“1.2.3”进行样品的制备,结果见表3,从表中可以看出最终产品中山奈酚的平均含量为90.6%,其平均得率为56.6%。
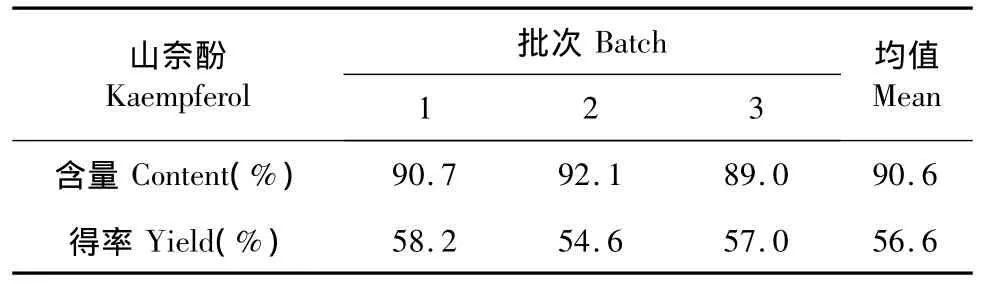
表3 从紫叶李树叶中提取山奈酚试验结果Table 3 Results of kaempferol experiment from Prunus cerasifera leaves(n=3)
3 结论
本文对紫叶李树叶中各黄酮苷元含量进行了测定,重点探讨了采用乙醇提取法提取紫叶李树叶中山奈酚化合物的最佳工艺条件。试验结果表明:紫叶李树叶中槲皮素、山奈酚的含量分别为1.02%、3.21%;乙醇提取法的最适工艺参数是浸提剂乙醇浓度为70%、浸提温度为50℃、液料比15∶1、浸提时间为1.5 h,山奈酚提取率可达92.7%,经浸取、浓缩、水解、萃取、结晶工艺后,其紫叶李树叶中山奈酚的总得率为56.6%,山奈酚的纯度为90.6%,本项研究为紫叶李树叶中黄酮的开发利用提供了科学依据。
1Mu JJ(慕静静),Zeng YY(曾耀英),Huang XY(黄秀艳), et al.Efects of kaempferol on activation,proliferation and cell cycle of mouse T lym phocytes in vitro.Chin J Cell Mol Immunol(细胞与分子免疫学杂志),2009,25:1106-1108.
2Lin XC(林小聪),Liu XG(刘新光),Chen XW(陈小文),et al.Inhibitory effect of kaempferol on protein kinase CK2 in vitro and in HL260 cells.Chin J Biochem Mol Biol(中国生物化学与分子生物学报),2006.22:894-901.
3 Seitz C,Eder C,Deiml B,et al.Cloning,functional identification and sequence analysis of flavonoid 3¢-hydroxylase and flavonoid 3¢,5¢-hydroxylase cDNAs reveals independent evolution of flavonoid 3¢,5¢-hydroxylase in the Asteraceae family Christian.Plant Mol Biol,2006,61:365-381.
4 Ghosh A,Kanti Das B,Roy A,et al.Antibacterial activity of some medicinal plant extracts.J Nat Med,2008,62:259-262.
5 Kemertelidze E,Shalashvili K,Korsantiya B,et al.Therapeutic effect of phenolic compounds isolated from Rhododendron ungernii leaves.Pharm Chem J,2007,41:10-13.
6 Jiang WB(姜卫兵),Zhuang M(庄猛),Shen ZJ(沈志军),et al.Study on the photosynthetic characteristics of red-leaf peach and purple-leaf plum in different sea sons.Acta Horticul Sin(园艺学报),2006,33:577-582.
7 Wu B(吴波),Du SL(杜胜蓝),Lin WJ(刘文杰).Determination of flavonoids in tree leaves by HPLC with fluorescence detector.Anal Instrum(分析仪器),2009,4:41-43.
8 Yang XW(杨秀伟).Traditional Chinese Medicine Composition Supersession Analysis(中药成分代谢分析).Beijing: Scientific and Technological Publishing House of Chinese Medicin,2003.566-568.
9 Gutzeit1 D,Wray V,Winterhalter P.et al.Preparative isolation and purification of flavonoids and protocatechuic acid from sea buckthorn juice concentrate(Hippophae rhamnoides L.ssp.rhamnoides)by high-speed counter-current chromatography.Chrogatographia,2007,65:1-7.
10 Lai YH(赖宇红),Tong HZ(童惠贞),Xian YF(冼彦芳),et al.Flavonoids hydrolysis conditions in EGb quantification. J China Pharm Univ(中国医科大学学报),2007,38:569-571.
11 Wu Y(伍毅),Wang HX(王洪新).Study on hydrolyzing ginkgo flavone glycoside with β-glycosidase.J Anhui Agric Sci(安徽农业科学),2008,36:30-32.
Optimum Extraction Technology of Kaempferol in Prunus cerasifera Leaves
WU Bo1*,ZHANG Wei-nong2,YAN Jian-fang3,ZHANG Han-jun11Center of Analysis and Measurement,Wuhan Polytechnic University;2Food Science and Engineering,Wuhan Polytechnic University;3Chemical and Environmental Engineering,Wuhan Polytechnic University,Wuhan 430023,China
The content of flavonoids in Prunus cerasifera leaves and its extraction technology were studied in this paper. By means of ethanol extracting,the optimum extraction conditions of kaempferol in P.cerasifera leaves were determined. The results showed that the content of quercetin and kaempferol were major flavonoids in P.cerasifera leaves,the optimum conditions of ethanol extracting were obtained as follows:70%ethanol as extraction solvent at 50℃for 1.5 h,and the ratio of material to solvent was 1∶15.Using the technological parameters above mentioned,the average extraction rate of kaempferol was 92.7%.After extracting,concentration,hydrolyzing,extraction and crystal,the average recoveries and product purity of kaempferol were 56.6%and 90.6%,respectively.
Prunus cerasifera leaves;kaempferol;extraction technology
1001-6880(2011)05-0952-04
2010-08-13 接受日期:2010-10-28
湖北省教育厅重点科研资助项目(D20101712)
*通讯作者 Tel:86-013006153299;E-mail:wb@whpu.edu.cn
Q946.91;R284.2
A

