胰蛋白酶原激活肽和白细胞介素-6在实验性急性胰腺炎中的意义
高 军,田志军,邱宝樑 ,李 非,孙家邦
1北京市第六医院普外科,北京 1000072首都医科大学 附属宣武医院普外科,北京 100053
·论著·
胰蛋白酶原激活肽和白细胞介素-6在实验性急性胰腺炎中的意义
高 军1,田志军1,邱宝樑1,李 非2,孙家邦2
1北京市第六医院普外科,北京 100007
2首都医科大学 附属宣武医院普外科,北京 100053
目的探讨血浆胰蛋白酶原激活肽(TAP)和血清白细胞介素-6(IL-6)作为早期预测实验性急性胰腺炎病情严重程度指标的可行性。方法雄性SD大鼠90只,随机分成5组。分别是3%牛磺胆酸钠逆行胆胰管注射组、5%牛磺胆酸钠逆行胆胰管注射组、3%牛磺胆酸钠逆行胆胰管注射后0.5h经股静脉注入乌司他丁组、0.9%生理盐水逆行胆胰管注射组和假手术组(只行开、关腹术)。每组18只大鼠,每组再随机分成3组,分别于制模后3、6、24 h后取血处死,留取标本。观察血清淀粉酶、血浆TAP水平、血清IL-6水平变化,并在光镜下对胰腺病变进行双盲组织病理学评分。结果制模后3和6 h血浆TAP水平5%牛磺胆酸钠逆行胆胰管注射组[(4.798±0.169)和 (3.999±0.299)nmol/L]比3%牛磺胆酸钠逆行胆胰管注射组[(2.416±0.148)和(3.356±0.211)nmol/L]明显增高(P<0.01);制模后6 h,血清IL-6水平5%牛磺胆酸钠逆行胆胰管注射组(1339.51±56.43)pg/ml明显高于3%牛磺胆酸钠逆行胆胰管注射组(619.07±42.25)pg/ml(P<0.01)。结论在轻重不同的急性胰腺炎模型中,胰腺病理改变越严重,血浆TAP和血清IL-6峰值出现越早。血浆TAP水平可以作为早期精确预测急性胰腺炎模型胰腺病变严重程度的指标。
胰蛋白酶原激活肽; 白细胞介素-6;急性胰腺炎;胰酶抑制剂
急性胰腺炎(acute pancreatitis,AP)是外科常见的急腹症之一。多数AP是一种自限性疾病,15%~20%的患者病情可能恶化成为重症急性胰腺炎(severe acute pancreatitis, SAP),SAP临床表现凶险,病死率高[1],有文献报道可达20%~30%[2]。国内外众多研究者一直想筛选出一个早期判断AP病情严重程度的可靠指标,以鉴别SAP患者和可能发展成为SAP的患者并给予早期积极的治疗,以提高SAP的治疗效果。胰蛋白酶原激活肽(trypsinogen activation peptides, TAP)和白细胞介素-6(interleukin-6, IL-6)就是近年引人关注的两个指标。本研究通过不同严重程度的大鼠急性胰腺炎模型中血浆TAP和血清IL-6水平的动态变化规律及其与胰腺组织病理学改变之间的关系,探讨TAP和IL-6作为早期预测此AP模型严重程度的指标的可行性,为血浆TAP和血清IL-6在临床AP患者诊治方面的应用提供依据。
材料和方法
分组将90只Sprague-Dawley(SD)大鼠(购自首都医科大学实验动物中心,清洁级)采用抽签法随机分成5组: 3%牛磺胆酸钠逆行胆胰管注射组[水肿性胰腺炎(edema pancreatitis,EP)组];5%牛磺胆酸钠逆行胆胰管注射组[坏死性胰腺炎(necrosis pancreatitis,NP)组]、3%牛磺胆酸钠逆行胆胰管注射后0.5 h经股静脉注入乌司他丁组[胰腺炎治疗(treatment pancreatitis,TP)组]; 0.9%生理盐水逆行胆胰管注射组[胰腺炎对照(control pancreatitis,CP)组]、假手术(sham operation,OP)组(只行开、关腹术)。每组18只大鼠,每组再采用抽签法随机分成3小组,每组6只大鼠,分别于制模后3、6、24 h后处死。
方法动物模型参照Aho等[3]的方法制作,用微量注射泵(SP-100型,日本JMS公司产品)向胆胰管内恒速注入牛磺胆酸钠(美国Sigma公司产品)溶液,其中,EP组和TP组注入的牛磺胆酸钠浓度为3%,NP组注入的牛磺胆酸钠浓度为5%。TP组于制模后0.5 h经股静脉注入乌司他丁(天普生物化学制药有限公司产品) 2.5万U/ml,36 ml/h,持续1 min。CP组注入与牛磺胆酸钠等量的0.9%生理盐水。OP组为假手术组。各组大鼠分别于制模后3、6、24 h后处死,离心(应用TGL-16G恒温高速离心机,上海安亭科学仪器厂生产)后留取血浆和血清标本,测定血浆TAP水平和血清IL-6水平。另取部分血清测定淀粉酶,将胰头部分胰腺作病理切片检查。
胰腺组织病变严重程度的评价胰腺组织病变严重程度的评价用改良的Schmidt法[4],并参照Pozsar等[5]的方法在光镜下对胰腺病变进行双盲评分来确定。具体评分方法:(1)水肿:0=无,1=轻度叶间隙增宽,2=重度叶间隙增宽,3=腺泡间隙增宽,4=细胞间隙增宽;(2)坏死:0=无,1=坏死面积1%~10%,2=坏死面积11%~20%,3=坏死面积21%~30%,4=坏死面积大于30%;(3)出血:0=无,1=有;(4)炎性细胞浸润:计数高倍视野下血管周围或小叶内白细胞数量,0=0~1个,1=2~10个,2=11~20个,3=21~30个,4=大于30个或出现微脓肿。每只动物胰腺组织病理学评分的最后得分为以上4项评分相加后所得的分值。
血浆TAP和血清IL-6的测定方法血浆TAP水平的测定采用TAP酶免疫测定(EIA)试剂盒(购自爱尔兰Biotrin International公司)完成。血清IL-6水平的测定采用大鼠IL-6酶联免疫吸附法(ELISA)试剂盒(购自美国Endogen公司)完成,具体操作步骤严格按试剂盒说明书进行。酶标仪采用LP-400型酶标仪(法国Basture公司产品)。
统计学处理采用SPSS 10.0统计软件,所有结果采用均数±标准差表示,用单因素方差分析各组均数的差异,然后再进行各组间的两两比较。
结 果
血清淀粉酶水平制模后3和6 h,血清淀粉酶水平EP、NP、TP、CP组与OP组相比明显升高(P<0.01)(表1)。
胰腺病理改变及组织病理学评分假手术组胰腺结构基本正常。EP、NP、TP、CP组胰腺组织有不同程度的胰腺间质水肿、腺泡细胞坏死、炎性细胞浸润和胰腺间质出血。制膜后3、6和24 h,胰腺组织病理学评分EP、NP、TP、CP组明显高于OP组(P<0.01),NP组胰腺组织病理学评分明显高于EP组(P<0.01)。制模后24 h,TP组胰腺组织病理学评分明显低于EP组(P<0.01)(表2)。
血浆TAP水平EP、NP、TP、CP组与OP组比较,血浆TAP水平在各观察时间点的差异均有统计学意义(P<0.01);制模后3和6 h,NP组血浆TAP水平明显高于EP组(P<0.01);制模后6 h,TP组血浆TAP水平明显低于EP组(P<0.01)(表3)。

表 1 各组大鼠制模后不同时相血清淀粉酶水平
OP:假手术;EP:水肿性胰腺炎; NP :坏死性胰腺炎; TP:胰腺炎治疗; CP:胰腺炎对照;与OP组比较,aP<0.01; 与EP组比较,bP<0.01
OP: sham operation; EP: edema pancreatitis; NP: necrosis pancreatitis; TP: treatment pancreatitis; CP: control pancreatitis;aP<0.01 compared with OP group;bP<0.01 compared with EP group
血清IL-6水平制模后3、6和24 h,EP、NP、TP组与OP组相比,血清IL-6水平差异均有统计学意义(P<0.01)。制膜后6 h,NP组血清IL-6水平明显高于EP组(P<0.01);制膜后6和24 h,TP组血清IL-6水平明显低于EP组(P<0.01)(表4)。

表 2 各组动物制模后不同时相胰腺病理组织学评分
与OP组比较,aP<0.01;与EP组比较,bP<0.01
aP<0.01 compared with OP group ;bP<0.01 compared with EP group

表 3 各组动物制模后不同时相血浆胰蛋白酶原激活肽水平
与OP组比较,aP<0.01;与EP组比较,bP<0.01
aP<0.01 compared with OP group ;bP<0.01 compared with EP group
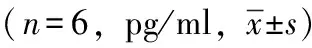
表 4 各组大鼠制模后不同时相血清白细胞介素-6水平
与OP组比较,aP<0.01;与EP组比较,bP<0.01
aP<0.01 compared with OP group;bP<0.01 compared with EP group
讨 论
TAP是位于脊椎动物胰蛋白酶原氨基末端的激活肽,在实验性AP模型和临床AP患者中,胰腺内的胰蛋白酶原异常激活导致TAP直接被释放进入腹腔和血液循环,激活的胰蛋白酶启动胰腺自身消化的链锁,导致胰腺组织内其他酶原的激活,造成胰腺损伤。定量测定TAP可以定量反应胰蛋白酶原激活的程度[6]。本研究应用牛磺胆酸钠逆行胆胰管注射诱发的大鼠AP模型与人类急性坏死性胰腺炎早期在形态学改变、病理生理学改变、生化改变及并发症方面[7]极其相似。
本研究最终胰腺病变严重程度有明显差异的EP组与NP组大鼠,在制模后3 h,胰腺病理组织学改变尚无统计学意义时,EP组与NP组血浆TAP水平差异已有统计学意义,这种改变一直维持到制模后6 h。而制模后24 h胰腺病理组织学改变最严重,且两组病理改变差异最明显时,血浆TAP水平差异已无统计学意义,表明在轻重不同的AP模型中,血浆TAP水平的差异先于胰腺组织病理学改变差异的出现。在24h胰腺病理改变最严重时,血浆TAP水平与胰腺病变不平行可能是由于胰腺病变的发展导致胰腺微循环灌注受损,胰腺组织中的TAP向血中释放减少造成的[8]。
IL-6是一种重要的炎症介质, 在细胞因子网络中发挥关键作用,在全身炎性反应的发生和发展中发挥主导作用, 可敏感地反应组织损伤的程度[9-10]。本研究制模后6 h,NP组血清IL-6水平比EP组明显增高,而EP组与NP组动物胰腺组织病理学改变的差异也开始于制模后6 h,故此时的血清IL-6水平可以准确反映EP、NP两组动物胰腺病变的严重程度。NP组血清IL-6水平在达到峰值后迅速下降,由于EP组血清IL-6水平峰值出现比NP组晚,到制模后24 h,两组血清IL-6水平的差异已不能够反映出两组动物胰腺病变的严重程度的差异。本研究表明,胰腺病变越严重,血清IL-6峰值出现越早,早期测定血清IL-6水平可以预测此AP模型胰腺病变的严重程度。
乌司他丁是从男性尿液中分离纯化的蛋白酶抑制剂, 可以抑制体内广泛分布的丝氨酸蛋白酶活性,具有减少炎性细胞浸润、抑制多种炎症因子和介质释放的功能[11]。本研究制模后6 h,TP组血浆TAP水平比EP组明显降低;制模后6和24 h,TP组血清IL-6水平比EP组明显降低;制模后24 h,TP组胰腺组织病理学评分明显低于EP组,表明乌司他丁能够不同程度地抑制胰蛋白酶原的激活和IL-6的产生及胰腺病变的发展。
本研究表明,在轻重不同的AP模型中,血浆TAP水平的差异早于血清IL-6水平差异的出现,血浆TAP水平的峰值早于血清IL-6水平峰值的出现。因而作为早期预测AP严重程度的指标,TAP的预测价值高于IL-6的预测价值。近年来,TAP作为早期预测临床AP患者病情严重程度指标的研究已在国外多个医疗中心内进行[12-14]。本研究表明:TAP对SAP的早期预测有较高的应用价值,TAP有望成为临床AP患者的一项常规检查指标。
[1] Talukdar R, Vege SS.Recent developments in acute pancreatitis[J].Clin Gastroenterol Hepatol,2009, 7(11 Suppl):S3-S9.
[2] Jha RK, Ma Q, Sha H,et a1.Acute pancreatitis: a literature review[J]. Med Sci Moni, 2009, 15(7):RA 147- RA 156.
[3] Aho HJ, Koskensalo ML, Nevalainen TJ. Experimental pancreatitis in the rat : sodium taurocholate-induced acute haemorrhagic pancreatitis[J]. Scand J Gastroenterol,1980, 15(4):411-416.
[4] Schmidt J, Lewandrowsi K,Warshaw AL, et al. Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat[J]. Int J Pancreatol,1992, 12(1):41-45.
[5] Pozsar J,Berger Z,Simon K, et al. Biphasic effect of prostaglan- dinE1 on the severity of acute pancreatitis induced by a closed duodenal loop in rats[J]. Pancreas,1996, 12(2):159-164.
[6] Gudmundsdottir A, Gudmundsdottir E, Oskarsson S, et al. Isolation and characterization of cDNAs from Atlantic cod encoding two different forms of trypsinogen[J]. Eur J Biochem,1993, 217(3):1091-1097.
[7] Kruse P, Hage E, Lasson A. Protease and protease inhibitors in taurocholate-induced acute pancreatitis in rats[J]. Int J Pancreatol,1999, 25(2):113-121.
[8] Mithofer K, Fernandez-del Castillo C, Frick TW, et al. Increased intrapancreatic trypsinogen activation in ischemia-induced experimental pancreatitis [J]. Ann Surg, 1995, 22(40):364-371.
[9] Peng YZ,Yuan ZQ,Li HB.Removal of inflammatory cytokinesand endotoxin by veno-venous continuous renal replacement therapy for burned patients with sepsis[J]. Burns,2005,31(5):623-628.
[10] Tsutsumi R,Kamohara Y,Eguchi S,et al.Selective suppression of initial cytokine response facilitates liver regenerationafter extensive hepatectomy in rats[J].Hepato Gastroentemlogy,2004, 51(4):701-704.
[11] 曾文红,白国强. 乌司他丁研究进展[J]. 中华肝胆外科杂志,2001,7 (1):52-54.
[12] 张明威,王欣,张静. 胰蛋白酶原激活肽与急性胰腺炎严重程度的相关性研究[J]. 临床肝胆病杂志,2007,23(6):448-449.
[13] 张维新,陈运和,肖翔宇,等. 血浆胰蛋白酶原激活肽和尿胰蛋白酶原-2在急性胰腺炎预后监测中的价值[J]. 江西医学院学报,2008,48(1):38-40.
[14] Ryu JK. Evaluation of severity in acute pancreatitis[J]. Korean J Gastroenterol, 2009, 54(4):205-211.
SignificanceofTrypsinogenActivationPeptidesandInterleukin-6inExperimentalAcutePancreatitis
GAO Jun1, TIAN Zhi-jun1,QIU Bao-liang1,LI Fei2,SUN Jia-bang2
1Department of General Surgery, Beijing NO.6 Hospital, Beijing 100007,China
2Department of General Surgery,Xuanwu Hospital of Capital Medical University,Beijing 100053,China
GAO Jun Tel:010-64035566-2483,E-mail: J-Kao@163.com
ObjectiveTo explore the feasibility of using plasma trypsinogen activation peptides (TAP) and serum interleukin-6(IL-6) as early markers for predicting the severity of experimental acute pancreatitis.MethodsNinety male adult Sprague-Dawley rats were equally randomized into five groups: edema pancreatitis group, treated with retrograde ductal infusion of 3% sodium taurocholate solution; necrosis pancreatitis group, treated with retrograde ductal infusion of 5% sodium taurocholate solution; treatment pancreatitis group, treated with retrograde ductal infusion of 3% sodium taurocholate solution and ulinastatin intravenous infusion half an hour later; control pancreatitis group, treated with 0.9% normal saline retrograde ductal infusion; and sham operation group, treated with sham operation. Rats in each group were equally randomized into three subgroups, which were killed by exsanguination 3, 6, or 24 hours after infusion, and blood specimens were obtained. Serum amylase, plasma TAP, and serum IL-6 were determined. The severity of pancreatitis was scored by two blinded pathologists under microscope.ResultsAt 3 and 6 hours after infusion, plasma TAP concentration of necrosis pancreatitis group [(4.798±0.169) and (3.999±0.299)nmol/L, respectively]were significantly higher than those of edema pancreatitis group [(2.416±0.148) and (3.356±0.211)nmol/L, respectively] (P<0.01); at 6 hours after infusion, serum IL-6 level of necrosis pancreatitis group [(1339.51±56.43)pg/ml]was significantly higher than that of edema pancreatitis group [(619.07±42.25)pg/ml] (P<0.01).ConclusionsIn this acute pancreatitis model, the peak levels of plasma TAP and serum IL-6 may appear earlier in rats with severer disease. Serum TAP level may be used as a marker for the accurate early prediction of the severity of acute pancreatitis.
trypsinogen activation peptides; interleukin-6; acute pancreatitis; pancreatin inhibitor
ActaAcadMedSin,2011,33(2):205-209
高 军 电话:010-64035566-2483,电子邮件:J-Kao@163.com
R657. 5
A
1000-503X(2011)02-0205-05
10.3881/j.issn.1000-503X.2011.02.021
2010-09-08)

