应激引起种猪急性死亡的诊断与治疗
康润敏,陈晓晖,曾 凯,徐昌文,周英顺
(1.四川省畜牧科学研究院,四川 成都610066;2.四川大学动物疫病防控与食品安全四川省重点实验室,四川 成都610064)
长途运输作为一种应激原常常会导致运送的猪只发生死亡和发病,Van der Meulen[1]等(2001)证明长途运输的应激能够降低肠道内pH值,使肠道的渗透性增加,运输结束后肠道的渗透性达到最高峰。渗透性的增加导致肠道内的细菌和内毒素从肠道迁移至全身血液循环中,这可能能够解释运输后疾病增加的原因[2-3]。2010年9月下旬,因猪场搬迁某集约化养猪场将猪只进行长途运输,猪场搬迁后20日间陆续出现11头种猪急性死亡。本次试验通过对急性死亡种猪临床症状观察,并采集急性死亡猪的病料,对可疑引起猪死亡临床症状和病理解剖变化的病原进行实验室诊断,并且进行细菌分离,然后检测分离出的细菌对18种常见药物的敏感性试验,为临床治疗提供依据。
1 材料
1.1 病料的采集 无菌采集急性死亡种猪的心、肝、脾、肺、肾、腹股沟淋巴结、脑等病料组织。
1.2 试剂 Trizol试剂、反转录试剂盒,购自上海英骏生物技术有限公司;TaqDNA聚合酶、dNTPs、DNAMarkerDL-2000,购自上海生工生物工程技术服务有限公司;药敏试纸,购自广州市迪景微生物科技有限公司;小鼠,购自四川大学华西医学院实验动物中心。
1.3 引物 猪瘟病毒引物是根据报道的中国C株E2区基因设计合成一对猪瘟病毒(Classical swine fever virus)特异性的PCR引物,片度跨幅A/D抗原区,扩增片段为375bp;猪日本乙型脑炎病毒引物根据GenBank报道的猪日本乙型脑炎病毒E基因序列并参考文献[4]设计,扩增片段为349bp;伪狂犬病病毒引物根据GenBank的伪狂犬病病毒gE基因并参考文献[5]设计,扩增片段为370bp;猪繁殖与呼吸综合征病毒按照JXA1株为参考设计部分NSP2基因为引物,经典猪繁殖与呼吸综合征病毒扩增片段为799bp,高致病性猪繁殖与呼吸综合征病毒扩增片段为709bp;16SPCR引物参照文献[6],扩增片段为1 500bp,上述引物序列见表1,上述引物均由上海生工生物工程技术服务有限公司合成。
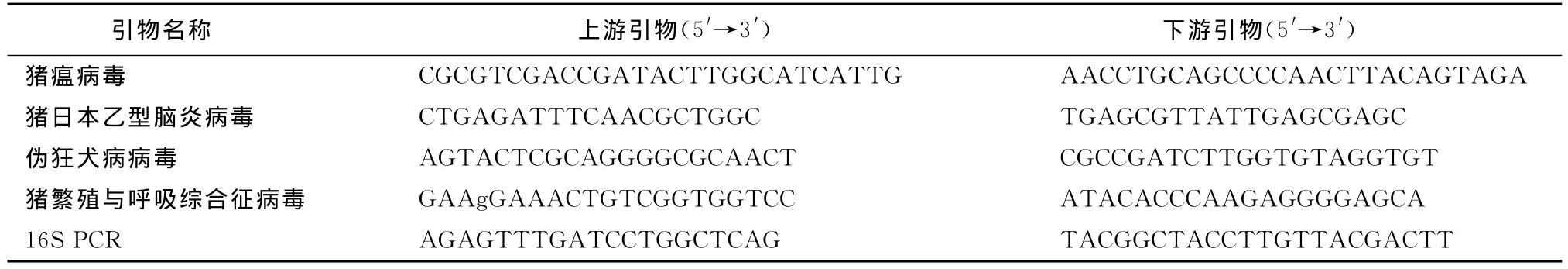
表1 各病毒引物序列
2 方法
2.1 临床症状 观察死亡种猪体表状况,剖检死亡猪只观察病死猪心、肝、脾、肺、肾、胃、肠、淋巴结、关节以及脑的病理变化。
2.2 病毒检测 无菌采集死猪病料(肺脏、脾脏、淋巴结等)剪碎,研磨后,加入灭菌的生理盐水,制成10%的悬液,-80℃保存用于病毒提取;用酚氯仿方法提取病料中的DNA,按Trizol试剂使用说明书来提取样品的总RNA;按照反转录试剂盒的说明书将样品的RNA直接进行反转录合成全长cDNA,将所提取的DNA和反转录的cDNA进行PCR反应,其反应体系如下:10×PCR Buffer 5μL,上/下游引物(50pmol/μL)各1μL,10mmol/LdNTP 2μL,25 mmol/L MgCl22μL,TaqDNA 聚合酶(5U/μL)1μL,灭菌双蒸水34μL,模板4μL。各病毒的扩增条件如下,猪瘟病病毒扩增条件:95℃5min;95℃1min,52℃1min,72℃1min,共35个循环,循环后72℃延伸10min;猪日本乙型脑炎病毒扩增条件:94℃5min;94℃30s,50℃30s,72℃1min,共30个循环,循环后72℃8min;伪狂犬病病毒扩增条件:94℃ 5min;94℃ 1min,55℃ 1min,72℃1min,共30个循环,循环后72℃延伸10min;猪繁殖与呼吸综合征病毒扩增条件:94℃3min;94℃40s,57℃45s,72℃5min,共29个循环,72℃10 min。
2.3 细菌分离 将无菌采集的死猪病料(心、肝、脾、肺、肾、淋巴结等)分别接种于含10%兔血的营养琼脂平板上,37℃培养48h,观察菌落形态,挑取单个菌落进行革兰染色镜检,然后挑取单个菌落接种于兔血的营养琼脂平板上纯化培养16h。
2.4 细菌致病性检测 挑取纯化的单菌落接种于10mL的血清肉汤中,将肉汤培养基放入37℃摇床中,振荡培养12h,取培养液0.2mL注射入健康小鼠腹腔,16h后观察小鼠的临床表现和死亡情况,并将死亡小鼠进行细菌分离。
2.5 细菌鉴定 16SrRNA通用引物对所分离细菌进行鉴定,反应体系如下:10×PCR Buffer 5μL,上/下游引物(50pmol/μL)各1μL,10mmol/L dNTP 2μL,25mmol/L MgCl22μL,TaqDNA 聚合酶(5U/μL)1μL,灭菌双蒸水34μL,cDNA模板4μL;16SrRNA扩增条件:94℃预变性1min,然后94℃1min,50℃1min,72℃1min 30s,循环30周期,最后72℃延长5min,反应结束后,16SrRNA产物经1%琼脂糖凝胶进行电泳,阳性16SrRNA产物直接送上海生工生物工程技术服务有限公司测序。
2.6 药敏试验 挑取纯化的细菌接种于10mL血清肉汤培养基中,将接有细菌的血清肉汤培养基放入37℃摇床中,振荡培养12h,取培养液0.2mL均匀涂抹在普通培养基的平板中,再将药敏纸片均匀的粘贴于培养基上,置入37℃培养箱中培养24h后,观察并测定抑菌圈直径。判定标准美国临床标准委员会(NCCLS)手册2005版。
3 结果
3.1 临床症状 长途运输后20日内,曾出现严重应激反应的成年种猪先后急性死亡11头,临床表现为高热(40℃~41.5℃),白猪全身皮肤表面发红,局部斑块状红疹,黑猪皮肤表面呈凸起状斑块,呼吸加快,牙关紧闭,口吐白沫或者血沫。急性死亡后病理变化以皮肤紫癜,以及心脏外膜、肺脏、胃底部、胸前淋巴结、肠系膜淋巴结严重出血等症状为主。
3.2 病毒检测 RT-PCR结果显示,死猪的病料中并未感染猪瘟病毒,经典猪繁殖与呼吸综合征病毒,高致病性猪繁殖与呼吸综合征病毒,猪日本乙型脑炎病毒;PCR结果显示,死猪的病料中未感染伪狂犬病病毒。
3.3 细菌分离 病料接种血琼脂平板中培养24h后,心、肝、脾、肺、肾接种区域均出现针尖大小菌落,培养48h后菌落呈现无色透明状;挑取单个菌落接种于普通营养琼脂中24h后见极小菌落,培养48h后见菌落长有针尖大小、菌落呈圆形、平滑、透明;经革兰染色后观察,各组织分离到的细菌均为革兰阳性杆菌、无鞭毛、无荚膜、形态极小、两端钝圆、部分细菌可见弯曲状,并且可见以单个和链状存在。
3.4 细菌致病性 注射小鼠后,小鼠于24h发生死亡,将死亡小鼠进行剖检,取死亡小鼠的心、肝、脾、肺、肾进行细菌分离,结果显示,从死亡小鼠器官中分离的细菌菌落大小似针尖状,革兰染色为阳性杆菌,部分可见弯曲状。
3.5 细菌检测 16SrRNA的产物的电泳结果见图1。使用NCBI中的Blast软件对测序结果进行在线比对,结果表明,分离菌株与猪红斑丹毒丝菌ATCC19414的同源性高达99%,结果显示,病猪是由于感染了猪红斑丹毒丝菌而导致死亡。
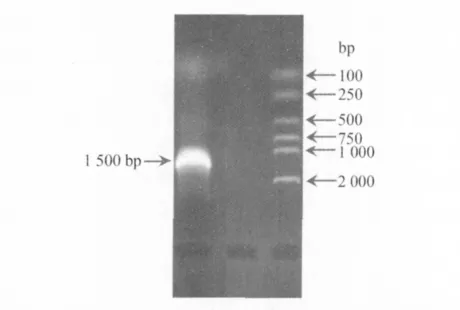
图1 16SrRNA产物在1%琼脂糖凝胶电泳结果
3.6 药敏试验 使用18种常见的抗菌药物对从病料中分离的猪红斑丹毒丝菌进行敏感性试验,结果显示,阿莫西林,氨苄西林,替卡西林,红霉素,头孢噻吩,恩诺沙星,头孢唑啉,环丙沙星,头孢噻吩对分离的丹毒杆菌的抑菌效果好,而分离的丹毒杆菌对阿米卡星,庆大霉素,新霉素,两性霉素具有耐药性。
4 治疗
本次通过诊断结果进行临床处理,全场进行丹巴二连苗(含猪丹毒杆菌G4T10弱毒株和猪多杀巴氏杆菌E0630弱毒株)猪紧急免疫,并且对出现临床症状的猪只使用药敏试验中高度敏感的恩诺沙星和阿莫西林,通过治疗和紧急免疫,猪只开始进食,病情逐渐好转,通过1周治疗后,病情得到很好的控制。
5 讨论
应激反应是指机体突然受到强烈有害刺激时,通过下丘脑引起血中促肾上腺皮质激素浓度迅速升高,糖皮质激素大量分泌导致畜禽一系列机体和代谢的改变。长途运输往往是引起应激反应的一个重要原因,而应激会导致疾病增加,Berends B R(1996)[7]试验证明运输导致的应激反应有可能是导致猪感染沙门菌的主要因素,本试验所研究的种猪急性死亡的病例也是由于种猪经过长途运输后感染猪红斑丹毒丝菌而导致的。猪丹毒是由猪红斑丹毒丝菌又称为丹毒杆菌引起的一种急性传染病,广泛分布于全国各地。抗生素是治疗细菌疾病的主要药物,由于抗生素的滥用导致细菌对大多数抗生素具有耐药性,本研究通过药敏试验证明猪红斑丹毒丝菌对阿米卡新,庆大霉素,新霉素和两性霉素具有耐药性,其结果与雷燕[8]结果相似,但是本研究中猪红斑丹毒丝菌对阿莫西林敏感,其结果与雷燕[8]结果相反,可能由于猪红斑丹毒丝菌的菌株不同或者本试验中研究猪红斑丹毒丝菌,并且本研究中的猪场在平时疾病治疗过程中并未大量以及时常使用阿莫西林,这也许是本研究分离的猪红斑丹毒丝菌对阿莫西林敏感,而雷燕[8]所分离的猪红斑丹毒丝菌对阿莫西林的不敏感的主要原因。
[1] van der Meulen J,de Graaf G J,Nabuurs M J A ,etal.Effect of transportation stress on intra-mucosal pH and intestinal permeability[C].8Symposium on Digestive Physiology in Pigs,CAB International,2001:329-331.
[2] Zucker B A,Kruger M .Auswirkungen von transportbelastugen auf den endotoxingelhalt im blut von schlac-htsch-weinen[J].Berl Munchen Tierarztl Wochenschr,1998,111:208-210.
[3] Berg R D.Bacterial translocation form the gastrointestinal tract[J].Adv Exp Med Biol,1999,473:11-30.
[4] 吕晓丽,崔保安,陈红英,等.复合RT-PCR检测猪乙脑病毒和猪流感病毒方法的建立[J].华南农业大学学报,2008,29(4):79-81.
[5] 韩勇,李文刚,项朝荣,等.猪伪狂犬病病毒的分离和鉴定[J].动物医学进展,2007,28(3):43-45.
[6] 龙雯,陈存社.16SrRNA测序在细菌鉴定中的应用[J].北京工商大学学报:自然科学版,2006,24(5):10-12.
[7] Berends B R,Urlings H A P,Snijders J M A,etal.Identification and quantification of risk factors in ani-mal management and transport regarding Salmonella spp in pigs[J].International Journal of Food Microbiology,1996,3(12):37-53.
[8] 雷 燕,颜其贵,韩国全,等.一起育肥猪急性死亡病例的诊治[J].猪业科学,2010,2:76-78.

