小鼠肌源性干细胞高表达CD34、Sca-1、Bcl-2和desmin*
韦 喆, 张金明, 安 庚, 冀晨阳, 潘淑娟
(中山大学孙逸仙纪念医院整形外科, 广东 广州 510120)
小鼠肌源性干细胞高表达CD34、Sca-1、Bcl-2和desmin*
韦 喆, 张金明△, 安 庚, 冀晨阳, 潘淑娟
(中山大学孙逸仙纪念医院整形外科, 广东 广州 510120)
目的探讨小鼠肌源性干细胞(MDSCs)的生物学特性和表型。方法取小鼠骨骼肌,用酶分步消化,应用差速贴壁法进行纯化获取MDSCs,观察细胞的形态,对MDSCs分别进行增殖能力、克隆形成率和融合情况等鉴定;通过流式细胞术、免疫荧光法及免疫印迹法(Western blotting)等检测初步确定细胞表型。结果经差速贴壁法获取的MDSCs为圆形或短梭形细胞,聚集成簇,呈对数生长;细胞倍增时间(9.69±2.08)h,克隆形成率(13.35±2.54)%;细胞在高汇合度(>50%)或低血清(2%FBS)培养时,极易融合成肌管或肌细胞链;流式细胞术和免疫荧光技术鉴定:CD34、Sca-1、Bcl-2和desmin在原代MDSCs中的表达均>90%;Western blotting检测显示随着细胞的纯化, desmin表达越来越强,α-SMA表达越来越弱。结论MDSCs通过差速贴壁法获取时纯度较高,它具有高水平表达CD34、Sca-1、Bcl一2和desmin的生物学特性,这4种蛋白可作为鉴定MDSCs的标志物。MDSCs增殖旺盛,可在体外大量扩增,是组织工程研究的一种新型种子细胞。
肌源性干细胞; Preplate技术; 细胞表型; CD34; 干细胞抗原1; 蛋白质Bcl-2; 结蛋白
肌源性干细胞(muscle-derived stem cells, MDSCs)作为一种成体干细胞,具有强大的增殖能力和多项分化潜能,并具有免疫赦免性[1],现已成为研究热点。与骨髓间充质干细胞[2]相比,MDSCs取材方便,来源广泛,对再生障碍性贫血或骨髓源性肿瘤等疾病的应用不受限制,在Duchenne肌营养不良、心肌缺血和肌肉缺损修复上取得了明显的效果[3,4],是组织工程研究的一种新型种子细胞。但是,由于缺少特异性细胞标记,使得MDSCs的鉴定存在争议。本研究旨在对小鼠MDSCs的生物学特性及表型进行研究,完善MDSCs的表型鉴定体系。
材 料 和 方 法
1材料
1.1动物 C57BL/6小鼠,雌性,2-3周龄,购自中山大学实验动物中心。
1.2试剂 DMEM-LG(Gibco),马血清(horse serum,HS,Hyclone),胎牛血清(fetat bovine serum,FBS,Gibco),Ⅺ型胶原酶(Sigma),dispase蛋白酶(Roche),0.25%胰酶-0.01%EDTA(Hyclone),1%青/链抗生素(1∶100,Hyclone),Hoechst33342(碧云天),MTT(Sigma), DMSO(Sigma),兔抗CD34(博士德),兔抗干细胞抗原1(stem cell antigen 1,Sca-1, Sigma),兔抗结蛋白(desmin, Sigma),兔抗凋亡相关蛋白(Bcl-2,博士德),兔抗α平滑肌肌动蛋白(α-SMA, Sigma) ,FITC-羊抗兔IgG(Sigma)、Cy3-羊抗兔IgG(Sigma),羊抗兔甘油醛-3-磷酸脱氢酶(GAPDH,上海康成); 过氧化物酶标记羊抗兔IgG(博士德),BCA-100蛋白定量测定试剂盒(博士德),Ⅱ抗曝光试剂盒(博士德)。
2方法
2.1MDSCs的获取及传代 根据Gharaibeh等[5]的方法加以调整,颈椎脱臼处死C57BL/6小鼠,无菌条件下切取四肢肌肉约5 g,转移入超净台剪成肉泥状置入离心管中;依次加入与组织等量体积的0.2%Ⅺ型胶原酶消化1 h,0.2% dispase消化30 min,0.25%胰酶-0.01%EDTA消化30 min。消化期间将离心管置于37℃恒温振荡摇床中(200 r/min),每次消化之间需离心(1 000 r/min离心5 min)并取沉淀进行下一步消化。消化完成后取沉淀加入DMEM-LG+10%FBS +10%HS+1%青/链抗生素的培养基吹打混匀,接种于25 cm2透气培养瓶中。放入37 ℃、5%CO2细胞培养箱内,24 h后将含有未贴壁细胞的培养基转移至离心管中离心(1 000 r/min离心5 min)后用新鲜培养基重悬,接种另一培养瓶中,记为第1次贴壁细胞(preplate 1,PP1)。依此类推,每次间隔24 h转瓶换液,分别记为第2次贴壁细胞(preplate 2,PP2)到第6次贴壁细胞(preplate 6,PP6)。PP6的贴壁细胞即为原代MDSCs。培养约7 d左右,细胞生长到50%,用胰酶进行消化,以1∶2的比例进行传代,每2d换液1次。
2.2MDSCs的增殖活性 取第1代MDSCs,以3 000cells/well接种于96孔板内,每孔液体量为200 μL,置于37 ℃、5%CO2细胞培养箱内培养,每隔2 d换液。隔天行MTT法在酶联免疫检测仪上测定波长492 nm下5个副孔的吸光度(A) 值,以时间(d)为横轴,A值为纵轴绘制生长曲线。并计算细胞的倍增时间(Patterson 公式):Td= Tlg2/ lg(Nt/ N0),Td:倍增时间(h); T:培养时间;N0: 起始细胞数;Nt: 第t天的细胞数。
2.3MDSCs的克隆形成率 取达80%汇合的PP6细胞,制成单细胞悬液, 以200 cells/well接种于6孔板内,培养7d后,纯甲醇固定30 min,Giemsa染色15 min,晾干。随机挑选10个孔,显微镜下计算每孔细胞数>50的克隆数,克隆形成率即为:克隆数/ 接种细胞数×100%。另选取1个孔,用CD34抗体进行免疫荧光检测。
2.4MDSCs的融合能力 收集原代MDSCs接种于6孔板内,将其分为3组(n=3)。第1组用生长培养基(DMEM - LG + 10% FBS + 10%HS),保持细胞生长大于50%;第2组用分化培养基(DMEM - LG + 2% FBS),当细胞生长将近50%时进行传代;第3组(对照组)用生长培养基,当细胞生长至30%-50%时进行传代。倒置相差显微镜观察形态学变化。
2.5流式细胞仪鉴定MDSCs 收集PP1-PP6细胞,胰酶消化离心取沉淀,PBS吹打重悬调整细胞浓度为1010cells/L以上,送流式细胞仪检测CD34、Sca-1、Bcl-2和desmin的阳性率。每个指标重复3次(n=3)。
2.6细胞免疫荧光鉴定MDSCs 将PP1-PP6细胞接种到24孔板内,24 h后进行处理。4%多聚甲醛固定30 min;PBS冲洗,0.2%Triton X-100破膜20 min,PBS冲洗,10%山羊血清封闭30 min。PBS冲洗后,各孔分别滴加CD34、Sca-1、Bcl-2和desmin覆盖细胞表面,浓度均为1∶100。4 ℃湿盒过夜。PBS冲洗,避光滴加Cy3-羊抗兔Ⅱ抗(1∶50)及FITC-羊抗兔Ⅱ抗(1∶50)在37 ℃下避光孵育30 min。大量PBS冲洗,避光滴加Hoechst 33342,37 ℃下避光孵育15 min,PBS冲洗后立即置于荧光显微镜下观察并拍照。
2.7Westernblotting提取PP1-PP6细胞的蛋白,BCA法测定各代的总蛋白浓度后调整上样体积,使得电泳时各泳道总蛋白量相等,在12%的SDS凝胶中进行电泳。转膜封闭后分别使用兔抗α-SMA(1∶500),兔抗desmin(1∶600)4 ℃孵育过夜,过氧化物酶标记羊抗兔Ⅱ抗(1∶5 000)37 ℃下孵育1 h后进行显色并曝光。并以GAPDH作为内参照,实验重复3 次。结果用Image-Pro Plus 6.0 图像分析软件测定各条带的吸光度值并进行分析。
3统计学处理
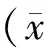
排除标准:(1)既往有肩部慢性疼痛史;(2)身体状况差,不能耐受手术;(3)既往有神经系统疾病引起的肩关节活动障碍。
结 果
1MDSCs形态学检测结果
PP1和PP2的细胞贴壁快(约2-3 h),数量多,形态以长梭形的成纤维样细胞居多,并混杂有其它形态的细胞如星形和不规则形。PP3和PP4细胞开始出现短梭形,圆形或多边形的贴壁细胞(约占10%-20%),同时还有成纤维样细胞和骨骼肌细胞。随着时间的增加,短梭形细胞逐渐增多,PP6中刚分离出来的细胞呈球形,折光性强。培养12 h后开始贴壁,大部分仍为圆形,48 h后完全贴壁并开始增殖,大部分细胞逐渐延展成短梭形或纺锤形,有两极,体积小(约占细胞总数的80%),7 d细胞增长达50%,培养10 d左右,细胞生长密集,并表现出一定的方向性,见图1。
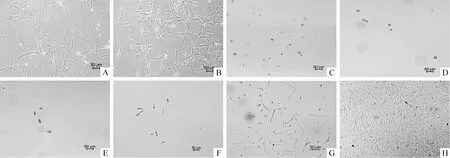
Figure 1. Preplate 1(PP1),preplate 4(PP4) and preplate 6(PP6)cells under microscope(A-G:×200;H:×100). With the isolating process, cells becomed increasingly small and spindly in shape.A:PP1; B:PP4;C:the inoculated cells of PP6 were round;D:PP6 cells began to adhere at 12 h; E:all cells were adherent at 48 h,and showed short shuttle and spindle shape;F:cells were shuttle shape or long spindle shape at 72 h;G:cells grew to 50% at 7 d;H: arrangement of PP6 cells were circinate, reticulate or radial at 10 d.
2MDSCs的生长曲线
以不同时点所测得A值, 经统计分析,组与组之间差异显著(Bonferroni法,P<0.01)。细胞接种后即开始进入增殖期,呈对数生长,至第7 d后增殖逐渐减慢,进入平台期,见图2。细胞的倍增时间为(9.69±2.08)h。
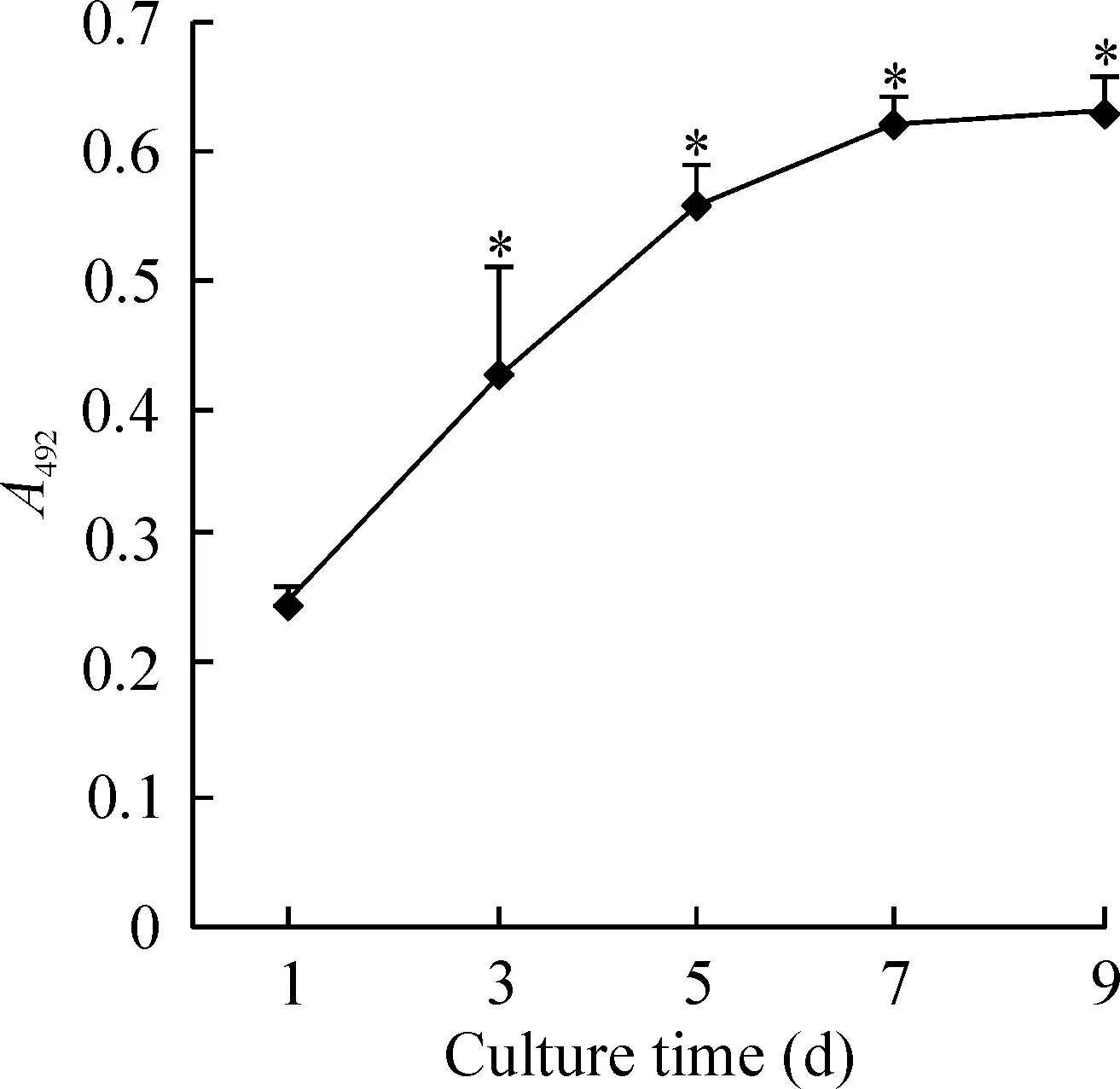
Figure 2. Proliferation capacity of MDSCs by MTT methods. The absorbance of 1 d,3 d,5 d,7 d,9 d were 0.25±0.01, 0.43±0.08, 0.56±0.03, 0.62±0.02 and 0.63±0.03.s. n=5. *P<0.05 vs 1 d.
3MDSCs克隆形成率
PP6细胞的平板克隆形成率为(13.35±2.54)%,差异显著(n=10,P<0.05)。免疫荧光显示这些克隆表达CD34,见图3。
4MDSCs融合情况
5流式细胞仪检测
在Qu-Petersen等[6]的基础上,利用差速贴壁法,将PP1-PP6的细胞分为4个标本,PP1主要为成纤维样细胞, PP2-PP3为早贴壁细胞群(early preplate cells,EPCs), PP4-PP5为晚贴壁细胞群(late preplate cells, LPCs),PP6即MDSCs。流式细胞仪检测结果示:从PP1-PP6细胞,CD34、Sca-1、Bcl-2和desmin的阳性率逐渐增高,呈上升趋势;desmin在PP1细胞内的表达低,但在PP2-PP6表达均较高,4种蛋白在PP6细胞中的表达均>90%,表明MDSCs纯度高,见表1。
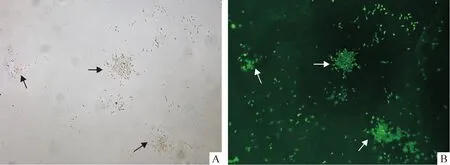
Figure 3. The colony forming of MDSCs(A,×100) and positive expression of CD34 in the colony cells(B,×100).
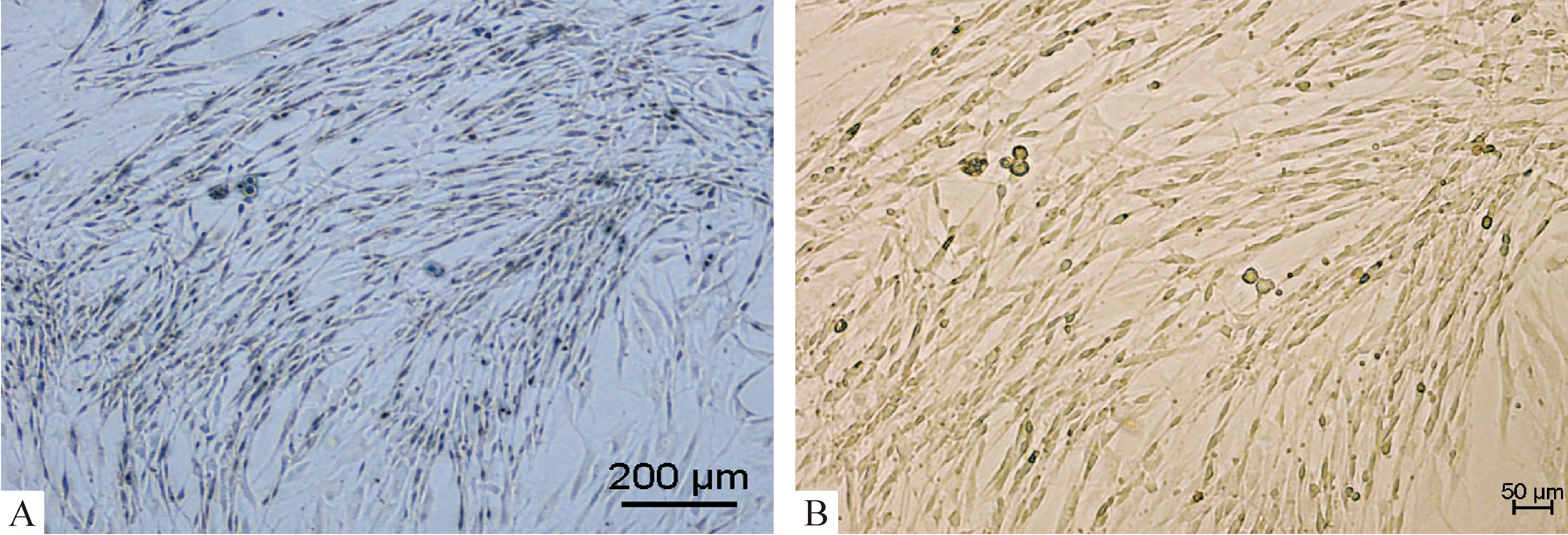
Figure 4. Cells fusion in preplate 6 cells(PP6). Numerous cell chains could be seen in PP6 when cultured under high confluence or low serum concentration.A,×100; B,×200.
表1 流式细胞仪检测结果
6细胞免疫荧光
细胞免疫荧光结果与流式细胞检测结果大致相同,从PP1-PP6表达Sca-1的细胞得到富集,细胞形态趋于一致,PP5和PP6中以短梭形细胞居多,有聚团生长的倾向;CD34、Bcl-2和desmin在MDSCs中也均有表达,见图5。
7Westernblotting结果
通过各组与其内参照吸光度的比值,得到desmin和α-SMA蛋白相对表达水平。组与组之间差异显著(P<0.05)。随着细胞的纯化,PP1-PP6细胞的desmin表达越来越强,在PP6细胞中desmin蛋白含量达到最大;α-SMA表达越来越弱,PP6细胞中α- SMA的表达量很少,见图6。
讨 论
在骨骼肌中存在着肌卫星细胞[7],其功能是使受损肌纤维得到一定程度的再生和修复。Qu-Petersen等[6]利用差速贴壁法(preplating technique)[8]从肌卫星细胞内分离出早贴壁细胞群(early preplate cells,EPCs)和晚贴壁细胞群(late preplate cells, LPCs),而LPCs内又分离出一小群慢贴壁细胞即肌源性干细胞。MDSCs具有干细胞的特征,但由于没有公认的鉴定金标准,现今仅能通过细胞形态和分子表型等方面初步确定。
通过Preplate技术获取的MDSCs具有特征性的形态,未贴壁的MDSCs是小而圆的球体,贴壁后逐渐变化为短梭形,聚集生长和对数增殖,并表现出一定的方向性。它具有强大的增殖能力,平板克隆形成率为(13.35±2.54)%,但在高汇合度(>50%)或低血清(2%FBS)培养时,极易融合成肌管或肌细胞链。经流式检测可初步认为得到的PP6为较纯的MDSCs。
目前尚无MDSCs表达的特异性标记物,使MDSCs的鉴定存在争议。研究[1,6]表明它表达CD34、Sca-1、desmin、MyoD和c-kit等细胞表型,但这些标志在成纤维细胞、EPCs、LPCs和肌卫星细胞内也呈阳性反应,这使得鉴别较为困难,而各文献选取检测的蛋白标志也不尽相同[6,8,9]。本实验采用4种抗体进行鉴定及区别。Sca-1和CD34[10]是髓系干细胞的标志,它们在MDSCs中高表达,既能反映其干细胞的特性,同时也能区别LPCs[6]。因为在获取MDSCs的过程中很易与LPCs混淆,虽然LPCs也表达Sca-1和CD34,但表达率低于MDSCs。本研究证实CD34和Sca-1在MDSCs的阳性率高达90%以上,而在LPCs的表达率只有70%-80%。然而,有研究认为干细胞中CD34的表达是可逆的[11],因而用它作为标记物应该谨慎。另一潜在的标记蛋白是Bcl-2,它是成肌分化通路上的一种早期表达蛋白,该蛋白可作为间接反映原始成肌化细胞的指标[12]。肌卫星细胞表达Bcl-2只有10%-30%[12],本实验证实在MDSCs的表达高达90%以上。结蛋白desmin是中间丝蛋白的一种,是目前公认的成肌化早期的特异性标志,流式检测它在MDSCs中的阳性率达到95%,表明了其肌源性的特征。虽然成纤维细胞与血管平滑肌细胞也产生结蛋白,但desmin含量低约10%左右,与抗体产生弱阳性反应[13]。α- SMA是平滑肌细胞的特异性标记,在成纤维细胞中亦为阳性,而在肌源性细胞则为阴性。因此,desmin和α- SMA组成的鉴定体系可用于排除成纤维细胞的污染。
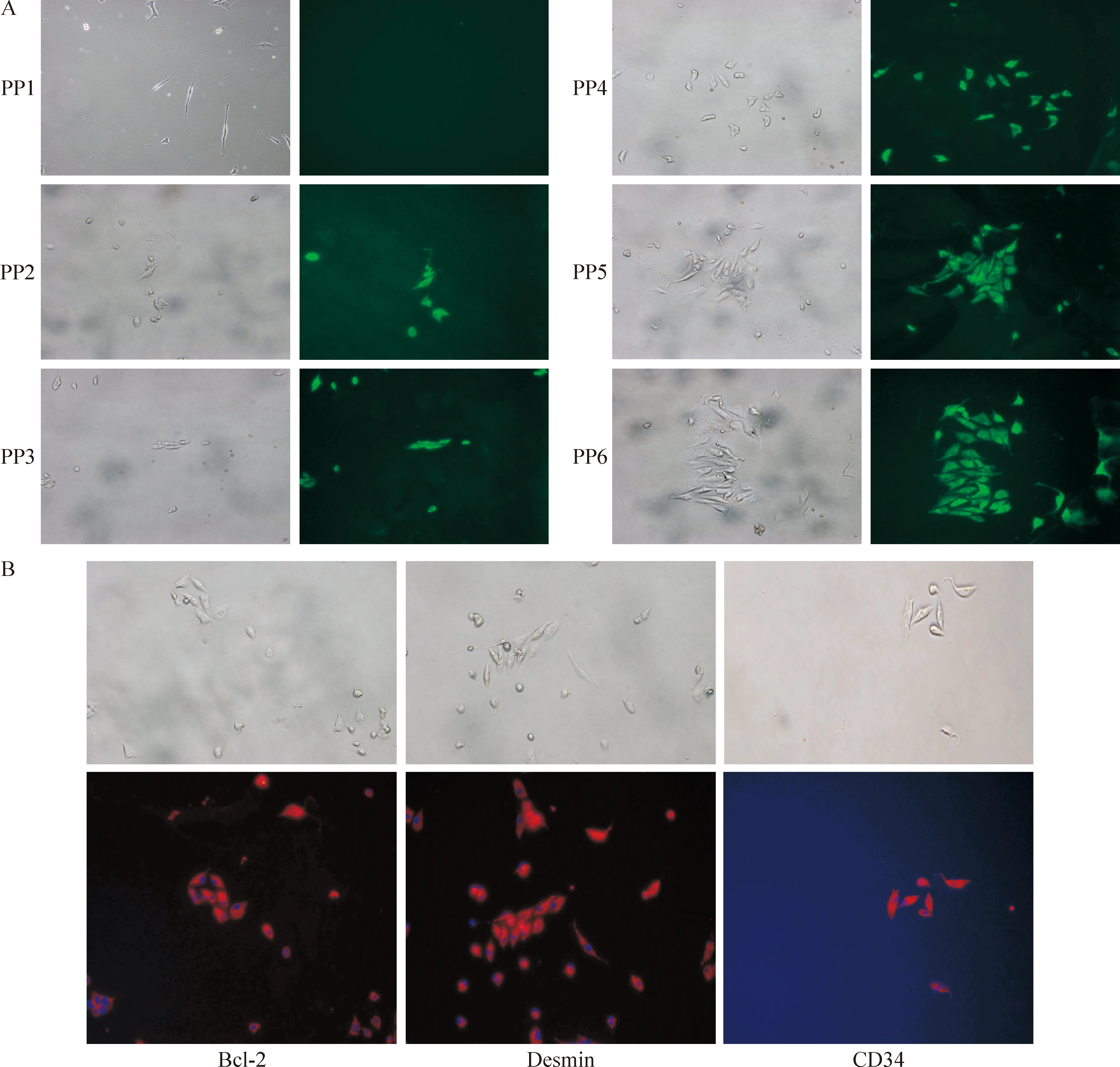
Figure 5. Results of immunofluorescence assay.A: Immunofluorescence staining showed that Sca-1+ cells from preplate 1 cells(PP1) to preplate 6 cells(PP6)(×200);B:expression of Bcl-2,desmin and CD34 was also positive in PP6 cells(×200).
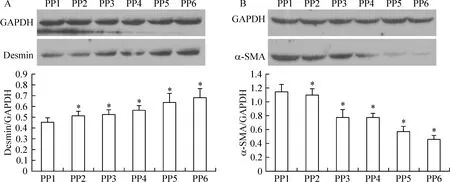
Figure 6. Results of Western blotting.With the purification of the cells,increased desmin expression(A) and decreased α-SMA expression(B) from preplate 1 cells(PP1) to preplate 6 cells(PP6) were shown. ±s. n=3. *P<0.05 vs PP1.
本实验证实了小鼠肌源性干细胞高表达CD34、Sca-1、Bcl-2和desmin。将这4种蛋白可作为鉴定肌源性干细胞表型的一个鉴定体系,既表明其干细胞及肌源性的特性,又在表型上与其它细胞区分。但值得注意的是,分子表型只是确认这种细胞的辅助手段之一,还须结合细胞的来源位置、长期增殖能力及多向分化能力等确定。
[1] Lee JY, Qu-Petersen Z, Cao B, et al. Clonal isolation of muscle-derived Cells capable of enhancing muscle regeneration and bone healing[J].J Cell Biol,2000,150(5): 1085-1100.
[2] Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999,284(5411): 143-147.
[3] Payne TR, Oshima H, Okada M, et al. A relationship between vascular endothelial growth factor, angiogenesis, and cardiac repair after muscle stem cell transplantation into ischemic hearts[J]. J Am Coll Cardiol, 2007,50(17): 1677-1684.
[4] 韦育林,伍 卫,王景峰,等. 骨髓间质干细胞体外诱导分化为心肌样细胞的实验研究[J]. 中国病理生理杂志, 2005,21(6): 1090-1093.
[5] Gharaibeh B, Lu A, Tebbets J, et al. Isolation of a slowly adhering cell fraction containing stem cells from murine skeletal muscle by the preplate technique[J]. Nat Protoc, 2008,3(9): 1501-1509.
[6] Qu-Petersen Z, Deasy B, Jankowski R, et al. Identification of a novel population of muscle stem cells in mice: potential for muscle regeneration[J]. J Cell Biol, 2002,157(5): 851-864.
[7] Baroffio A,Hamann M, Bernheim L, et al. Identification of self-renewing myoblasts in the progeny of single human muscle satellite cells[J]. Differentiation, 1996,60(1): 47-57.
[8] Richler C,Yaffe D. Theinvitrocultivation and differentiation capacities of myogenic cell lines[J]. Dev Biol, 1970,23(1): 1-22.
[9] 张金明,何 涛,梁伟强,等.兔肌源性干细胞的生物学特性及表型研究[J]. 中国病理生理杂志, 2006,22(11): 2239-2243.
[10]Torrente Y, Tremblay JP, Pisati F, et al. Intraarterial injection of muscle-derived CD34(+)Sca-1(+)stem cells restores dystrophin inmdxmice[J]. J Cell Biol, 2001,152(2): 335-348.
[11]Sato T,Laver JH,Ogawa M, et al. Reversible expression of CD34 by murine hematopoietic stem cells[J].Blood, 1999,94(8):2548-2554.
[12]Dominov JA, Dunn JJ, Miller JB. Bcl-2 expression identifies an early stage of myogenesis and promotes clonal expansion of muscle cells[J]. J Cell Biol, 1998, 142(2): 537-544.
[13]Alessandri G, Pagano S, Bez A, et al. Isolation and culture of human muscle-derived stem cells able to differentiate into myogenic and neurogenic cell lineages[J]. Lancet, 2004,364(9448): 1872-1883.
HighexpressionofCD34,Sca-1,Bcl-2anddesminproteinsinmousemuscle-derivedstemcells
WEI Zhe, ZHANG Jin-ming, AN Geng, JI Chen-yang, PANG Shu-juan
(DepartmentofPlasticandReconstructiveSurgery,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:zxmrwk@yahoo.com.cn)
AIM: To explore the characteristics and phenotype of the muscle-derived stem cells(MDSCs) of mouse.METHODSSkeletal muscle specimens were harvested from C57BL/6 mice of 2 weeks old. Preplate technique was applied to isolate MDSCs. The cellular growth status and morphology of the primary MDSCs were observed. The sphere-forming, proliferation and differentiation assays were performed and flow cytometry(FCM), immunocytochemistry and Western blotting were used to characterize MDSCs.RESULTSThe isolating process contained 6 consecutive days of differentiated attachment. MDSCs were round or short spindle-shaped cells. The growth curve of MDSCs showed logarithmic growth, and the doubling time of MDSCs was(9.69±2.08) h. Cloning efficiency of MDSCs was(13.35±2.54)%. When the cells at high confluence(>50%) or cultured with low concentration of serum(2% FBS), they tended to fuse to form myotubes. The observations of FCM and immunofluorescence showed that the phenotypic characteristics of MDSCs were antibody-positive for CD34, Sca-1, Bcl-2 and desmin(>90%). With increasing the level of cell purification, the upregulation of desmin expression and the downregulation of α-SMA expression from preplate 1 cells(PP1) to preplate 6 cells(PP6) were observed by Western blotting.CONCLUSIONThe preplate technique can effectively isolate MDSCs. MDSCs express the antigens of CD34, Sca-1, Bcl-2 and desmin at high levels, and the 4 proteins can be used to identify MDSCs. With a high proliferating abilityinvitro, MDSCs are ideal seed cells for tissue engineering.
Muscle-derived stem Cells; Preplate technique; Cell phenotype; CD34; Stem cell antigen 1; Protein Bcl-2; Desmin
R363
A
10.3969/j.issn.1000-4718.2011.02-023
1000-4718(2011)02-0332-06
2010-08-30
2010-10-09
国家自然科学基金资助项目(No.30672183);广东省科技计划资助项目(No.0711220600357)
△通讯作者 Tel:020-81332477;E-mail: zxmrwk@yahoo.com.cn

