高效液相色谱法研究牛乳源耐药金黄色葡萄球菌对环丙沙星的蓄积作用
曹兴元,白如念,罗应武,吴聪明
(1.中国农业大学动物医学院,北京 海淀 100193;2.北京市畜牧兽医总站,北京 朝阳 100185;3.北京市怀柔区动物疫病预防控制中心,北京怀柔101400)
金黄色葡萄球菌(以下简称金葡菌)对氟喹诺酮类药物的耐药性问题已引起人们极大的关注,并且对耐氟喹诺酮类药物的金葡菌的靶位点突变机制进行了广泛研究,国内学者初步探讨了多重耐药转运蛋白NorA介导的氟喹诺酮耐药机制[1-2]。目前已经证实,金葡菌中的多重耐药转运蛋白NorA,NorB和NorC均介导氟喹诺酮类药物的耐药性,并且NorA[3],NorB[3]和NorC[4]均为细菌中常见的主要易化子家族类的由质子力驱动的外排泵[5]。本文采用临床分离的牛乳源环丙沙星耐药的金葡菌,通过建立的高效液相色谱法(HPLC-FLD),测定了临床分离的耐药、敏感菌及金葡菌标准菌株ATCC 29213在加入一种质子驱动力的阻断剂氰氯苯腙(CCCP)前后对环丙沙星蓄积量的差异,为深入研究外排泵介导的耐药机制提供了试验用菌株,同时为临床检测通过外排泵介导耐药的金葡菌提供了方法学上的依据。
1 材料与方法
1.1 菌株 27株野生环丙沙星耐药金葡菌、3株野生环丙沙星敏感金葡菌和1株金葡菌标准菌株ATCC 29213。
1.2 药品与试剂 环丙沙星标准品购自中国药品与生物制品检定所。乙腈,色谱纯,购自Dikma公司;磷酸,三乙胺,盐酸,甘氨酸等均为色谱纯。氰氯苯腙(CCCP)购自美国Sigma公司。
1.3 MIC测定 对30株临床分离的牛乳源金葡菌进行环丙沙星的最小抑菌浓度(MIC)测定,参照(NCCLS)推荐的微量肉汤稀释法进行[6]。
1.4 细菌处理 取过夜生长的金黄色葡萄球菌营养肉汤培养物在新鲜肉汤中稀释 100倍,生长至OD 600为0.6后,5 000 r/min离心15 min。弃上清,用50 mmol/L的磷酸盐缓冲液(p H值为7.0)重新悬浮使OD600为3.6。将环丙沙星标准添加液加入每个细菌样品中,终浓度为10 mg/L。从此时开始计时,每隔1 min吸取1 mL样品于1.5 mL塑料管中,并放置于冰上。在加入环丙沙星5 min后,加入CCCP(终浓度为100μmol/L),同时设置对照组为不加CCCP的样品。待CCCP作用5 min后,分别从CCCP处理组和对照组取出1 mL样品也置于冰上。将所有置于冰上的样品在4℃下,以5 000 r/min离心10 min。然后,用1 mL冰冻的50 mol/L的磷酸盐缓冲液(p H值 7.0)冲洗 2遍。样品经4℃12 000 r/min离心 5 min后,弃掉上清,并用1 mL p H值为3.0的盐酸甘氨酸缓冲液重新悬浮,室温放置裂解细菌。16 h后,将每个样品室温下12 000 r/min离心10 min后,取上清液于进样小瓶中进HPLC检测。
1.5 HPLC方法
1.5.1 HPLC色谱条件 检测器:Waters 2475荧光检测器;色谱柱:Supelcosil LC-18-DB,250 mm×4.6 mm,粒径 3.5μm;流动相:磷酸-三乙胺缓冲液:乙腈(80/20,v/v);流速:1.0 mL/min;激发 波长:280 nm;发射波长:450 nm;进样量:100 μL 。
1.5.2 标准曲线 用p H值为3的磷酸-三乙胺缓冲液稀释环丙沙星标准储备液,分别配制浓度为0.001 mg/L、0.01 mg/L、0.05 mg/L、0.1 mg/L、1 mg/L、10 mg/L的标准工作液,直接进样测定。每一浓度进样3次,以标准工作液的浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.5.3 HPLC检测限和定量限的测定 取已裂解的细菌样品,6个平行,按样品前处理1.4步骤处理,测得基线噪音值,按S/N=3和S/N=10计算,分别求得该方法的检测限和定量限。
1.5.4 添加回收率的测定 设0.001 mg/L、0.1 mg/L、10 mg/L 3个添加水平,并设定空白对照,每个水平设5个平行。分别取定量的已裂解的细菌样品,添加一定体积的环丙沙星标准品添加液,使样品中药物浓度为0.001 mg/L、0.1 mg/L、10 mg/L,按样品前处理1.4步骤处理后进HPLC测定。
1.5.5 精密度的测定 取定量的已裂解的细菌样品,添加一定体积的环丙沙星标准品添加液,使其在组织中的浓度为0.001 mg/L、0.1 mg/L、10 mg/L,按样品前处理1.4步骤处理后进HPLC测定。批内每个浓度做5个平行,共做3个批次。
1.6 数据处理 本试验采用双尾T-test检验判断细菌对环丙沙星的蓄积量的差异是否显著。P<0.05表示差异显著,而且说明存在外排泵介导的金葡菌对氟喹诺酮类耐药。
2 结果与分析
2.1 检测限、定量限、添加回收率和精密度 标准品(0.05 mg/L)色谱图、空白细菌样品色谱图和添加细菌样品(0.05 mg/L)色谱图见图1。按信噪比S/N=3,求得检测限为0.3μg/L,根据 S/N=10,求得定量限为1μg/L,可满足试验检测要求。平均回收率范围在94.60%~105.31%之间,日内变异系数范围在1.70%~8.63%之间,日间变异系数范围在3.56%~9.09%之间,表明该方法稳定可靠,可满足定量分析的要求。
2.2 标准曲线 在浓度为0.001~10 mg/L范围内的回归方程为,Y=2 000 000X-3 005.1,相关系数R2=0.999 9。
2.3 HPLC法测定31株金黄色葡萄球菌对环丙沙星的蓄积量 环丙沙星在金葡菌内蓄积迅速,对于标准菌株ATCC 29213,环丙沙星在加入菌液5 min后就蓄积达到稳态浓度。为了研究31株金黄色葡萄球菌中外排泵的存在情况,选择环丙沙星蓄积量发生显著变化的EZP29菌株和没有发生显著变化的DXP17菌株,将CCCP加入待测样品中,观察CCCP对外排泵发挥抑制作用后细菌内环丙沙星蓄积量的变化(图2)。对于EZP29和DXP17菌株,CCCP处理后均能够显著增加环丙沙星在细菌内的蓄积量,这种作用与CCCP未处理前细菌对环丙沙星的蓄积能力无相关性。
添加CCCP后,大多数菌株改变了对环丙沙星的蓄积量,结果见表1。从整体来看,药物蓄积量的平均值在3.94~8.49 mg/L范围内,提高了1.55倍。其中来自RYP、DXP和SBP农场的菌株具有较高的稳态药物浓度,为14.94±1.32 mg/L,其他菌株的稳态浓度均低于6.5 mg/L。来自EZP和TZP农场的菌株则具有较低的稳态药物浓度,分别为1.73±0.45 mg/L和 1.73±0.91 mg/L(见表1)。31株菌中有11株菌的药物蓄积量的变化具有差异显著性(P<0.05),说明这些菌中有外排泵发挥作用。而且,外排泵出现在不同耐药水平的菌株中。


3 讨论
本试验采用高效液相色谱法来测量细菌内环丙沙星的蓄积量,检测限比较低,这可能与细菌的组成简单、易提取和纯化有关。此外,与Mortimer等[7]报道的荧光检测法相比,HPLC检测方法灵敏度更低,线性关系更好,线性范围更广。本试验对细菌中环丙沙星的提取过程与先前的研究略有差异,Zeller等[8]认为细菌沐浴在药液中时加入葡萄糖有利于提高菌内药物的蓄积量,但是有试验表明,葡萄糖会抑制CCCP的作用[9],所以本试验没有采用葡萄糖,而且同时也简化了试验步骤。
CCCP处理前后金葡菌对环丙沙星蓄积量的差异是否显著预示着细菌是否存在外排泵介导的耐药机制。本试验数据表明,约有50%的菌株由外排泵介导耐药,其中包括1株JTP16敏感菌。进一步试验发现,JTP16菌株QRDRs区域未发生点突变现象,推测可能的外排泵并不能介导对氟喹诺酮的高水平耐药。如果把耐药菌株划分为3个组:低水平耐药(4,8 mg/L)、中度水平耐药(16,32 mg/L)和高水平耐药(64,128 mg/L),则在不同耐药水平的菌株中存在外排泵介导的耐药机制的比率分别为57.10%,31.30%和75.00%,可见在高水平耐药菌株中外排泵介导的耐药现象比例也很大。先前对NorA的研究结果表明,NorA仅介导对金葡菌对氟喹诺酮类药物的低水平耐药[10],去除靶基因突变介导的耐药部分作用,不排除NorB和NorC也参与了介导金葡菌对环丙沙星的耐药,详细的分子机制有待进一步深入研究。
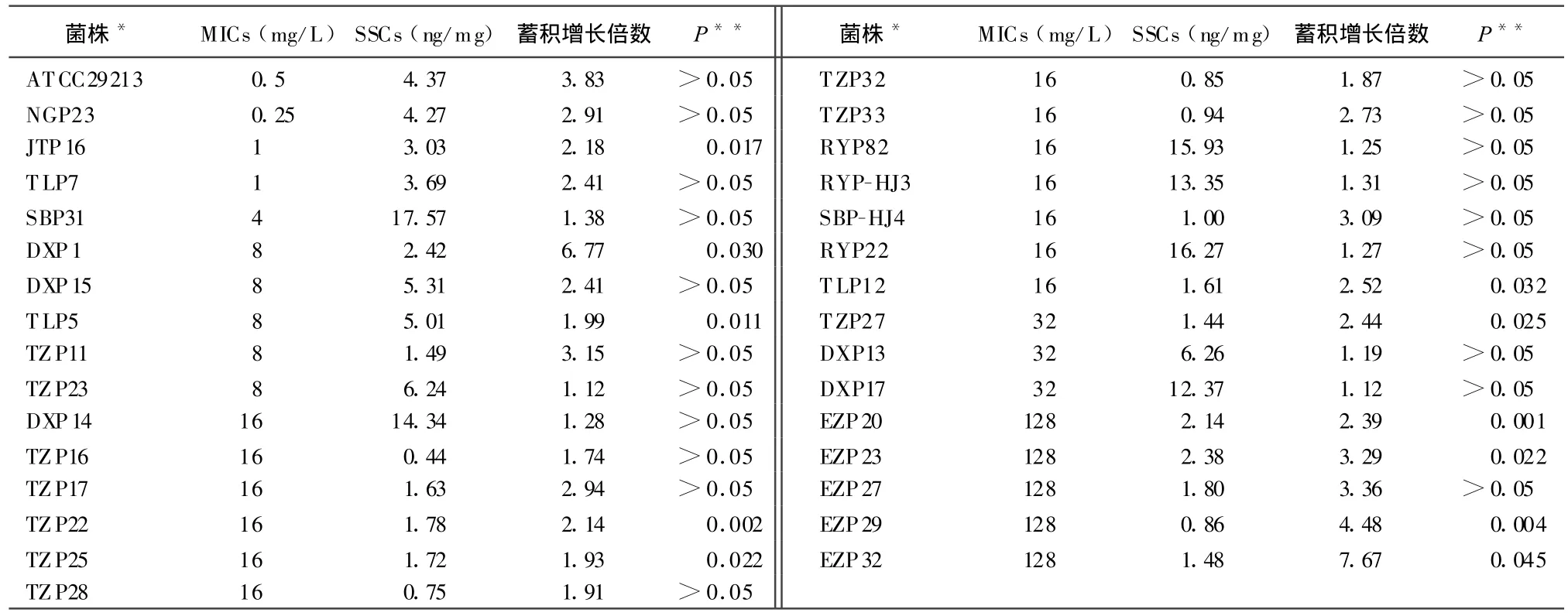
表1 环丙沙星在31株金葡菌中蓄积的稳态浓度(SSCs)和CCCP处理后药物在菌中的蓄积量
[1] 钟利,冯萍,范昕建,等.nor A基因介导的金黄色葡萄球菌对氟喹诺酮类药物耐药机制的研究[J].中华传染病杂志,2003,21:142-144.
[2] 杜锐,韩文瑜,雷连成.金黄色葡萄球菌氟喹诺酮耐药性与nor A基因m RNA表达水平的关系[J].中国兽医学报,2006,26:66-68.
[3] Truong-Bolduc Q C,Dunman P M,Strahilevitz J,et al.MgrA is a multip le regulator of two new efflux pumps in Staphylococcus aureus[J].J Bacteriol,2005,187:2395-2405.
[4] Truong-Bolduc Q C,Strahilevitz J,Hooper DC.Nor C,a new efflux pump regulated by MgrA of Staphylococcusaureus[J].Antimicrob Agents Chemother,2006,50:1104-1107.
[5] Pao S S Paulsen I T,Saier M J,et al.Major facilitator superfamily[J].Microbiol Mol Biol Rev,1998,62:1-34.
[6] NCCLS:抗微生物药物敏感性实验执行标准[S].2006版.
[7] Mortimer PGS and Piddock L J V.A comparison of methods used for measuring the accumulation of quinolones by Enterobacter iaceae,Pseud omonas aeruginosa and Staphylococcus aur eus[J].J Antimicrob.Chemother,1991,28:639-653.
[8] Zeller V,Janoir C,Kitzis M-D,et al.Active efflux asa mechanism of resistance to ciprofloxacin in Streptococcus pneumoniae[J].Antimicrob Agents Chemother,1997,41:1973-1978.
[9] Piddock L J V and Johnson M M.Accumulation of 10 Fluoroquinolones by Wild-Type or Efflux Mutant Strep tococcuspneumoniae[J].Antimicrob Agents Chemother,2002,46:813-820.
[10]Ferrero L,Cameron B,Crouzet J.Analysis of gy r A and gr lA mutations in stepwise-selected ciprofloxacin-resistant mutants of Staphylococcus aureus[J].Antimicrob Agents Chemother,1995,39:1554-1558.

