MiR-590-3p在胰腺癌干细胞中的表达
宫伟强 秦仁义 王敏 田锐 朱峰 石程剑 张志发 李旭 洪晓泉
·论著·
MiR-590-3p在胰腺癌干细胞中的表达
宫伟强 秦仁义 王敏 田锐 朱峰 石程剑 张志发 李旭 洪晓泉
目的应用无血清培养基分离胰腺癌干细胞,检测其miR-590-3p的表达。方法运用无血清培养基克隆培养ASPC-1、PANC1细胞,检测其单克隆形成、分化及细胞周期、半数抑制浓度(IC50)和表面标记物CD24+、CD44+表达。实时定量PCR法检测细胞miR-590-3p的表达。结果经无血清培养基培养,(0.94±0.53)%的ASPC-1细胞和(0.57±0.12)%的PANC1细胞能存活,呈克隆球样悬浮生长,并可以在体外连续传代。加入血清后细胞球又重新贴壁生长。ASPC-1细胞球G0/G1期比例和CD24+、CD44+、CD24+CD44+的细胞比例及IC50分别为(75.3±5.4)%、0.96%~2.01%、27.52%~34.47%、0.35%~0.44%和(224.37±5.71)μg/ml,均显著高于亲本细胞的(43.7±3.8)%、0.38%~0.42%、17.65%~18.25%、0.05%~0.08%、(11.43±2.10)μg/ml(P值均<0.05)。PANC1细胞球G0/G1期比例和CD24+、CD44+、CD24+CD44+的细胞比例及IC50分别为(80.1±4.7)%、5.31%~9.84%、72.05%~93.06%、4.91%~5.21%、(296.58±4.27)μg/ml,均显著高于亲本细胞的(46.1±5.3)%、4.09%~4.97%、47.71%~55.66%、1.48%~2.63%、(26.17±3.81)μg/ml(P值均<0.05)。ASPC-1、PANC1细胞球miR-590-3p表达分别是亲本细胞的4.67和4.52倍。结论应用无血清培养基可以从ASPC-1、PANC1细胞系中分离出具有干细胞特性的胰腺癌细胞球,其miR-590-3p表达上调,该基因可能是胰腺癌干细胞特性维持的关键基因。
胰腺肿瘤; 肿瘤干细胞; 微RNAs; 细胞球; 无血清培养基
研究表明,胰腺癌干细胞是胰腺癌中的恶性核心细胞,无血清培养法能有效地分离到胰腺癌干细胞。microRNA是正常胚胎干细胞和肿瘤干细胞自我更新和分化特性维持的关键基因。我们的前期研究表明,miR-590-3p在原代胰腺癌CD24+CD44+ESA+亚群细胞中高表达。本实验检测胰腺癌细胞系ASPC-1和PANC1中干细胞的miR-590-3p的表达。
材料和方法
一、细胞球的培养分离和传代
胰腺癌细胞系ASPC-1、PANC1由本实验室长期培养保存。取对数生长期细胞,以1×103个/ml密度重悬于无血清DMEM/F12培养基,并添加20 μg/L EGF(PeproTech公司)、10 μg/L bFGF(PeproTech公司)、2% B27(Invitrogen公司)、1 mg/L胰岛素、1×10-7mol/L地塞米松、0.4% BSA、105U/L青霉素G和100 mg/L链霉素。常规培养3~4 d后收集形成的细胞球,机械吹打成单细胞,重悬于上述培养基,按1∶4的比例传代。
二、克隆细胞的形成
取ASPC-1和PANC1单细胞悬液,按160、80、40、20、10、5个细胞梯度接种于96孔板中,每2 d添加25 μl 无血清培养液,培养8 d后计克隆数。每孔接种的细胞数作为自变量,以每个浓度未形成细胞球的百分比作为应变量,按Bellows等[1]和Tropepe等[2]法求出胰腺癌干细胞在胰腺癌细胞系中的比例。实验重复5次。
三、细胞球的分化诱导
取ASPC-1、PANC1细胞球,培养于含10% FBS的DMEM中,观察细胞球的生长。取培养1、7、14 d 的细胞,三去污裂解液法提取细胞蛋白,常规行蛋白质印迹法检测CK18的表达。鼠抗人CK18抗体购自Cell Signaling公司,1∶200稀释。最后ECL试剂盒显影,扫描测定条带吸光度(A)值。
四、细胞周期检测
取培养7 d的胰腺癌细胞球及普通培养的癌细胞制备单细胞悬液,调整细胞密度为1×106/ml。加入-20℃预冷的70%乙醇4℃固定过夜。加入RNase(终浓度50 μg/ml)及PI染液(终浓度50 μg/ml)37℃孵育30 min,流式细胞仪分析细胞周期。实验重复3次。
五、细胞耐药性检测
取培养7 d的胰腺癌细胞球及普通培养的癌细胞制备单细胞悬液,调整细胞密度为2×104/200 μl。加入吉西他滨,终浓度分别为0、5、10、20、40、80、160、320、640、1200 μg/ml,每个浓度设3个复孔。静止培养72 h后,每孔加入10 μl CCK-8,37℃孵育2 h,酶标仪测定各孔A450值。
六、细胞表面标记物CD24+、CD44+检测
取培养7 d的胰腺癌细胞球及普通培养的癌细胞制备单细胞悬液,调整细胞密度为106/100 μl,加入鼠抗人CD24-FITC、CD44-APC抗体,以不加抗体作为对照,冰上避光孵育30 min, PBS洗涤两遍,用流式细胞仪检测。实验重复3次。
七、MiR-590-3p表达检测
取培养7 d的胰腺癌细胞球及普通培养的癌细胞,Triol法抽提细胞总RNA,实时定量PCR检测miR-590-3p的表达。miR-590-3p引物上游:5′-ACACTCCAGCTGGGAATTTTATGTATAA-3′;下游:5′-TGGTGTCGTGGAGTCG-3′,扩增产物为72 bp。内参U6引物上游:5′-CTCGCTTCGGCAGCACA-3′;下游:5′-AACGCTTCACGAATTTGCGT-3′,扩增产物为65 bp。引物购自广州锐博生物公司。PCR反应条件:95℃ 20 s,95℃ 10 s、60℃ 20 s、70℃ 1 s,40个循环,采用ABI 7300软件,应用2-ΔΔCT方法[3]计算miR-590-3p的表达,以普通培养的癌细胞的表达量为1,计算细胞球的表达倍数。同时,PCR扩增产物经琼脂糖凝胶电泳,Goldview染色。实验重复3次。
八、统计学处理
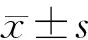
结 果
一、胰腺癌细胞球的形成、传代及分化诱导
ASPC-1、PANC1细胞在无血清培养液中培养24~36 h形成少量体积较小的悬浮细胞,形态不规则,折光性较差(图1a),以后细胞球体积增大,形态更为致密,折光性强(图1b),14~ 20 d形成致密的形态一致的细胞球(图1c)。细胞球细胞传代后7~9 d仍可形成悬浮细胞球。
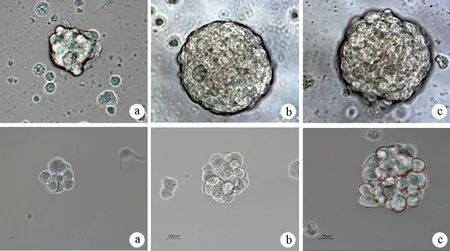
图1培养24 h(a)、72 h(b)、7 d(c)的ASPC-1(上)及PANC1(下)细胞球形态变化(×200)
绝大多数细胞球于3 h后开始贴壁,12 h后细胞球变扁,形状不规则(图2a);24 h贴壁细胞数量明显增加,迁移出的细胞呈放射状分布(图2b);72 h细胞球形态消失,细胞贴壁生长(图2c),与正常含血清培养条件下的细胞形态相似。同时,上皮细胞相关蛋白CK18表达量随时间延长而增加(图3)。
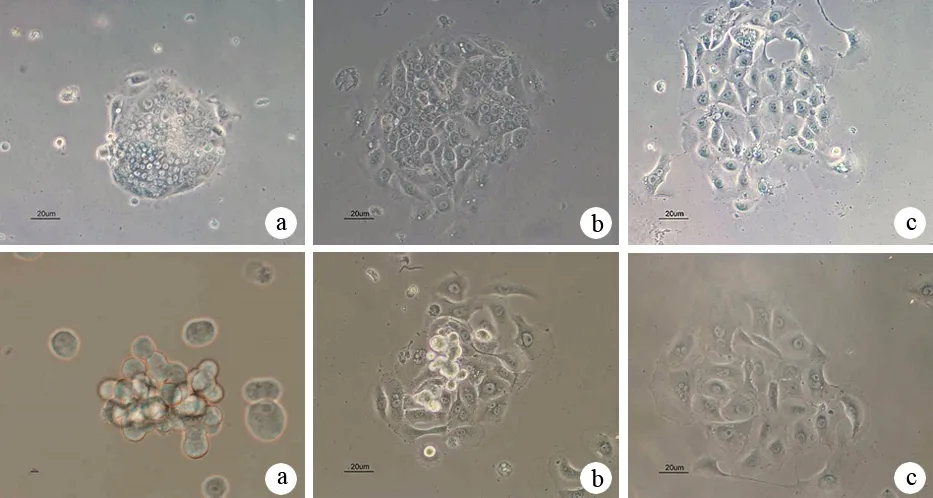
图2加入FBS诱导12(a)、24(b)、72 h(c)的ASPC-1细胞球(上)及PANC1(下)细胞球形态变化(×200)
二、单克隆细胞的形成
经培养,ASPC-1、PANC1细胞形成一个肿瘤细胞球所需的细胞数分别为107.8±21.6、184.0±13.5,表明ASPC-1和PANC1仅有(0.94±0.53)%和(0.57±0.12)%的细胞具有克隆形成能力。
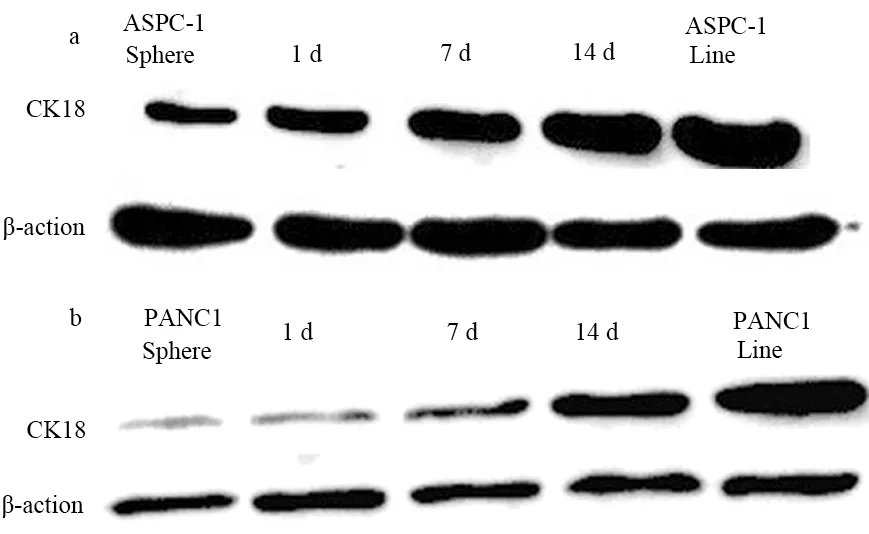
图3 ASPC-1(a)及PANC1(b)的细胞球CK18的表达
三、细胞周期的变化
ASPC-1、PANC1细胞球的G0/G1期比例分别为(75.3±5.4)%和(80.1±4.7)%(图4),均显著高于亲本细胞的(43.7±3.8)%和(46.1±5.3)%(P值均<0.05)。
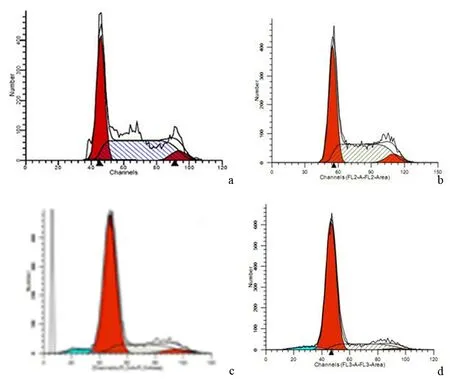
图4ASPC-1(a)、PANC1(b)、ASPC-1细胞球(c)、PANC1细胞球(d)的细胞周期分布
四、癌细胞耐药性的变化
吉西他滨干预72 h后, ASPC-1、PANC1细胞球的半数抑制浓度(IC50)分别为(224.37±5.71)、(296.58±4.27)μg/ml,均显著高于亲本细胞的(11.43±2.10)、(26.17±3.81)μg/ml(P值均<0.05)。
五、CD24+、CD44+细胞的比例
ASPC-1细胞中CD24+、CD44+和CD24+CD44+的比例分别为0.38%~0.42%、17.65%~18.25%和0.05%~0.08%;ASPC-1细胞球中分别为0.96%~2.01%、27.52%~34.47%和0.35%~0.44%。PANC1细胞中CD24+、CD44+和CD24+CD44+比例分别为4.09%~4.97%、47.71%~55.66%和1.48%~2.63%;PANC1细胞球中分别为5.31%~9.84%、72.05%~93.06%和4.91%~5.21%(图5)。细胞球均显著高于亲本细胞(P值均<0.05)。
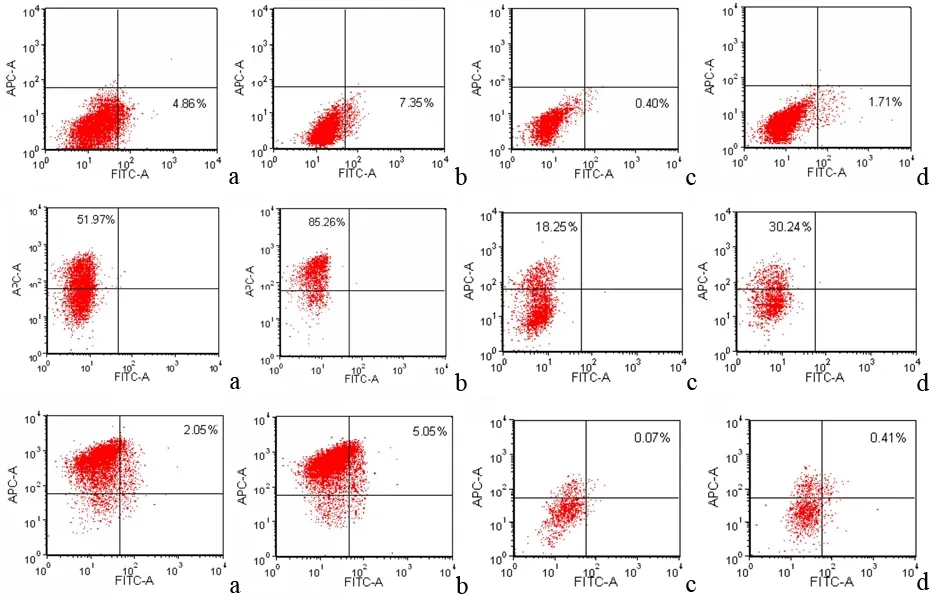
图5ASPC-1(a)、PANC1(b)、ASPC-1细胞球(c)、PANC1细胞球(d)中CD24+(上)、CD44+(中)和CD24+CD44+(下)的细胞
六、胰腺癌细胞球miR-590-3p的表达
ASPC-1、PANC1细胞球miR-590-3p表达分别是亲本细胞的4.67(4.21~5.15)和4.52(4.18~5.09)倍(图6,P值均<0.05)。

图6 癌细胞及其细胞球中miR-590-3p的表达(RT-PCR)
肿瘤干细胞的分选有干细胞标记物法、无血清悬浮培养法和侧群细胞分选法。本实验采用无血清悬浮培养法从ASPC-1和PANC1细胞系中成功培养出胰腺癌细胞球,并能连续传代。细胞球在分化过程中,导管上皮细胞的相关蛋白——CK18的表达随时间延长而逐渐增加;而在含血清培养基培养2周后,细胞球细胞又重新贴壁生长,恢复其亲本细胞系形态。
吉西他滨是细胞周期特异性抗肿瘤药物,主要杀伤S期的细胞,同时也阻断细胞由G1向S期过渡。本实验结果显示,胰腺癌球细胞多处于G0/G1期,吉西他滨对ASPC-1、PANC1细胞球的IC50明显高于亲本细胞的IC50,提示胰腺癌细胞球具有更高的耐药性。
Li等[4]通过表面标记物CD24、CD44和ESA分别从胰腺癌组织和PANC1细胞系中分选得到胰腺癌干细胞。实验表明,CD24+CD44+ESA+胰腺癌细胞是阴性细胞成瘤能力的100倍,且具有自我更新和分化的特性,可能是胰腺癌发生、发展、耐药和侵袭转移的核心细胞[5]。本实验获取的ASPC-1、PANC1细胞球中,CD24+CD44+细胞比例明显高于亲本细胞,表明细胞球具有干细胞特性的细胞亚群。
MicroRNA是一类普遍存在于动植物体内的非编码小分子RNA,是正常胚胎干细胞和肿瘤干细胞自我更新和分化特性维持的关键基因[6]。如let-7家族成员表达下降或缺失在乳腺癌干细胞的“干性”成瘤能力的维持中起至关重要的作用[7]。本实验结果显示,miR-590-3p在ASPC-1、PANC1细胞球细胞高表达,提示我们可以利用miR-590-3p作为一种新的分选胰腺癌干细胞的标准。
[1] Bellows CG, Aubin JE. Determination of numbers of osteoprogenitors present in isolated fetal rat calvaria cells in vitro. Dev Biol,1989,133:8-13.
[2] Tropepe V, Sibilia M, Ciruna BG, et al. Distinct neural stem cells proliferate in response to EGF and FGF in the developing mouse telencephalon. Dev Biol,1999,208:166-188.
[3] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-Delta Delta C(T) Method. Methods,2001,25:402-408.
[4] Li C, Heidt DG, Dalerba P, et al. Identification of pancreatic cancer stem cells. Cancer Res,2007,67:1030-1037.
[5] Gou S, Liu T, Wang C,et al. Establishment of clonal colony-forming assay for propagation of pancreatic cancer cells with stem cell properties. Pancreas,2007,34:429-435.
[6] Hatfield SD, Shcherbaca HR, Fischer KA, et al. Stem cell division is regulated by the microRNA pathway. Nature, 2005,435:828-833.
[7] Yu F,Yao H, Zhu P,et al. Let-7 regulates self renewal and tumorigenicity of breast cancer cells.Cell, 2007,131:1109-1123.
2010-08-27)
(本文编辑:吕芳萍)
ExpressionofmiR-590-3pinpancreaticcancerstemcells
GONGWei-qiang,QINRen-yi,WANGMin,TIANRui,ZHUFeng,SHICheng-jian,ZHANGZhi-fa,LIXu,HONGXiao-quan.
DepartmentofPancreatic-BiliarySurgery,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
QINRen-yi,Email:ryqin@tjh.tjmu.edu.cn
ObjectivesTo isolate cancer stem cells (CSCs) in pancreatic cancer cell lines PANC1 and ASPC-1 with serum-free medium(SFM), and to detect the expression of miR-590-3p in CSCs.MethodsPANC1 and ASPC-1 cells was cultured in serum-free medium. The monoclonal formation, differentiation and cell cycle, half inhibitory concentration (IC50), and the expression of the surface markers CD24+, CD44+were detected. qRT-PCR was used to detect the expression of miR-590-3p.ResultsAfter SFM culture, (0.94±0.53)% of ASPC-1 and (0.57±0.12)% PANC1 survived, and they formed spheres, and could continuously passage in vitro. Cell spheres differentiation recurred when serum was supplemented in SFM. The G0/G1stage proportion, CD24+, CD44+, CD24+CD44+cells proportion, IC50in ASPC-1 cell were (75.3±5.4)%, 0.96%~2.01%, 27.52%~34.47%, 0.35%~0.44% and (224.37±5.71)μg/ml, which were significantly higher than that those in parent cell [(43.7±3.8)%, 0.38%~0.42%, 17.65%~18.25%, 0.05%~0.08%, (11.43±2.10)μg/ml,P<0.05]. The G0/G1stage proportion, CD24+,CD44+,CD24+CD44+cells proportion, IC50in PANC1 cell were (80.1±4.7)%,5.31%~9.84%,72.05%~93.06%,4.91%~5.21%,(296.58±4.27)μg/ml, which were significantly higher than that those in parent cell [(46.1±5.3)%, 4.09%~4.97%, 47.71%~55.66%, 1.48%~2.63%, (26.17±3.81)μg/ml,P<0.05]. The expression of miR-590-3p in ASPC-1, PANC1 spheres was 4.67 and 4.52 times higher than the expression in parent cell lines.ConclusionsPancreatic cancer cell spheres can be isolated from ASPC-1, PANC1 by culture with SFM. miR-590-3p is up-regulated and may play an important role in regulating biological characteristics of pancreatic cancer stem cells.
Pancreatic neoplasms; Tumor stem cells; MicroRNAs; Cell spheres; Serum-free medium
10.3760/cma.j.issn.1674-1935.2011.04.006
国家自然科学基金面上项目(30772127)
430030 武汉,华中科技大学同济医学院附属同济医院胆胰外科(宫伟强、秦仁义、王敏、田锐、朱峰、石程剑、张志发、李旭、洪晓泉);潍坊市人民医院肝胆外科(宫伟强)
秦仁义,Email:ryqin@tjh.tjmu.edu.cn

