低能离子注入油脂高产菌株黏红酵母(RHODOTORULA GLUTINIS)的选育
李市场 刘红霞 朱朝阳 王冬冬
(河南科技大学食品与生物工程学院,洛阳 471003)
低能离子注入油脂高产菌株黏红酵母(RHODOTORULA GLUTINIS)的选育
李市场 刘红霞 朱朝阳 王冬冬
(河南科技大学食品与生物工程学院,洛阳 471003)
本文对油脂高产菌株选育过程中的筛选方法进行研究,采用苏丹黑B染色作为定性分析、酸热耦合超声波作为定量分析高产油脂菌株的筛选方法,通过低能离子注入黏红酵母(Rhodotorula glutinis)进行诱变,筛选油脂高产菌株。结果表明:获得了一株油脂高产菌株D30,产量比出发菌株提高33.05%,传代试验表明了D30的遗传稳定性良好,当发酵96 h,其油脂产量达3.10 g/L。另外,对D30发酵动力学进行了研究,当发酵时间为10 d时,其生物量为47.98 g/L(菌体湿重),油脂产量达到7.81 g/L。
黏红酵母 油脂 苏丹黑B染色 索氏抽提法 酸热耦合超声波
微生物油脂(microbial oil)又称单细胞油脂(single cell oil.SCO),即微生物(酵母、霉菌、细菌等)在一定条件下,以碳水化合物、碳氢化合物和普通油脂为碳、氮源,辅以无机盐生产的油脂和另一些有商品价值的脂质[1]。微生物油脂的研究和开发,不仅丰富了传统的油脂工业技术,而且是工业化生产油脂的一个重要途径。尤其是目前人口的快速增长,使得油脂需求量与自然资源严重短缺的矛盾日益尖锐,在此情况下,开辟新油源——微生物油脂更具有重要的理论和实际意义。
目前对微生物油脂的研究和开发主要集中在利用微生物生产高附加值的特殊用途功能性油脂方面。利用微生物可生产含各种类型脂肪酸油脂,有单不饱和脂肪酸,如棕榈油酸、油酸等;多不饱和脂肪酸,如亚油酸(LA)、亚麻酸(LNA)、花生四烯酸(AA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等;这些具有特殊功能和用途的功能性油脂在促进人类健康方面具有越来越重要的作用[2-3]。
微生物油脂具有很多优点,如微生物细胞增殖快,生产周期短,价值便宜,不受季节、气候变化的限制等。但是,微生物油脂也有其局限性,最明显的一点就是油脂的产量低。为了提高产量,本文利用低能离子注入选育高产油脂菌株。低能离子生物学是一门新兴边缘交叉学科,它集能量沉积、动量传递、质量沉积及电荷交换等效应[4],同时还具有高传能线密度值、集束性好、射程可控、能量沉积和质量沉积区域集中等特点,因此可以在损伤轻的情况下,获得更高的突变率和更宽的突变谱[5]。最近几年,低能离子生物学研究在农作物育种方面取得可喜的成果。陈宇等[6]用N+注入产红霉素菌,使红霉素的产量提高了20%以上。王纪等[7]用低能离子注入生产VD的麦角甾醇酵母,发酵水平提高了50%以上,而且遗传稳定。
1 材料和方法
1.1 试验仪器
LZD 900低能离子注入设备:中科院等离子物理研究所自主开发;LDZX-50KB立式压力蒸汽灭菌锅:上海申安医疗器械厂;BS223S电子天平(Max=220 g,d=0.001 g):北京赛多利斯仪器系统有限公司;HH-S恒温水浴锅:江苏省金坛市江通电子有限公司;TDL-50电动离心机:江苏省金坛市医疗仪器厂;SW-CJ-1F型单人双面净化工作台:苏州净化设备有限公司;HY-8数显大容量振荡器(摇床):江苏省金坛市医疗仪器厂;ECLIPSE TS100-F倒置显微镜:NIKON。
1.2 菌种
黏红酵母(Rhodotorula glutinis)31596:中国工业微生物菌种保藏中心(CICC)。
1.3 培养基
斜面培养基:加入2%琼脂和2%蛋白胨的10%麦芽汁,pH:5.8 ~ 6.2。
种子培养基:加入2%蛋白胨的10%麦芽汁,pH:5.8 ~ 6.2。
发酵培养基(g/L):葡萄糖:80;蛋白胨:1.8;(NH4)2SO4:1.11;KH2PO4:2.5;pH:5.8 ~ 6.2。
每个三角瓶加CaCO30.5 g单独灭菌,采用湿热灭菌法:115 ℃保温30 min,pH:5.8 ~ 6.2。
1.4 培养工艺
斜面培养:转接斜面后置于28℃的恒温培养箱中,培养48 h,4℃保藏;
种子培养:从斜面刮取3环菌体,接种于种子培养基中(250 mL三角烧瓶装液30 mL),28℃摇床转速为190 r/min培养20 h。
发酵培养:按10%(体积比)的接种量接种于发酵培养基中(装液量为250 mL三角瓶装液30 mL),28℃摇床转速为190 r/min培养96 h。
1.5 离子注入
1.5.1 菌悬液的制备
用适量的无菌水洗脱纯种黏红酵母斜面,利用梯度稀释法,稀释至一定的倍数,制成106cfu/mL的菌悬液。
1.5.2 离子束辐照设备
离子注入机是由中国科学院离子束生物工程重点实验室研究制备的LZD 900多功能离子注入机。本试验用10 keV的氮离子(N+)进行不同剂量的离子注入。靶室真空度为10-3Pa,以5 s脉冲式注入,间隔15 s。
1.5.3 离子注入处理
取0.1 mL已稀释到合适浓度的菌悬液均匀涂布于无菌平皿上,无菌风干后进行注入。在注入机上,能量选用 10 keV,以不同的剂量(20、40、60、80、100、120)×2.6×1013ions/cm2对黏红酵母单菌落进行注入;注入靶室的真空密度为10-3Pa。该试验把真空未接受离子注入的处理作为真空对照(设置放入真空靶室,以不经离子注入的样品为真空对照,以同样方法涂平皿,风干后不置于真空下的样品为基本对照)。
1.5.4 离子注入后的培养
离子注入后立即在超净工作台上用新鲜无菌水洗脱,进行适当的稀释,并涂布于分离平皿上,在28℃培养数小时,长出单菌落,计数并计算出相对存活率和突变率。
1.5.5 存活率的计算
在不同的诱变剂量下,接受离子注入诱变的菌株的存活单菌落数与不接受注入的对照菌株的存活单菌落数,两者的比值即为存活率。存活率=各处理计量的单菌落数/真空对照单菌落数×100%。
1.5.6 突变率的计算
挑选单菌落转接斜面,根据上述培养条件,进行摇瓶培养,同时以出发菌作为对照,考察菌株的产油脂能力。在诱变选育研究中,负突变率是指负突变菌株占全部被考察的菌株的比率,正突变率指正突变菌株占全部被考察菌株的比率。
1.5.7 筛选方法
1.5.7.1 苏丹黑 B 染色
苏丹黑B(苏丹黑B:0.3 g,70%乙醇100 mL)是一种能溶于脂肪的色素,而微生物油脂不被一般染料着色,但可被脂溶性染料如苏丹黑B着色,使脂肪粒呈现蓝黑色,从而可以定性判断油脂的含量[8]。
染色方法:
在洁净无油的载玻片中央加1滴培养好的发酵液,热固定,用苏丹黑B染色染色10 ~15 min,倾去染料,用滤纸吸干后用二甲苯清洗涂片,直至洗脱液无色为止。用0.5%番红水溶液复染1~2 min,水洗后吸干、镜检,细胞和菌丝呈红色,菌体内的脂肪颗粒呈蓝黑色[9]。
1.5.7.2 索氏抽提法
微生物油脂是脂类物质,能溶于乙醚等有机溶剂。利用微生物油脂能溶于脂溶性溶剂这一特性,用脂溶性溶剂将其提取出来。整个提取过程均在索氏提取器中进行,使用的脂溶性溶剂为乙醚[10]。
样品的准备:将诱变后的菌株按上述培养条件摇瓶培养96 h后,离心收集菌体,湿菌体在80~100℃电热鼓风干燥箱内烘干至恒重,取1张滤纸,做成滤纸斗,烘干后在电子天平上称重,然后将碾碎干菌体装在滤纸斗里称重,两质量之差即为干菌体的质量。
油脂的提取:把装有样品的滤纸斗放入提取管内,向提取管中缓缓倒入乙醚直至液面达到虹吸管上弯头部,正好虹吸1次;再向提取管中倒入乙醚,使其液面达到第1次液面的一半。将索氏提取仪整个装置放入恒温水浴锅中加热提取(水温65℃左右),提取24 h以上。
提取终点的判断:可将被回流的乙醚滴在滤纸上乙醚挥干后有无油迹来判断,无油迹证明脂肪已被抽提完全。
油重的确定:称取一个烘干至恒重的三角瓶,记做W1,将接收瓶中的液体转移至三角瓶中,乙醚完全挥净后,将三角瓶瓶放入烘箱中(100±5)℃烘干至恒重。烘干后易吸湿,因此称量要迅速,记做W2,油重W=W2-W1
1.5.7.3 酸热耦合超声波法
由于黏红酵母所产生的油脂属于胞内物质,要提取出油脂必须要对细胞进行破碎。酸热耦合超声波法的原理是:主要是利用盐酸对细胞壁中糖及蛋白质等成分的作用,对菌体细胞壁进行破壁处理,使原来结构紧密的细胞壁变得疏松,再经沸水浴及速冻处理使细胞壁进一步被破坏,然后用有机溶剂浸提细胞中的油脂[11-12]。
菌体的收集:将发酵液倒入50 mL的离心管中,4 000 r/min离心20 min,弃上清液,加入蒸馏水10 mL,搅拌均匀,4 000 r/min离心20 min,重复2次。
细胞破碎:向收集好的菌体加入10 mL 4 mol/L盐酸,振荡混匀,室温放置30 min后,沸水浴5 min,-20℃速冷10 min;然后使用超声波细胞破碎仪进一步破碎细胞,超声功率200 W,全程时间5 min,超声时间3 s,间歇时间4 s。
油脂的提取:破碎后的菌体悬液,加入2倍体积氯仿:甲醇(2∶1)提取液,充分振荡后,4 000 r/min离心25 min,取氯仿层,加等体积0.1%氯化钠溶液,混匀,4 000 r/min离心25 min,取氯仿层,挥发除去氯仿即得油脂。
2 结果与分析
2.1 离子注入
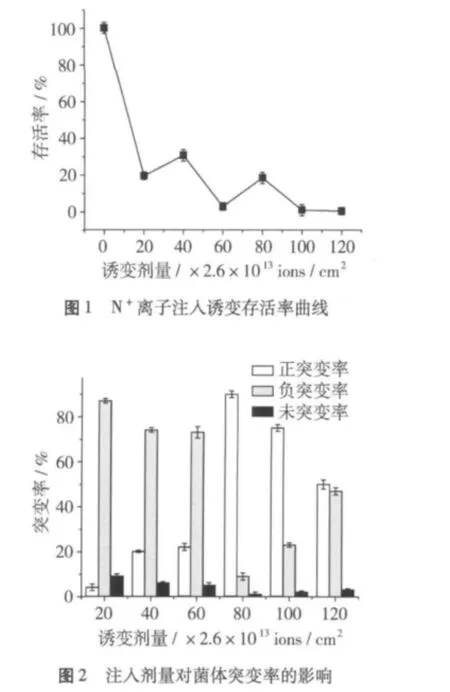
黏红酵母经过离子注入后,存活率和突变率如图1、图2所示。结果表明,存活曲线呈现先降后升的“波浪型”曲线。首先,存活率大幅度下降;在(20~60)×2.6×1013ions/cm2之间,存活率的下降趋于缓慢;在(60~80)×2.6×1013ions/cm2之间,存活率又有了小幅度的上升;当剂量大于80×2.6×1013ions/cm2时,存活率又开始下降。这种特异的存活曲线与传统的物理诱变或者化学诱变所呈现“肩型”或“直线型”的存活曲线相比有明显不同[13],其原因为离子注入除了具有能量沉积效应外,还有动量传递、质量沉积和电荷中和与交换等效应存在[14]。
突变株油脂产量相比出发菌株,产量低于出发菌株5%的视为负突变菌株;产量高于出发菌株5%的视为正突变菌株,在正负5%之间的为未突变。各剂量处理下的存活率和突变率为3次以上重复的平均值。由图 2可知,在(20、40、60)×2.6×1013ions/cm2的注入剂量下,负突变率要高于正突变率;在(80、100、120)×2.6 ×1013ions/cm2,正突变率要远比负突变率高,尤其是(80、100)×2.6 ×1013ions/cm2。因此,当注入能量为10 keV时,在既考虑到致死率,又考虑到正突变率情况下,注入剂量选择(80、100)×2.6×1013ions/cm2作为该菌株常用的离子注入参数。
2.2 筛选方法的比较。
经苏丹黑B染色法染色后,菌体内的脂肪粒呈现黑色,而菌体为红色,根据脂肪粒的大小可初步判断油脂含量的多少。通过苏丹黑B染色,经显微镜观察,定性筛选出5株较高产菌株,分别为:D30、B23、B13、C53、C32 如图3 所示。

图3 苏丹黑B染色法得到的5株油脂高产菌株
由图3可以看出,脂肪粒的大小顺序排列为:D30>B23>B13>C53>C32,根据苏丹黑B染色的原理,产油脂能力和脂肪粒的大小正相关,这5株黏红酵母产油脂的能力大小也应该为:D30>B23>B13>C53>C32。为了验证初筛过程的准确性,分别用索氏抽提法和酸热耦合超声波法对这5株高产菌株进行定量分析,结果见表1。

表1 酸热耦合超声波提取法和索氏抽提法对油重的影响 /g/L
由表1可以看出,两种定量分析均验证了所得油脂得率的高低与初筛中脂肪粒的大小相对应,油脂含量最高菌株为D30,这说明初筛方法准确而有效。
苏丹黑B染色对黏红酵母油脂进行定性观察简单快捷,不需要通过物理或者化学方法破碎细胞壁和进行常规的有机溶剂对油脂提取,能在短时间内从大量的诱变菌株中快速定性的筛选出高产菌株。
苏丹黑B染色法只能定性地观察菌株的产油脂能力,不能定量地检测油脂的含量。酸热耦合超声波法与索氏抽提法[15]相比,其操作简便、快速,样品需要量小并且不需任何处理,可作为定量检测的方法用于复筛。
因此,在后续的研究中,选用苏丹黑B染色法作为定性分析方法、酸热耦合超声波法作为定量检测方法,筛选出一株高产油脂黏红酵母(Rhodotorula glutinis)D30,发酵 96 h,产量高达 3.10 g/L,比出发菌株提高了33.05%(出发菌株为2.33 g/L)
2.3 菌种D30遗传稳定性试验。
为了确保筛选到的高产突变菌株的遗产稳定性,对诱变选育菌株D30进行传代试验,每代试验过程为:高产菌株自然分离→单菌落→斜面→种子瓶→摇瓶发酵,提取油脂产量。共传6代,每代均做3个平行样,结果见表2。由表2可以看出,从F1~F6代,油脂产量基本上维持在3.20 g/L左右,最高可达3.55 g/L,说明该菌株遗产稳定性较好。

表2 高产突变株遗传稳定性试验
2.4 高产突变株D30的发酵动力学分析
将经过诱变选育出的高产油脂菌株D30在上述培养条件下进行摇瓶发酵培养,每隔24 h观察一次,并取样检测绘制发酵曲线(每次试验抽取3个平行样品),结果见图4。
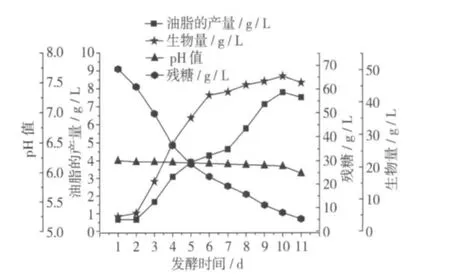
图4 D30的发酵曲线
由图4可以看出,由于发酵液中加入了适量的CaCO3用来平衡pH,整个培养过程中pH值基本稳定在5.8~6.2之间,而此pH正是黏红酵母菌株生长及合成油脂的最佳范围[16]。油脂的生产随着菌体的生长不断积累。1~2 d为其短暂的滞后期,很快进入快速生长期,油脂的积累与葡萄糖的消耗呈负相关性,2~6 d时,生物量快速的增加,此时为菌体生长阶段,6 d后菌体的增长进入稳定期,油脂开始大量的积累,耗糖速度也明显加速。在10 d时,菌体量和油脂产量达到最高,糖浓度已经降到最低,此时达到发酵终点,生物量为47.98 g/L(菌体湿重),油脂产量达到7.81 g/L。在发酵到10~11 d的时候,pH开始下降,油脂的产量和菌体生物量也开始下降,推测其原因可能为菌体开始自溶,葡萄糖即将耗尽,油脂被当做碳源重新利用。
3 结论
采用低能离子注入技术诱变黏红酵母,选育油脂高产菌株,筛选出一株高产突变株D30,其油脂产量达到3.10 g/L,比出发菌株提高了33.05%。确立了苏丹黑B染色法作为快速定性、酸热耦合超声波法作为定量筛选高产油脂菌株的方法;D30的发酵动力学研究表明,到达到发酵终点时,其生物量为47.98 g/L(菌体湿重),油脂产量达到 7.81 g/L。
[1]薛照辉,吴谋成.微生物油脂进展[J].山西食品工业,2002,6(2):10 -12
[2]Erwin J,Bloch K.Biosynthesis of unsaturated fatty acids in microorganisms[J].Science,1964,143:1006 - 1012
[3]Ward O P.Microbial production of long-chain polyunsaturat-ed fatty acid[J].Inform,1995,6:683 -688
[4]Kezhou Cai,Xuelan Liu,Yongjian Xu,et al.Damage effects induced by electrically generated negative air ions in Caenorhabditis elegans[J].Science of the total environment,2008,401:176 -183
[5]李市场,古绍斌,姚建铭,等.低能N+离子·紫外线和60Co–γ射线对黑曲霉产木聚糖酶的诱变效应[J].安徽农业科学,2007,35(17):5080 -5081,5116
[6]陈宇,汤建中.离子注入红霉素产生菌诱变高产菌株及其机理初步研究[J].中国抗生素杂志,1997,23(6):410-414
[7]王纪,薛小莉.离子注入麦角甾醇酵母选育及发酵工艺[J].微生物学杂志,1998,5(4):25 -28
[8]董欣荣,曹健,赵斌,等.几种真菌油脂的检测与提取[J].郑州工程学院学报,2002,123(1):14-18
[9]周德庆.微生物学实验手册[M].上海科学技术出版社,1983:32-34
[10]Singleton J A,Stikeleather L F.A solvent extractor system for the rapid extraction of lipids and trace bioactive micronutrients in oilseeds.[J].JAOCS,1999,76(12):1461 -1466
[11]王敏,李市场,刘红霞,等.响应面优化粘红酵母油脂提取工艺的研究[J].中国油脂,2010,35(4):7 -11
[12]孔凡敏,赵祥颖,田延军,等.酸热法提取酵母油脂条件的研究[J].中国酿造,2010,218(5):143 -146
[13]Vilaithong T,Yu L D,Alisi C,B,et al.A study of low - energy ion beam effects on outer plant cell structure for exogenous macromolecule transferring[J].Surface and Coatings Technology,2000,128 -129:133 -138
[14]宋道军,余增亮.离子注入微生物产生“马鞍型”曲线的可能作用机制[J].核技术,1999,22(3):129 -132
[15]Jinchao Shen,Xueguang Shao.A comparison of accelerated solvent extraction,Soxhlet extraction,and ultrasonic - assisted extraction for analysis of terpenoids and sterols in tobacco[J].Analytical and Bioanalytical Chemistry,2005,383:1003-1008
[16]张嘉,沈丹虹,郑晓冬.1株高产油脂酵母菌株的诱变选育及其发酵条件研究[J].浙江大学学报:农业与生命科学版,2009,35(5):497 -502.
Screening of Lipid-producing Strain Rhodotorula Glutinis by Low-energy Ion Implantation
Li Shichang Liu Hongxia Zhu Chaoyang Wang Dongdong
(Food and Bioengineering School,Henan University of Science and Technology,Luoyang 471003)
The paper studied the screening of strain with high - yield oil,and Sudan Black B staining and Acid-heating+Ultrasonic extraction were respectively chosen in qualitative and quantitative analysis methods to screen the strain with high-yield oil.Screening of lipid-producing strain Rhodotorula glutinis by low -energy ion implantation was studied as well.As a result,a high - yield mutant strain D30 was obtained,and it's lipid yield was increased by 33.05%than that of original.And it was found that genetic characteristics of D30 was rather stable through successive transfer of cultures,when fermentation time was 96 h and it's lipid yield increased to 3.10 g/L.Additionally,the fermentation characteristic of high-yield mutation strain D30 was studied,it's lipid yield and biomass respectively increased to 7.81 g/L and 47.98 g/L(wet strain),when fermentation time reached 10 d.
Rhodotorula glutinis,lipid,Sudan Black B staining,Soxhlet extraction,Acid - heating+Ultrasonic extraction
Q939.97
A
1003-0174(2011)08-0031-05
中国科学院等离子体物理研究所暨安徽省离子束生物工程学重点实验室开放基金(2008B004)
2010-10-28
李市场,男,1976年出生,博士,副教授,硕士生导师,微生物育种

