小凹蛋白-1在脐静脉内皮细胞CaR介导NO生成中的作用和机制*
王振焕, 胡清华, 钟 华, 邓峰美, 陈雄英, 孙志萍, 何 芳△
(1新疆地方与民族高发病教育部重点实验室,石河子大学医学院 2病理生理教研室,3医学机能实验中心,新疆 石河子 832002;4华中科技大学同济医学院病理生理学系,卫生部呼吸疾病重点实验室,湖北 武汉 430030)
小凹蛋白-1在脐静脉内皮细胞CaR介导NO生成中的作用和机制*
王振焕1,2, 胡清华3, 钟 华1,2, 邓峰美1,2, 陈雄英1,2, 孙志萍4, 何 芳1,2△
(1新疆地方与民族高发病教育部重点实验室,石河子大学医学院2病理生理教研室,3医学机能实验中心,新疆 石河子 832002;4华中科技大学同济医学院病理生理学系,卫生部呼吸疾病重点实验室,湖北 武汉 430030)
目的: 探讨小凹蛋白-1(Cav-1)在人脐静脉内皮细胞(HUVECs)钙敏感受体(CaR)介导NO生成中的作用和机制。方法利用转染技术将构建的Cav-1干扰质粒(Cav-1 shRNA)转染入HUVECs,随机分为:(1) 对照组;(2)CaR激动剂 (精胺)组;(3) 精胺+Ca2+组;(4) CaR负性变构调节剂(Calhex231)+精胺组;(5) Calhex231+精胺+Ca2+组;(6) 非律平(filipin)+精胺组;(7) filipin+精胺+ Ca2+组;(8)空质粒 (vehicle)+精胺+Ca2+组;(9) Cav-1 shRNA+精胺组;(10) Cav-1 shRNA+精胺+Ca2+组。Western blotting检测Cav-1 shRNA转染后HUVECs中CaR和Cav-1蛋白表达,通过NO荧光探针DAF-FM DA负载HUVECs检测细胞内NO的生成;并在提供充足底物的条件下检测细胞内皮型一氧化氮合酶(eNOS)活性。结果Cav-1干扰后,Cav-1蛋白表达降低,同时 CaR的膜蛋白表达降低(Plt;0.05),CaR的浆蛋白表达无变化(Pgt;0.05)。无论细胞外为零钙液或含钙液时,精胺(2 mmol/L)刺激CaR时均引起eNOS活性和NO含量增加(Plt;0.05),其中细胞外液为含钙液时,eNOS活性和NO含量增加较细胞外为零钙液时更明显(Plt;0.05),Calhex231 (1 μmol/L)可阻断(细胞外为零钙液)或降低(细胞外液为含钙液) 精胺介导的上述作用 (均Plt;0.05);此作用亦可被filipin (1.5 mg/L)或Cav-1基因沉默减弱(细胞外液为含钙液) (均Plt;0.05)。结论HUVECs中Cav-1对CaR介导的NO生成有促进作用,其机制可能与Cav-1影响CaR膜定位及对激动剂反应性有关。
小凹蛋白-1; 人脐静脉内皮细胞; 受体,钙敏感; 一氧化氮
生理条件下,NO主要源于内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)。细胞内钙离子浓度(intracellular Ca2+concentration,[Ca2+]i)增加为激活eNOS的重要条件;而小凹蛋白-1(caveolin-1,Cav-1)为eNOS的负调控蛋白,也是小凹(caveolae)表面标志蛋白和结构蛋白[1]。钙敏感受体(Ca2+-sensing receptor, CaR)为G蛋白偶联受体C家族的II型受体。该受体激活后经磷脂酶C (phospholipase C,PLC),增加胞内三磷酸肌醇(inositol 1,4,5-triphosphate,IP3)和二磷酸甘油(diphosphoglycerate,DAG),使[Ca2+]i升高,抑制甲状旁腺素的分泌,在维持全身钙稳态中发挥重要作用[2,3]。此外,CaR在影响NOS活性和NO生成中也发挥重要作用。人主动脉血管内皮细胞中功能性的CaR表达,在CaR激动剂精胺的刺激下,引起[Ca2+]i增加和NO生成[4,5]。如上所述,Ca2+为激活eNOS生成NO的重要辅助因子,而Cav-1是介导血管内皮细胞Ca2+内流重要的支架蛋白,又是eNOS的负调控蛋白。同时,文献已证实Cav-1为CaR的相互作用蛋白之一。在培养的人骨肉瘤细胞株(Saos-2),Cav-1与CaR相互结合,Cav-1可上调CaR的功能[6,7]。我们前期研究结果发现:人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)有CaR和Cav-1表达,两者共定位于膜上,Cav-1对CaR介导的钙内流有下调作用(资料已整理投稿)。那么,在HUVECs,CaR激活后是否具有介导NO生成作用,Cav-1对此有何种调节作用?有待证实。
本课题在前期研究基础上,以原代培养的HUVECs为研究对象,观察了CaR激动剂精胺(spermine)和负性变构调节剂Calhex231处理后HUVECs中eNOS活性和NO生成变化,以及Caveolae结构破坏剂非律平(filipin)或Cav-1基因沉默后对HUVECs中eNOS活性和NO生成影响,试图阐明Cav-1在CaR介导 NO生成中作用和机制,为心脑血管疾病防治提供新思路 。
材 料 和 方 法
1主要材料和试剂
1.1主要试剂 健康孕妇剖宫产的新鲜脐带(来自华中科技大学同济医学院附属同济医院,经伦理道德委员会批准和个人知情同意);胰酶(Sigma);M199 (Thermo);胎牛血清(Gibco); 细胞外基质(extracellular matrix,ECM,ScienCell);明胶(Sigma);精胺(Sigma);filipin (Sigma); Calhex231 (Sigma);Cav-1Ⅰ抗(Cell Signaling Technology);CaRⅠ抗(Affinity BioReagents,ABR);β-actin抗体(Santa Cruz);ECL发光试剂盒(Thermo);LipofectamineTM2000 (Invitrogen);Cav-1shRNA质粒(上海吉凯公司);G418 (Biosharp);NOS和NO检测试剂盒(Beyotime);去内毒素高纯度质粒抽提试剂盒(Omega)。
2方法
2.1HUVECs的培养与鉴定 依据本研究室以前的研究方法培养HUVECs,并对其进行细胞形态学及对细胞内Ⅷ因子进行免疫细胞化学染色来鉴定是否为HUVECs。取2-3代细胞用于实验。
2.2实验分组 按照以下方式分组处理,并持续灌流20 min,其中细胞外不含钙离子组和含钙离子组分别用Ca2+-free HBS溶液和含2 mmol/L Ca2+的HBS溶液将药物配制成不同浓度灌流:(1) 对照组;(2) spermine (2 mmol/L)组;(3) spermine + Ca2+组;(4) Calhex231 (1 μmol/L) + spermine组;(5) Calhex231+spermine+Ca2+组;(6) filipin (1.5 mg/L)+spermine组;(7) filipin+spermine+ Ca2+组;(8) 转染组:又分为空白对照组(Control 组),vehicle 组:转染空质粒, Cav-1 shRNA组:转染靶向Cav-1基因的siRNA,转染后的细胞加精胺(2 mmol/L)或精胺(2 mmol/L)+Ca2+(2 mmol/L),按照下述方法检测相应指标。
2.3质粒构建及转染 (1)质粒构建:由上海吉凯基因化学技术有限公司构建pGCsi-U6/Neo/DsRed重组质粒,该质粒经测序证实了克隆的RNAi打靶序列100%正确。(2)转染:待细胞生长至70%-90%融合度时进行转染,实验分为:未转染组即空白对照组(control组)、空质粒组(vehicle组)和特异性质粒转染组即实验组(Cav-1shRNA组),按照LipofectamineTM2000操作说明书进行。质粒经扩增和纯化,制备转染复合物,将该复合物与HUVECs混合,完成HUVECs转染。瞬时转染24-48 h后,荧光显微镜下观察到RFP,加入G418 (200 mg/L)进行筛选,待未表达抗性基因的细胞被杀死后,将G418 改为100 mg/L维持1周。
2.4Western blotting检测HUVECs Cav-1和CaR蛋白表达 弃去培养基,用预冷的PBS冲洗后,加入裂解液,提取细胞浆蛋白和膜蛋白,BCA 试剂测定蛋白含量,电泳,半干转,然后封闭,分别加入Cav-1 (1∶1 000)和CaR (1∶500)的Ⅰ抗,孵育过夜。第2 d用TBST洗膜3次各20 min,加入相应的Ⅱ抗 (1∶1 000)摇床上孵育1.5 h,TBST洗膜3次各20 min;ECL化学发光试剂显色,显影定影处理,获得实验结果。
2.5eNOS活性的测定 当接种于96孔板的HUVECs达80%融合时,把96孔板里的培养基吸尽后加入100 μL含有eNOS抑制剂的NOS的检测缓冲液,轻轻摇匀。再加入100 mL检测反应液,轻轻摇匀。37 ℃孵育箱中孵育30 min。直接把96孔板放到多功能酶标仪上,以没有细胞的孔为空白对照,激发波长为495 nm,发射波长为515 nm。eNOS活性用eNOS相对荧光强度(relative fluorescence unit,RFU)表示,其计算公式如下:eNOS相对活性=RFU已刺激-RFU抑制剂+已刺激)/(RFU未刺激-RFU抑制剂+未刺激)。
2.6NO含量的检测 按文献[5]进行,待细胞达80%融合时,按1∶2 000比例,用 DAF-FM DA荧光探针稀释液稀释DAF-FM DA,取200 μL稀释后的DAF-FM DA,37 ℃孵育细胞15 min后,用HBS溶液反复冲洗。将灌流槽放于倒置荧光显微镜(Olympus XI70)上,以没有细胞的孔为空白对照,同时用495 nm激发波长,515 nm发射波长,实时、逐时点检测刺激前后荧光的强弱,并通过IPA Software进行分析。NO含量用相对荧光强度RFU计算:NO含量=(测定孔曲线最高RFU -最低RFU)-(空白孔曲线最高RFU-最低RFU)。荧光强度应用Image-Pro Plus 5.0分析。在胞外液是零钙液时检测,发现细胞不能维持到预定的检测时间60 min,只能检测20 min,这与Jung等[7]的研究血管内皮细胞持续Ca2+内流是释放NO所必须的结果一致,因此图中不含钙离子的各组检测时间为20 min。各组分别减去空白对照组(背景荧光)的NO荧光强度值后为NO净荧光强度值,以此表示NO含量。
3统计学处理
结 果
1HUVECs的培养与鉴定
原代细胞放入培养箱后12 h,在倒置显微镜下观察融合的HUVECs呈典型的铺路石或鹅卵石样排列;对细胞内Ⅷ因子进行免疫细胞化学染色,95%以上的细胞呈阳性着色,证实细胞为HUVECs(资料未显示)。
2小凹结构破坏对HUVECs中Cav-1蛋白表达影响
同一代HUVECs分为4组:即对照组(control)、不同浓度加药组(1.5 mg/L、2 mg/L和2.5 mg/L filipin组),HUVECs经不同浓度filipin处理6 h后提取HUVECs的浆蛋白,采用Western blotting检测Cav-1蛋白表达。结果显示对照组、1.5 mg/L、2 mg/L及2.5 mg/L filipin组中Cav-1的蛋白含量相对值为1.56±0.01、1.53±0.01、1.49±0.01和1.57±0.02,各加药组与对照组相比,无显著差异(Pgt;0.05),见图1。
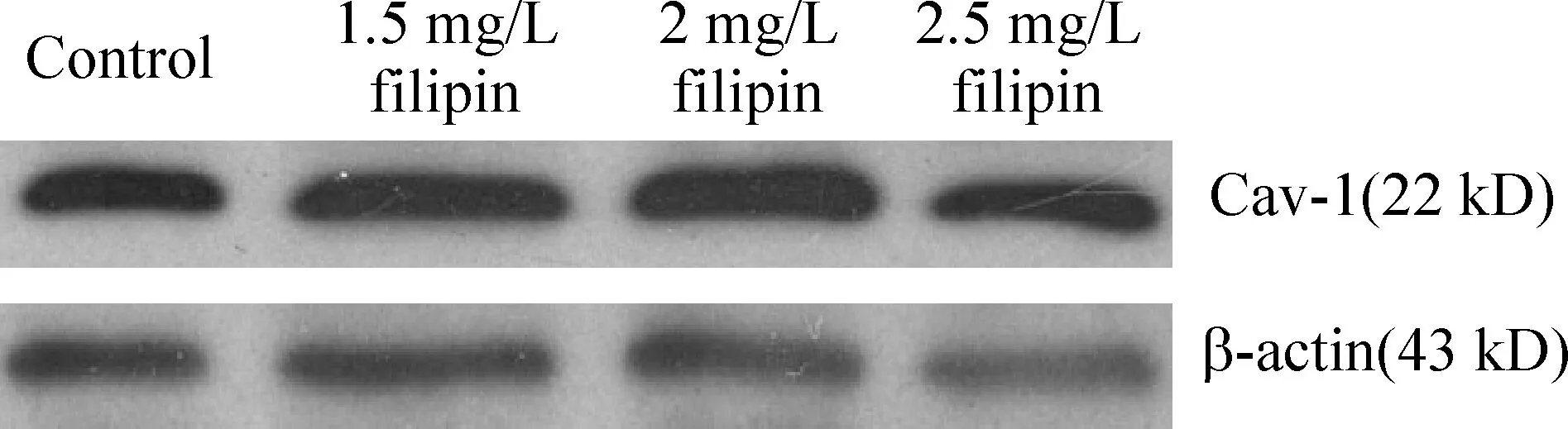
Figure 1.Effects of different concentrations of filipin on the expression of Cav-1 protein in HUVECs after 6-hour incubation±sE.n=3.
3Cav-1干扰后HUVECs中Cav-1和CaR蛋白表达
提取转染48 h、用G418 (200 mg/L)进行筛选7 d后HUVECs的浆蛋白和膜蛋白,与对照组比较,可见Cav-1 shRNA 组中Cav-1蛋白表达降低(抑制率为70%,Plt;0.05),vehicle 组Cav-1蛋白表达无明显变化(Pgt;0.05)。同时,Cav-1 shRNA 组中CaR的膜蛋白表达降低(抑制率为20%,Plt;0.05),CaR的浆蛋白表达无明显变化(Pgt;0.05), vehicle 组CaR的膜蛋白和浆蛋白表达均无明显变化(Pgt;0.05),见图2。
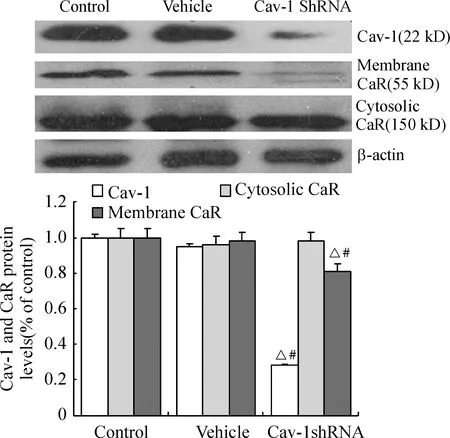
Figure 2.Effect of shRNA targeted to Cav-1 on Cav-1 and CaR protein expression in HUVECs detected by Western blotting±sE.n=3.△Plt; 0.05 vs control; #Plt; 0.05 vs vehicle.
4不同处理因素刺激下HUVECs内eNOS活性的变化
各组HUVECs培养48 h后加处理因素检测,与对照组相比,精胺组eNOS活性升高;与精胺组相比,精胺+Ca2+组eNOS活性进一步升高(Plt;0.05),Calhex231 +精胺组eNOS活性降低(Plt;0.05),filipin+精胺组及Cav-1 shRNA+精胺组eNOS活性均无显著差异(Pgt;0.05)。与精胺+ Ca2+组相比,Calhex231+精胺+Ca2+组、filipin+精胺+Ca2+组及Cav-1 shRNA+精胺+ Ca2+组eNOS活性均降低(Plt;0.05),而vehicle+精胺+Ca2+组eNOS活性无显著差异(Pgt;0.05),见图3。
5不同处理因素刺激下HUVECs内NO含量的变化
与对照组相比,精胺组NO荧光强度值增加;与精胺组相比,精胺+Ca2+组NO荧光强度值进一步增加(Plt;0.05), Calhex231+精胺组NO荧光强度值明显降低(Plt;0.05),filipin+精胺组及Cav-1 shRNA+精胺组细胞内NO荧光强度值无显著差异(Pgt;0.05)。与精胺+Ca2+组相比,Calhex231+精胺+Ca2+组、filipin+精胺+Ca2+组及Cav-1 shRNA+精胺+Ca2+组细胞内NO荧光强度值均明显降低(Plt;0.05),而vehicle+精胺+Ca2+组细胞内NO荧光强度值无显著差异(Pgt;0.05),见图4。
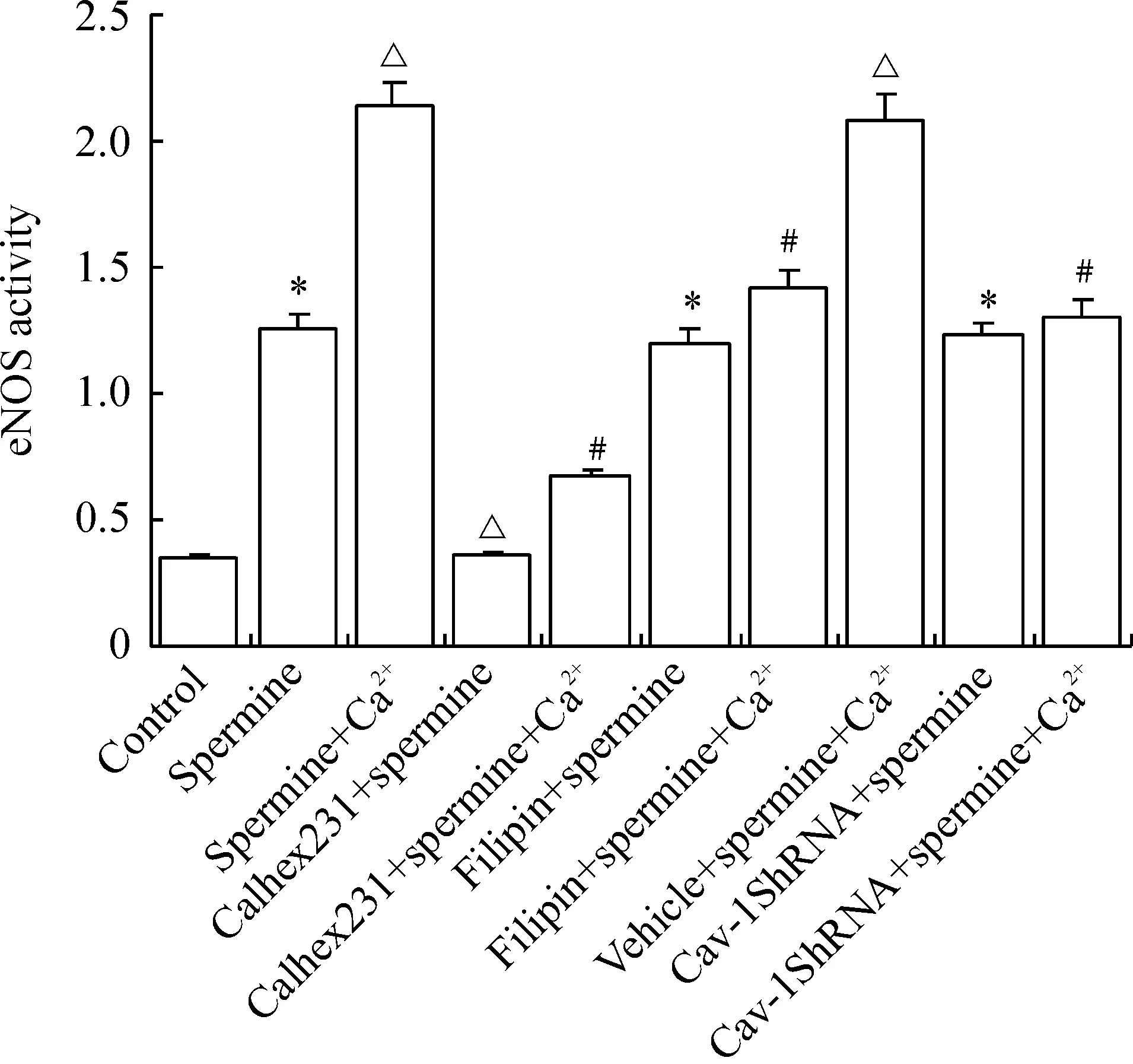
Figure 3.The changes of eNOS activity in HUVECs with different treatments.±sE.n=6.*Plt;0.05 vs control group;△Plt;0.05 vs spermine group; #Plt;0.05 vs spermine+Ca2+group.
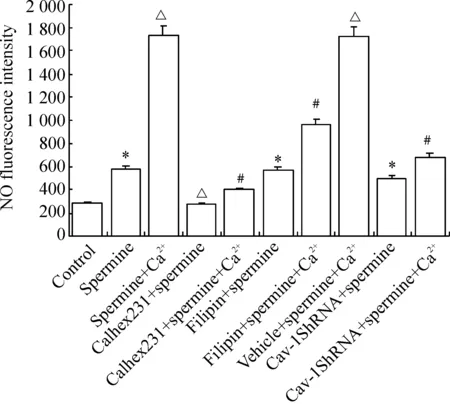
Figure 4.The changes of NO content in HUVECs after different treatments.±sE.n=6.*Plt;0.05 vs control group; △Plt;0.05 vs spermine group; #Plt;0.05 vs spermine+Ca2+group.
讨 论
随着研究的不断深入,发现CaR激活有影响NO生成的作用。在培养的睾丸间质细胞瘤模型中发现,当CaR 激动剂细胞外Ca2+浓度升高时,CaR激活上调iNOS mRNA和蛋白的表达,并导致 NO生成增加,对nNOS和eNOS无影响,在此过程中细胞内[Ca2+]i无变化[4]。Ziegelstein等[5]证实在人的主动脉血管内皮细胞中精胺激活CaR,经PLC增加胞内IP3使内钙释放导致[Ca2+]i增加和NO生成。本研究以HUVECs为研究对象,结果发现精胺刺激下HUVECs内eNOS的活性与NO含量增加,而CaR负性变购调节剂Calhex231处理完全阻断了精胺介导的上述作用,充分证明HUVECs内精胺刺激下HUVECs内eNOS的活性与NO含量增加由CaR介导。此外,Koyama等[8]研究表明外Ca2+内流是细胞内NO合成的先决条件 ,CaR介导的钙内流在eNOS的激活与NO生成中作用尚不清楚,故本研究亦在细胞外有钙的情况下(作为外钙来源,模拟CaR激活介导外钙内流),给予精胺刺激与单纯精胺刺激相比,HUVECs内eNOS的活性与NO含量进一步增加,Calhex231只能部分阻断此作用,这与我们前期按照上述同样方式处理后HUVECs[Ca2+]i变化趋势一致(资料已整理投稿)。该结果说明精胺激活CaR后引发胞内钙释放和激活的外钙内流共同参与了上述过程,而在细胞外有钙的情况下进一步加强了精胺介导的上述效应,证实了在HUVECs中CaR激活介导持续Ca2+内流亦是NO生成所必须的。我们的研究结果与上述在睾丸间质细胞瘤模型中的研究结果相比提示:在不同组织细胞经不同配体(Ca2+或精胺)激活CaR影响NO生成中的作用,激活了不同的NOS,对Ca2+依赖也有所不同。
已有研究表明CaR作用机制主要由G蛋白α亚基介导,但此信号转导机制作用并不能完全解释CaR的生物学效应,与CaR相互作用蛋白赋予CaR独特的信号转导特征[6],作为eNOS负调控蛋白的Cav-1是与CaR相互作用的蛋白之一。然而,并非在所有组织细胞都存在CaR和Cav-1相互作用,即使同一种与CaR相互作用蛋白定位于不同的组织细胞其调节功能也不同,如在培养的人骨肉瘤细胞株(Saos-2)和甲状旁腺细胞,CaR和Cav-1形成复合物并共定位于胞膜,在Saos-2,Cav-1可上调CaR激活引起的[Ca2+]i增加[7],而在甲状旁腺细胞使用一种胆固醇结合剂filipin破坏Caveolae的结构和功能,可阻断CaR诱导的 ERK1/2激活[9]。我们前期研究结果发现CaR和Cav-1两者共定位于HUVECs膜上,Cav-1对CaR介导的钙内流有下调作用,Cav-1对CaR介导的NO生成又有何种调节作用呢?结果发现Caveolae结构抑制剂filipin处理后对HUVECs中Cav-1蛋白没有影响,却抑制了有细胞外钙的情况下精胺激活CaR引发的eNOS活性与NO含量增加,对单独精胺刺激介导的上述效应无影响。为进一步证实此结果,实验中在保证RNAi特异性抑制Cav-1前提下,观察到与filipin处理一致的结果。该结果证实,在HUVECs,Cav-1对CaR经外钙内流介导的eNOS激活和NO生成有促进作用。同时,本研究发现Cav-1干扰后在Cav-1蛋白表达降低同时CaR膜蛋白表达也降低,CaR浆蛋白没有变化,推测Cav-1可能充当CaR膜定位及对激动剂反应实现各种不同功能的重要伴侣蛋白,由于filipin处理及Cav-1干扰后HUVECs的小凹结构破坏减少了CaR蛋白在膜上定位,使CaR对激动剂反应降低,抑制了spermine刺激CaR介导的上述效应。
通过上述一系列实验,我们证实在HUVECs中CaR有通过增加[Ca2+]i使NO生成增加的作用,此过程由CaR激活介导内钙释放、外钙内流共同参与,其中,外钙内流对促进释放NO生成尤为重要,Cav-1在CaR介导的NO生成过程中起着促进作用。
[1]Dudzinski DM,Michel T.Life history of eNOS: Partners and pathways[J].Cardiovasc Res,2007,75(2): 247-260.
[2]Brown EM,Gamba G,Riccardi D,et al.Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid[J].Nature,1993,366(6455): 575- 580.
[3]李光伟,邢文婧,郝静辉,等.钙敏感受体在缺氧诱导的大鼠肺动脉平滑肌细胞增殖中的作用[J].中国病理生理杂志,2010,26(12):2433-2437.
[4]Tfelt-Hansen J,Ferreira A,Yano S,et al.Calcium-sensing receptor activation induces nitric oxide production in H-500 Leydig cancer cells[J].Am J Physiol Endocrinol Metab,2005,288(6):E1206- E1213.
[5]Ziegelstein RC,Xiong Y,He C,et al.Expression of a functional extracellular calcium-sensing receptor in human aortic endothelial cells[J].Biochem Biophys Res Commun,2006,342(1):153-163.
[6]Huang C,Miller RT.The calcium-sensing receptor and its interacting proteins[J].J Cell Mol Med,2007,11(5):923-934.
[7]Jung SY,Kwak JO,Kim HW,et al.Calcium sensing receptor forms complex with and is up-regulated by caveolin-1 in cultured human osteosarcoma(Saos-2)cells[J].Exp Mol Med,2005,37(2):91-100.
[8]Koyama T,Kimura C,Park SJ,et al.Functional implications of Ca2+mobilizing properties for nitric oxide production in aortic endothelium[J].Life Sci,2002,72(4-5):511-520.
[9]Kifor O,Kifor I,Moore FD Jr,et al.Decreased expression of caveolin-1 and altered regulation of mitogen-activated protein kinase in cultured bovine parathyroid cells and human parathyroid adenomas[J].J Clin Endocrinol Metab,2003,88(9):4455-4464.
Roleofcaveolin-1inextracellularCa2+-sensingreceptor-mediatedNOgenerationinhumanumbilicalveinendothelialcells
WANG Zhen-huan1,2,HU Qing-hua3,ZHONG Hua1,2,DENG Feng-mei1,2,CHEN Xiong-ying1,2,SUN Zhi-ping4,HE Fang1,2
(1KeyLaboratoryofXinjiangEndemicandEthnicDiseases,MinistryofEducation,2DepartmentofPathophysiology,3CentreofMedicalFunctionalExperiments,MedicalCollegeofShiheziUniversity,Shihezi832002,China;4DepartmentofPathophysiology,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,KeyLaboratoryofRespiratoryDiseases,HealthMinistryofChina,Wuhan430030,China.E-mail:fangf2002shz@126.com)
AIM: To study the role of caveolin-1 (Cav-1) in extracellular Ca2+-sensing receptor (CaR)-induced production of nitric oxide (NO) in human umbilical vein endothelial cells (HUVECs).METHODSThe expression ofCav-1 gene in HUVECs was silenced by transfection of constructed Cav-1 short hairpin RNA (Cav-1 shRNA) interference plasmids.The HUVECs in second or third passage were divided into 10 groups: control group,spermine group,spermine+Ca2+group,Calhex231+spermine group,Calhex231+spermine+Ca2+group,filipin+spermine group,filipin+spermine+Ca2+group,vehicle+spermine+Ca2+group,Cav-1 shRNA+spermine group and Cav-1 shRNA+spermine+Ca2+group.The protein levels of Cav-1 and CaR in HUVECs were detected by Western blotting after transfection.The production of NO and the activity of endothelial nitric oxide synthase (eNOS) were determined using the fluorescent NO indicator,3-amino-4-methylamino-2’,7’-difluorofluorescein diacetate (DAF-FM DA).RESULTSThe protein expression of Cav-1 in HUVECs was decreased after transfected withCav-1 shRNA.Simultaneously,the CaR membrane protein was decreased,whereas CaR protein level in the cytosol was unaffected.Whether in the culture medium with or without Ca2+,the CaR agonist spermine at concentration of 2 mmol/L resulted in an increase in the activity of eNOS and the production of NO in HUVECs.In the presence of spermine,the production of NO and activity of eNOS in HUVECs were abolished (without Ca2+) or decreased (with Ca2+) after inhibition of CaR by a negative allosteric modulator Calhex231 (1 μmol/L,Plt;0.05).In the presence of Ca2+,the effect of spermine on the increase in the activity of eNOS and the production of NO in HUVECs was also attenuated after acute caveolae disruption with filipin (1.5 mg/L) or transfected withCav-1 shRNA (Plt;0.05).CONCLUSIONCaR-mediated production of NO in HUVECs might be promoted by the binding of Cav-1 to CaR.The mechanism is involved in the effect of Cav-1 on the localization of CaR at the plasma membrane,thus changing the responsibility of CaR.
Caveolin-1; Human umbilical vein endothelial cells; Receptors,calcium-sensing; Nitric oxide
1000-4718(2011)05-0934-05
R364.1+4
A
10.3969/j.issn.1000-4718.2011.05.019
2010-08-20
2011-03-14
国家自然科学基金资助项目(No.30860099)
△通讯作者 Tel: 0993-2057151;E-mail:fangf2002shz@126.com

