过氧亚硝酸阴离子供体通过蛋白激酶C途径抑制CA1区神经元延迟整流钾电流*
刘朝巍, 刘仕昌, 张 涛, 杨 卓△
(南开大学 1医学院生物活性材料教育部重点实验室,2生命科学学院,天津 300071)
过氧亚硝酸阴离子供体通过蛋白激酶C途径抑制CA1区神经元延迟整流钾电流*
刘朝巍1, 刘仕昌1, 张 涛2, 杨 卓1△
(南开大学1医学院生物活性材料教育部重点实验室,2生命科学学院,天津 300071)
目的: 过氧亚硝酸阴离子(ONOO-)是一种性质活泼的自由基,可引起强的氧化性损伤,介导了一氧化氮(NO)的大部分毒性作用。本研究探讨ONOO-对脑片海马神经元延迟整流钾电流(IK)和动作电位时程(APD)的影响及其作用机制。方法应用全细胞脑片膜片钳技术记录IK和动作电位。结果ONOO-供体SIN-1可抑制IK电流峰值,使其激活曲线向超极化方向移动,并可延长APD。脑片预处理PKC抑制剂chelerythrine (2.5 μmol/L)可抑制SIN-1对IK的作用。PKC激动剂PDBu (6 μmol/L)不仅加强而且模拟SIN-1对IK的影响。然而,鸟苷酸环化酶(GC)抑制剂ODQ对SIN-1的作用无影响。结论ONOO-可能通过PKC-IK-动作电位信号级联反应作用于海马神经元,并不依赖环磷鸟苷(cGMP)通路,这可能是ONOO-神经毒性的机制之一。
海马; 过氧亚硝酸; 延迟整流钾电流; 蛋白激酶C; 膜片钳术
一氧化氮(nitric oxide,NO)是一种非经典神经递质,具有信使和细胞毒性双重作用[1],可与超氧阴离子快速反应生成过氧亚硝酸阴离子(peroxynitrite,ONOO-)。ONOO-是一种性质活泼的自由基,可引起强氧化性损伤,介导了NO的大部分毒性作用。ONOO-可能是导致细胞损伤、能量耗竭和细胞死亡的重要因素。ONOO-可作为强氧化剂,作用于酶、蛋白质、脂质及DNA等大分子物质,产生细胞毒性作用,使细胞的代谢发生障碍及能量耗竭,导致细胞凋亡、损伤,甚至死亡。ONOO-参与多种神经系统疾病的病理过程,例如:阿尔茨海默病、脑缺血和癫痫等[2-4]。
钾通道是脑内分布最广、类型最多的一类离子通道,其中电压门控钾通道在调节神经元兴奋性等生理功能中起着十分重要的作用。延迟整流钾电流(delayed rectifier K+current,IK)是动作电位(action potential,AP)复极化过程的主要成分,影响AP的形状和时程[5]。细胞膜的离子通道是许多毒性物质的作用靶点,研究表明ONOO-可增加微动脉自发瞬时外向电流[6],并抑制人平滑肌的钙激活钾电流[7]和基底外侧的钾通道电流[8],氨氯吡咪敏感的钠电流[9]。我们前期的实验结果证实,ONOO-可以抑制海马神经元电压门控钠电流[10]。
蛋白激酶C(protein kinase C,PKC)和环磷鸟苷(cyclic guanosine monophosphate,cGMP)均可调节神经元IK[11,12]。电压门控钾通道的氨基酸序列存在许多PKC调节位点并可被cGMP信号通路调节。本研究主要通过研究ONOO-对海马神经元IK和AP的影响及其可能的调节机制,探讨ONOO-神经毒性的作用机制。
材 料 和 方 法
1材料
1.1动物 出生后14-18 d的雄性Wistar大鼠,购自中国医学科学院动物实验中心。
1.2试剂药品 SIN-1、MnTBAP、chelerythrine和PDBu购自Alexis。ODQ为Canmay产品。河豚毒素(anhydrotetrodotoxin 4-epitetrodotoxin,tetrodonic acid,TTX)为秦皇岛河北省水产科技开发公司产品。其余试剂为国产分析纯。
2方法
2.1脑片制备 实验动物用水合氯醛(400 mg/kg,ip)腹腔麻醉。待麻醉适度后,迅速断头、剪开颅骨取出全脑,置于备好的脑脊液中静置2 min。分离海马,使用振动切片机(Leica VT1 000M)将其切为厚度为400 μm的脑片。厚度较均匀的脑片移入30 ℃已通混合气的ACSF中,孵育1h以上备用。
2.2全细胞膜片钳记录 利用全细胞膜片钳技术记录大鼠脑片海马CA1区神经元IK。电极由PIP5型拉制仪(PIP5,HEKA)分两步拉制而成。充满电极内液后阻抗为2-6 MΩ。
将正置显微镜低倍镜的镜头选准所要记录脑片的位置,然后换成高倍镜。将高倍镜头浸入液体,适当调节焦距就可通过电荷耦合器件(charge-coupled device,CCD)摄像机在TV监视器屏幕上看到放大的细胞图像。为使细胞图像更清晰,用红外光代替普通光,其差分干涉对比度显微镜(differential inter-
ference contract,DIC)图像在黑白TV监视器屏幕上会更有立体感。选择表面光滑、形态饱满、轮廓分明、折光性好的锥体神经元。电极尖端与细胞膜形成高阻封接(大于1GΩ)后,负压破膜,使电极内液与细胞内液相通,形成全细胞状态,在电压钳下记录IK电流。信号采集频率:10 kHz;滤波频率:3 kHz。采样后数据由PULSE 10.0软件自动记录,存储于计算机硬盘内供分析。所有的实验均在室温(22-24 ℃)下进行。
2.3药物处理 SIN-1和ODQ溶解于二甲基亚砜(dimethyl sulfoxide,DMSO),配置成母液;MnTBAP、chelerythrine和PDBu溶解于人工脑脊液(artificial cerebrospinal fluid,ACSF)中。所有药物均在使用前用ACSF稀释,以备灌流使用,DMSO的终浓度小于0.1%。灌流速度约3-4 mL/min,灌流过程中持续通混合气(5% CO2和95% O2)以保证细胞外酸碱度稳定。ACSF(mmol/L):125 NaCl,25 NaHCO3,1.25 KCl,1.25 KH2PO4,1.5 MgCl2,2.0 CaCl2,16 glucose。记录K+电流电极内液成分(mmol/L):NaCl 5,KCl 144.4,MgCl21,EGTA 3,HEPES 10 (用10 mmol/L NaOH调至pH 7.3 );记录AP电极内液成分:NaCl 5,KCl 144.4,MgCl21,EGTA 3,HEPES 1。KOH调节pH至 7.2-7.3。
3数据学处理
结 果
1IK的分离
由于电压依赖性外向钾电流包括瞬时外向钾电流(transient outside potassium current,IA)和IK两种,且二者均可以在细胞膜受到去极化时激活,所以要记录到IK有必要先将IA分离出去。由于IA激活的电压大约在-60 mV,失活电压在-50 mV,而IK的激活电压在-50 mV或更高,所以可以根据两者不同的电压依赖性采用电压分离的方法得到较单纯的IK。如图1A所示,在-110 mV的前置脉冲电位(prepulse)后插入一段50 ms的-50 mV的中间电位(interpulse),然后再去极化到+60 mV,可以使IA几乎完全失活而记录到一个激活和失活都比较缓慢的外向电流,在此基础上,进一步用IK通道的特异性阻断剂四乙铵(tetraethylammonium,TEA)进行了验证,发现TEA可以剂量依赖地抑制该电流,30 mmol/L TEA可以完全抑制(数据未出示),说明我们所记录的就是IK。
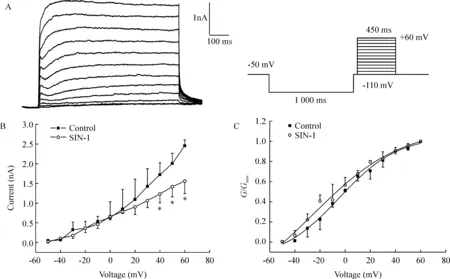
Figure 1.Effects of treatment with 500 μmol/L SIN-1 for 5 min on the I-V curves (B) and activation kinetics(C) of IK±s.n=6.*Plt;0.05 vs control.Currents were generated by applying depolarizing pulses,a 1 000-ms hyperpolarizing prepulse to -110 mV followed by interpluse in -50 mV for 50 ms and then step depolarized to potential from -50 to +60 mV for 450 ms with a 10 mV increment.The holding potential was -50 mV(A).
2ONOO-对IK的影响
SIN-1是ONOO-的供体,可同时产生NO和超氧阴离子。图2A显示SIN-1(10、500、1 000 μmol/L)可抑制IK,并呈现浓度依赖性。给予超氧化物歧化酶模拟剂MnTBAP(100 μmol/L)和SIN-1(500 μmol/L)对IK无明显影响,见图2A、B。结果表明SIN-1对IK的抑制是由ONOO-产生的,与超氧阴离子无关。
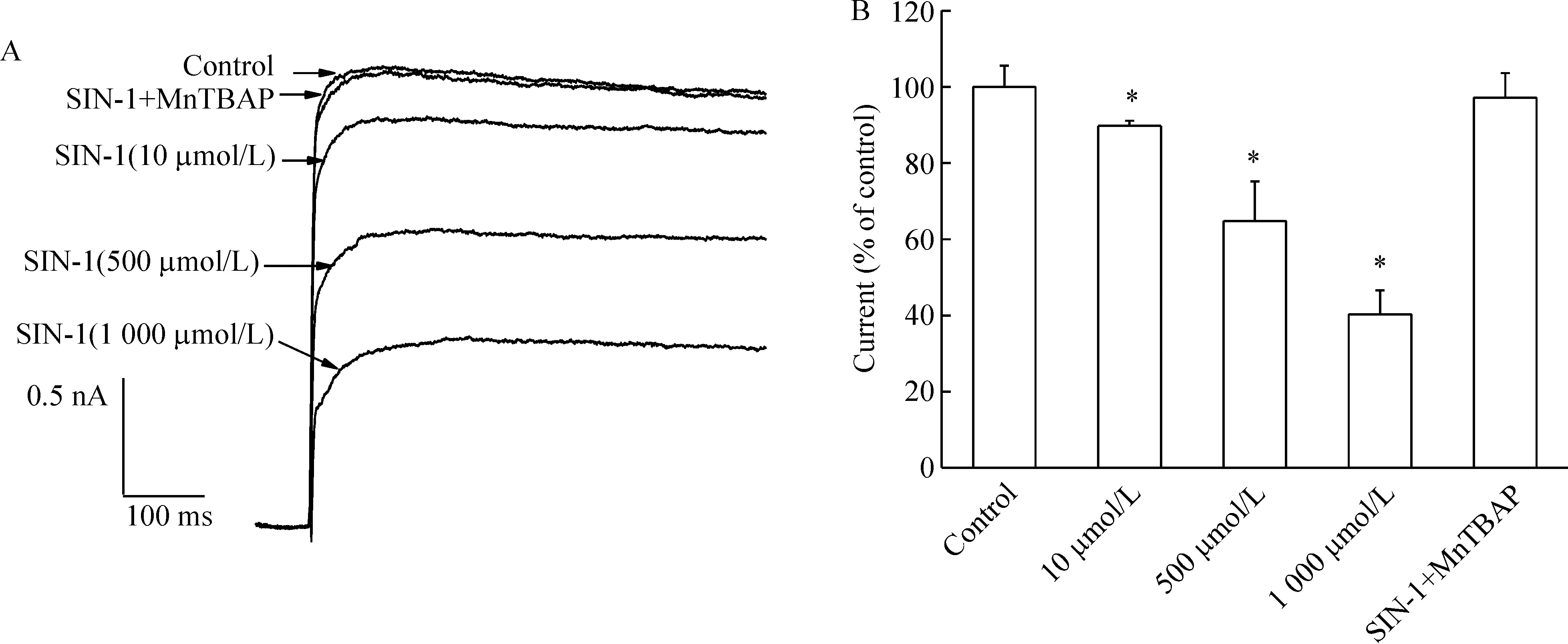
Figure 2.Effects of ONOO- on IK in hippocampal slices.Original current traces (A) and bar graph (B) showed the effects of SIN-1 at 10 μmol/L,500 μmol/L,and 1 000 μmol/L and co-treatment with 500 μmol/L SIN-1 and 100 μmol/L MnTBAP on the amplitude of IK.±s.n=8 .*Plt;0.05 vs control.
3ONOO-对IK的I-V曲线和激活动力学的影响
SIN-1可使IK的I-V曲线降低,见图1B,然而同时给予SIN-1和MnTBAP对IK的I-V曲线无显著影响(数据未出示)。利用公式G=I/(V-Vr)将电流值转换为电导值,其中G为电导,V为膜电位,Vr为翻转电位。以电导值与最大电导值的比值(G/Gmax)对应膜电位绘制出给药前后的激活曲线。所得曲线用Boltzmann方程G/Gmax=1-1/{1+exp[(V-Vh)]/k}进行拟合,式中G为电导,V为膜电位,Vh为半数激活电压,k为斜率因子。IK的激活曲线均呈S形。经拟合得出SIN-1给药前后IK的Vh分别为(44.9±3.4) mV 和(29.2±8.3) mV,(n=6,Plt;0.05),k值分别为23.2±3.4 和 33.0±4.5 (n=6,Plt;0.05)。说明ONOO-可使IK的激活曲线左移并改变其斜率因子,见图1C。
4SIN-1通过PKC途径抑制IK与鸟苷酸环化酶(guanylatecyclase,GC)途径无关
图3显示应用特异性的GC抑制剂ODQ对SIN-1诱导的IK的改变无显著影响(Pgt;0.05)。
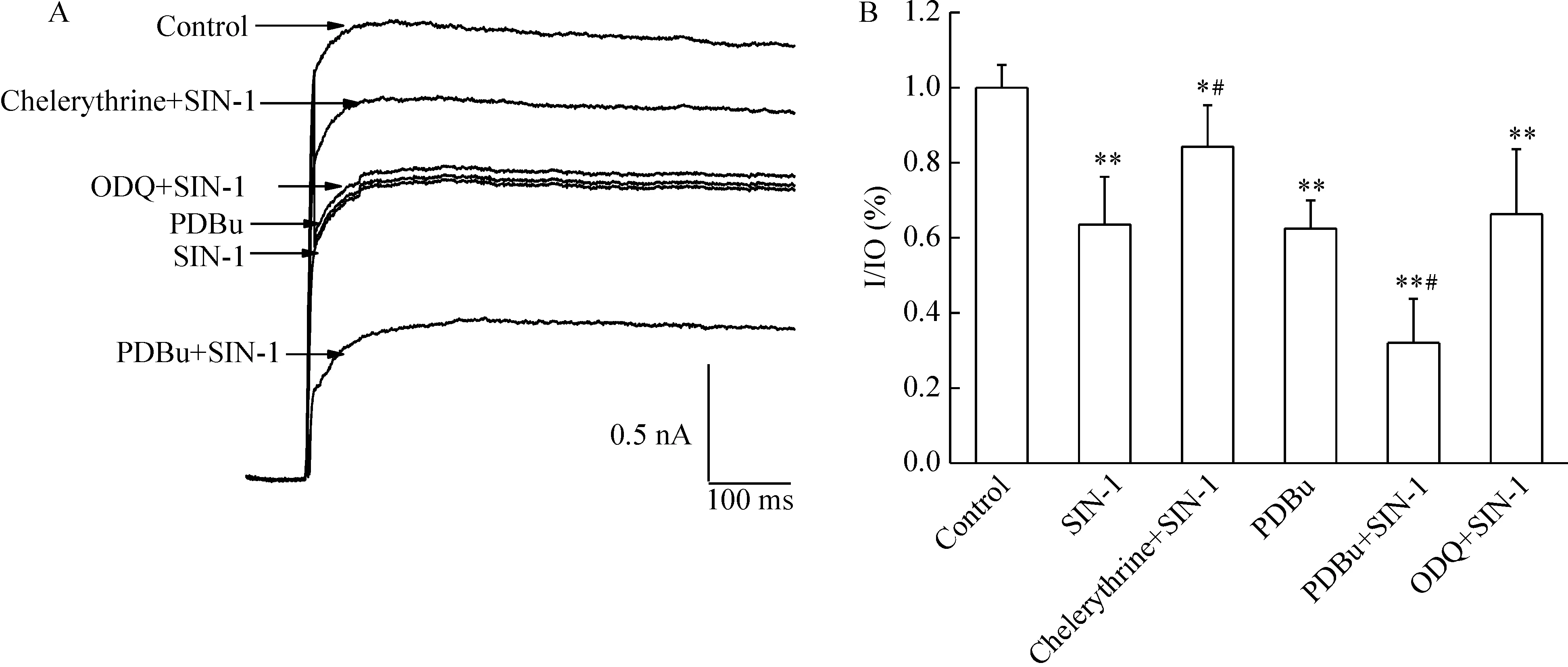
Figure 3.Activation of PKC-IK-AP (action potential) signaling cascades participated in the effect of ONOO- on IK of hippocampal neurons.A:original current traces showed ODQ had no effects on the action of SIN-1,but chelerythrine inhibited and PBDu strengthened the action of SIN-1;B:bar graph showed the summary variation of IK in the presence of 500 μmol/L SIN-1,chelerythrine and SIN-1,PDBu,PDBu and SIN-1,ODQ and SIN-1 .±s.n=6.*Plt;0.05,**Plt;0.01 vs control; #Plt;0.05 vs SIN-1.
PKC抑制剂chelerythrine (2.5 μmol/L)预处理脑片10 min,可抑制SIN-1对IK的作用。PKC激动剂PDBu(6 μmol/L)预处理脑片,SIN-1对IK的抑制作用增强(Plt;0.05)。另外,PDBu能模拟SIN-1对IK的抑制作用(Plt;0.05)。以上结果表明SIN-1可能通过PKC通路抑制IK,而与cGMP通路无关。
5ONOO-对AP的影响
用10 ms的去极化刺激诱发加药前后单个AP,见图4A。IK是AP复极化的主要成分。SIN-1可明显延长动作电位时程,见图4B。
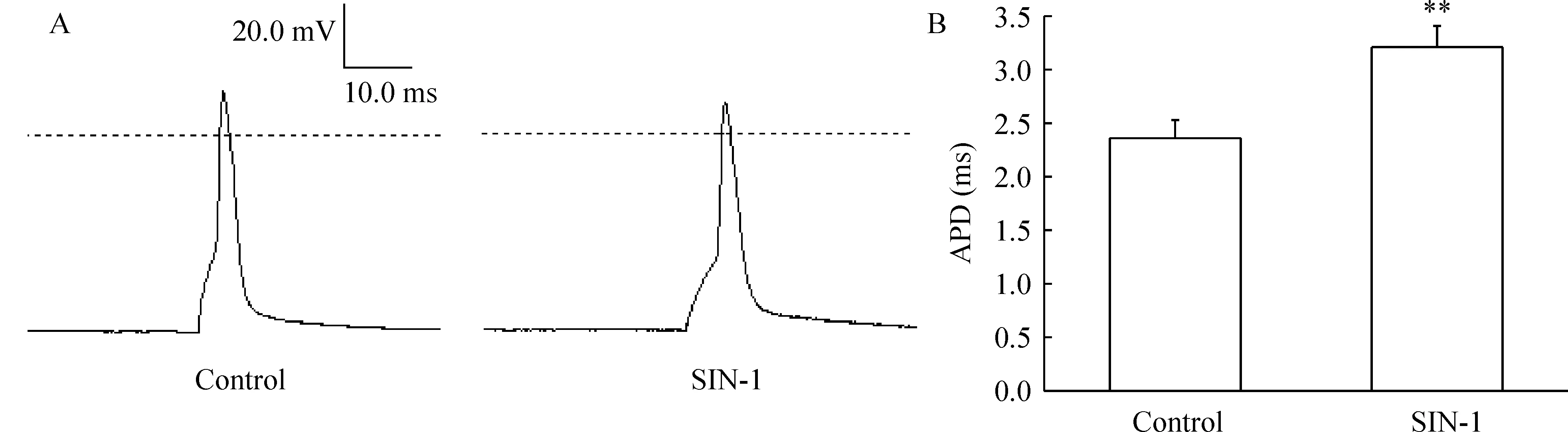
Figure 4.Effects of SIN-1 on action potential(AP) of hippocampal neurons.A:single AP was elicited using a 10 ms depolarizing current pulse in control group and treatment with 500 μmol/L SIN-1 for 5 min;B:bar graph showed the effect of 500 μmol/L SIN-1 on action potential duration(APD) in neurons .±s.n=8.**Plt;0.01 vs control.
讨 论
ONOO-在体内主要是由NO和超氧阴离子反应生成的,反应速率常数为6.7×109mol·L-1·s-1,接近于被动扩散的速度。ONOO-是较NO和超氧阴离子氧化作用更强、更广泛的氧化剂,参与了多种神经系统疾病的病理过程。SIN-1可同时产生超氧阴离子和NO,迅速结合生成ONOO-。本实验中,不同剂量的SIN-1可抑制IK,而SIN-1和MnTBAP共同作用时,IK无明显变化,表明ONOO-可抑制IK,且这种作用呈现剂量依赖性。
IK的改变可参与多种神经系统疾病的病理过程,如脑缺血、癫痫等。实验结果表明ONOO-抑制海马神经元IK,并使APD明显延长;IK的抑制剂TEA也可导致APD明显延长[13],提示ONOO-的毒性作用可能部分通过抑制IK从而影响AP。我们前期的实验结果证实ONOO-可抑制神经元AP的发放频率[10],既然IK是AP复极化的主要成份,是神经元兴奋性的决定因素之一,ONOO-对神经元兴奋性的影响可能部分是通过抑制IK实现的。
PKC和cGMP可调节多种离子通道。我们的实验结果表明PKC抑制剂chelerythrine (2.5 μmol/L)可抑制ONOO-对IK的作用。PKC激动剂PDBu (6 μmol/L)不仅加强而且模拟ONOO-的作用。这些结果表明PKC可能参与IK的抑制作用。而GC的抑制剂ODQ对SIN-1的作用无明显影响,提示cGMP信号通路与SIN-1对IK的作用无关。Malan等[14]的研究结果也表明cGMP不参与ONOO-对河豚猪心室肌细胞钙电流的作用。但我们的前期结果提示ONOO-通过GC途径抑制海马神经元电压门钠电流[10],这些不同的结果提示ONOO-对通道作用的调控机制可能具有特异性。
蛋白通道氨基酸残基的修饰可能参与ONOO-诱导的IK电流的改变。海马神经元电压门控钾通道对氧化损伤十分敏感[15]。ONOO-可氧化巯基从而抑制上皮细胞的钠通道电流[8]。另外ONOO-可导致蛋白质酪氨酸硝基化,有报道证实ONOO-可硝基化电压门控的钾通道蛋白,损害其功能[16]。
总之,我们的研究表明ONOO-通过PKC-IK-AP信号级联系统作用于海马神经元,并与cGMP通路无关,这可能是ONOO-的神经毒性的机制之一。
[1]刘惠卿,李文斌,李清君,等.脑缺血预处理对大鼠海马CA1区一氧化氮合酶活性和一氧化氮含量的影响[J].中国病理生理杂志,2006,22(1): 88-92.
[2]Moreira PI,Sayre LM,Zhu X,et al.Detection and localization of markers of oxidative stress byinsitumethods: application in the study of Alzheimer disease[J].Methods Mol Biol,2010,610: 419-434.
[3]Lim W,Kim JH,Gook E,et al.Inhibition of mitochondria-dependent apoptosis by 635-nm irradiation in sodium nitroprusside-treated SH-SY5Y cells[J].Free Radic Biol Med,2009,47(6):850-857.
[4]Chuang YC,Chen SD,Liou CW,et al.Contribution of nitric oxide,superoxide anion,and peroxynitrite to activation of mitochondrial apoptotic signaling in hippocampal CA3 subfield following experimental temporal lobe status epilepticus[J].Epilepsia,2009,50(4):731-746.
[5]Yellen G.The voltage-gated potassium channels and their relatives[J].Nature,2002,419 (6902): 35-42.
[6]Pan BX,Zhao GL,Huang XL,et al.Mobilization of intracellular calcium by peroxynitrite in arteriolar smooth muscle cells from rats[J].Redox Rep,2004,9 (1):49-55.
[7]Liu Y,Te rata K,Chai Q,et al.Peroxynitrite inhibits Ca2+-activated K+channel activity in smooth muscle of human coronary arterioles[J].Circ Res,2002,91 (11): 1070-1076.
[8]Lu M,Wang WH.Reaction of nitric oxide with superoxide inhibits basolateral K+channels in the rat CCD[J].Am J Physiol,1998,275(1 Pt1):C309-C316.
[9]DuVall MD,Zhu S,Fuller CM,et al.Peroxynitrite inhibits amiloride-sensitive Na+currents inXenopusoocytes expressing αβγ-rENaC[J].Am J Physiol,1998,274 (5):C1417-C1423.
[10]刘朝巍,韩大东,杨 茜,等.过氧亚硝酸阴离子通过鸟苷酸环化酶途径抑制钠电流影响海马神经元兴奋性[J].生物化学与生物物理进展,2008,35(2): 195-200.
[11]Yang B,Samson WK,Ferguson AV.Excitatory effects of orexin-A on nucleus tractus solitarius neurons are mediated by phospholipase C and protein kinase C[J].J Neurosci,2003,23(15):6215-6222.
[12]Han NL,Ye JS,Yu AC,et al.Differential mechanisms underlying the modulation of delayed-rectifier K+channel in mouse neocortical neurons by nitric oxide[J].J Neurophysiol,2006,95(4): 2167-2178.
[13]Suppes T.A late slow depolarization unmasked in the presence of tetraethylammonium in neonatal rat sympathetic neuronsinvitro[J].Brain Res,1984,293(2): 269-278.
[14]Malan D,Levi RC,Allotti G,et al.Cyclic AMP and cyclic GMP independent stimulation of ventricular calcium current by peroxynitrite donors in guinea pig myocytes[J].J Cell Physiol,2003,197 (2): 284-296.
[15]Archer S,Michelakis E.The mechanism(s) of hypoxic pulmonary vasoconstriction: potassium channels,redox O2sensors,and controversies[J].News Physiol Sci,2002,17: 131-137.
[16]Li H,Gutterman DD,Rusch NJ,et ak.Nitration and functional loss of voltage-gated K+channels in rat coronary microvessels exposed to high glucose[J].Diabetes,2004,53(9): 2436-2442.
PeroxynitritedonorinhibitsIKcurrentviaproteinkinaseCinhippocampalCA1neurons
LIU Zhao-wei1,LIU Shi-chang1,ZHANG Tao2,YANG Zhuo1
(1ThekeyLaboratoryofBioactiveMaterials,MinistryofEducation,SchoolofMedicine,2CollegeofLifeScience,NankaiUniversity,Tianjin300071,China.E-mail:zhuoyang@nankai.edu.cn)
AIM: To investigate the effects of peroxynitrite (ONOO-) on delayed rectifier potassium currents (IK) and action potential duration (APD).METHODSThe technique of whole cell patch-clamp was used in hippocampal slices andIKcurrent of the CA1 neurons was recorded.RESULTSSIN-1,an ONOO-donor,inhibited amplitudes ofIKcurrent and produced a hyperpolarizing shift in the activation-voltage curve.The application of SIN-1 resulted in a marked prolongation of APD.The responses of the CA1 neurons to ONOO-were inhibited by 2.5 μmol/L chelerythrine,an inhibitor of protein kinase C (PKC).The PKC activator PDBu (6 μmol/L) did not enhance but mimicked the effects.However,the guanylate cyclase inhibitor ODQ did not block the effects of ONOO-.CONCLUSIONThe effects of ONOO-on hippocampal neurons are mediated through activation of the signaling cascades of PKC-IK-action potential and are independent of cyclic guanosine monophosphate pathway,indicating the underlying mechanism related to neurotoxicity of ONOO-.
Hippocampus; Peroxynitrous acid; Delayed rectifier potassium currents; Protein kinase C; Patch-clamp techniques
1000-4718(2011)05-0900-05
R322.81
A
10.3969/j.issn.1000-4718.2011.05.013
2010-10-25
2011-03-09
国家自然科学基金青年基金资助项目(No.31000509);天津市应用基础与前沿技术研究计划重点项目(No.10JCZDJC19100)
△通讯作者 Tel:022-23504364;E-mail:zhuoyang@nankai.edu.cn

