修治附子在吗啡诱导的大鼠条件性位置偏爱上的作用*
吴贵云, 黄文起, 舒海华△, 张 辉, 陈 珊, 周 军
(中山大学附属第一医院1麻醉科,2口腔科 广东 广州 510080)
修治附子在吗啡诱导的大鼠条件性位置偏爱上的作用*
吴贵云1, 黄文起1, 舒海华1△, 张 辉1, 陈 珊2, 周 军1
(中山大学附属第一医院1麻醉科,2口腔科 广东 广州 510080)
目的: 探讨修治附子(PAT)在吗啡诱导的大鼠条件性位置偏爱(CPP)模型上的作用及其机制。方法(1)40只SD大鼠分为5组(n=8):生理盐水组、吗啡组、吗啡+PAT处理1、2和3组。除生理盐水组外,其余4组连续8 d隔天交替皮下注射吗啡5 mg/kg或生理盐水建立CPP模型,并同时每日分别以蒸馏水或PAT(0.3或1.0或3.0g/kg)灌胃。(2)其余32只SD大鼠分为4组(n=8):吗啡组、nor-BNI(kappa受体拮抗剂)+吗啡组、吗啡+PAT组和nor-BNI+吗啡+PAT组。4组大鼠均采用上述方法建立CPP模型。各组大鼠均于吗啡注射前120 min皮下注射生理盐水或nor-BNI(5 mg/kg),PAT处理组每日PAT 3.0 g/kg灌胃,其余2组以蒸馏水灌胃。各组大鼠均于CPP训练前和训练后测定CPP值,训练后测定CPP值后取大鼠脑伏隔核并采用放射免疫法检测其所含强啡肽浓度。结果(1)经CPP训练后,吗啡诱导引起了CPP值升高。(2)1.0或 3.0 g/kg的PAT剂量相关地降低了吗啡诱导引起的CPP升高(Plt;0.05)。(3)nor-BNI完全拮抗了PAT(3.0 g/kg)对吗啡CPP形成的抑制(Plt;0.05)。(4)PAT处理组大鼠脑伏隔核强啡肽的浓度比吗啡对照组高(Plt;0.05),也呈剂量相关。结论PAT剂量相关地抑制吗啡诱导的CPP形成,具有抗成瘾作用,其抗成瘾作用可能与大鼠脑伏隔核强啡肽的浓度增加,从而激动kappa受体有关。
修治附子; 吗啡; 条件性位置偏爱; 受体,阿片样,kappa; 强啡肽类
吗啡(morphine,Mor)广泛应用于各种急慢性疼痛[1],然而长期反复使用可引起治疗个体的身体和心理依赖,导致成瘾[2,3]。近年的研究发现强啡肽(dynorphin)/kappa阿片样受体(kappa opioid receptor,KOR)系统具有调节mu阿片样受体介导药物的成瘾作用[2,4]。修治附子(processedAconitituber,PAT)是生附子经过湿热处理减毒后,临床治疗慢性难治性疼痛的一种中药制剂[5-7]。我们早期的研究发现PAT可以通过增加强啡肽的释放,间接激动kappa受体而产生抑制吗啡耐受的作用[6]。因此,我们假设PAT具有抑制吗啡诱导奖赏效应的作用。自Katz等[8]1978年首次将条件性位置偏爱(conditioned place preference,CPP)用于阿片类物质奖赏效应的评定以来,具有药物相关环境暗示特征的CPP模型就成为研究药物滥用的最常用动物模型。本文拟用大鼠 CPP模型,来验证PAT是否具有抑制吗啡诱导的成瘾作用及其可能机制。
材 料 和 方 法
1动物和试剂
72只SPF级 SD雄性大鼠,2月龄,实验开始前体重(300±20)g,由中山大学医学院动物中心提供。分笼饲养,自由进食、饮水,实验前在饲养环境适应4d。PAT购自Tsumura(批号为C33591);吗啡购自东北制药集团沈阳第一有限公司(批号为080707-2);kappa受体拮抗剂nor-binaltorphimine(nor-BNI,10 mg/支)购自Sigma;强啡肽A1-13免疫活性物质(ir-dynA1-13)的放射免疫测定药盒由第二军医大学神经生物学教研室提供。
2实验装置
大鼠CPP训练测试箱购自Med Associates(ENV-013)。装置由PVC材料构成的黑、灰、白三室系统。黑、白两室大小均为长27.9 cm×宽 21.0 cm×高20.9 cm。黑室底部为不锈钢栅栏 (直径 4.8 mm,间距1.6 cm),白室底部为不锈钢网 (1.3 cm×1.3 cm)。灰色室大小为长 12.1 cm×宽21.0 cm×高 20.9 cm,底面灰色、光滑。灰箱位于黑、白室之间,通过一个大小为10 cm×10 cm的穿梭门与两箱相连,大鼠可以在三室之间自由穿梭,用于CPP测试,大鼠进出各箱的情况由位于装置两侧壁上的15对等距红外发光二极管监测,活动信号传送到计算机,通过MED-PC软件(Med Associates)收集记录。预实验表明,在此装置中大鼠对黑、白室没有明显天然偏爱。穿梭门内可放入隔离板将其自身封闭,使三箱隔离互不相连,以进行CPP训练。CPP值的计算方法为伴药箱减去非伴药箱停留的时间差。
3CPP训练及检测
3.1PAT在吗啡诱导的大鼠CPP上的作用 40只雄性SD大鼠随机分为5组(n=8):生理盐水对照组(saline+water组)、吗啡组(Mor+water组)和吗啡+PAT处理1组(Mor+PAT 0.3)、2组(Mor+ PAT 1.0)和3组(Mor+PAT 3.0)。除saline+water组每天皮下注射生理盐水外,其余4组均按下述CPP建立方案隔天交替皮下注射吗啡(5mg/kg)或生理盐水,注射完毕后, Mor+PAT 1-3组分别每天以PAT 0.3、1.0和3.0g/kg灌胃,saline+water组和Mor+water组均给予蒸馏水灌胃。皮下注射的生理盐水和吗啡的容量均为1 mL/kg,灌胃的蒸馏水和PAT容量均为10 mL/kg。实验采用均衡设计,每组大鼠按顺序编号,单号大鼠以黑室作为伴药室,双号大鼠以白室作为伴药室。CPP训练及检测在每天同一时段进行(9: 00-13: 00)。CPP建立方案共10 d,分为3个阶段:(1)训练前阶段(pre-conditioning),时间为d 0,抽出双侧CPP间隔板,将大鼠放入中间灰箱中,任其自由穿梭于黑、灰、白三箱15 min,检测其自由进出各箱的停留时间,测量大鼠CPP基础值。(2)CPP训练阶段(place conditioning training),时间为d1-8,双侧插入隔板封闭穿梭门,除生理盐水组外的各组大鼠均于单数日(d1、d3、d5、d7)皮下注射吗啡,待灌胃完毕后立即将大鼠放入伴药箱中停留45 min;在双数日(d2、d4、d6、d8)各组大鼠皮下注射同体积生理盐水,待灌胃完毕后立即将大鼠放入非伴药箱中停留45 min。(3)训练后阶段(post-conditioning),时间为d9,抽出 CPP双侧的隔板,将大鼠从中间灰箱放入,任其在各箱间自由穿梭15 min,测定大鼠 CPP值。
3.2Nor-BNI在PAT抑制吗啡成瘾上的作用 32只雄性SD大鼠分为4组(n=8):吗啡对照组(saline+Mor+water组)、nor-BNI+吗啡组(nor-BNI+Mor+water组)、吗啡+PAT处理组(saline+Mor+ PAT 3.0组)和nor-BNI+吗啡+PAT处理组(nor-BNI+Mor+ PAT 3.0组)。Nor-BNI+Mor +water组和nor-BNI+Mor+PAT 3.0组大鼠均于吗啡注射前120 min行nor-BNI(5mg/kg)注射(单数日)或生理盐水(双数日),其余2组大鼠均每天在相同时点皮下注射生理盐水;120 min后,4组大鼠均用上述3.1的方法在单数日皮下注射吗啡,双数日皮下注射生理盐水;之后saline+Mor+PAT 3.0组和nor-BNI+Mor+PAT 3.0组均每天以PAT 3.0 g/kg灌胃,其余2组每天蒸馏水灌胃,上述注射和灌胃容量同3.1。CPP建立和检测方案也同3.1。
4强啡肽A1-13含量的检测
预实验表明未经训练的同品的SD大鼠伏隔核内强啡肽浓度无显著差异。3.1和3.2的SD大鼠在训练后第9 d在CPP测试完毕后,用2%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,在显微手术操作台上迅速取脑剥离伏隔核,置于4 ℃环境中,加入300 μL的裂解液匀浆并离心1 h,吸取上清液,置于-80 ℃冰箱待测。取材完毕,将标本的上清液置于聚苯乙烯放射免疫测定管中,加入强啡肽A1-13抗血清100 μL、[125I]-强啡肽50 μL,约12 000 counts/min后加入PELH缓冲液,使总量补充为500 μL。4 ℃下孵育24 h后,每管加入1∶4羊抗兔丙种球蛋白血清50μL,继续孵育24 h,之后离心吸出上清液,用γ计数器测定沉淀物的每分钟脉冲数,计算出各管的B/B0百分值。根据同批实验所作标准曲线,查出各样品ir-dynA1-13的含量,再换算成每克脑组织湿重伏隔核ir-dynA1-13的含量的pg数。
5统计学处理
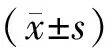
结 果
1CPP检测结果
1.1PAT抑制吗啡诱导的CPP形成 训练前各组大鼠CPP值无显著差异(Pgt;0.05)。Saline+water组训练后的CPP与训练前相比无显著差异(Pgt;0.05),提示生理盐水不会诱导CPP形成;Mor+water组训练后的CPP值比训练前明显升高(Plt;0.05),提示吗啡诱导的大鼠CPP模型建立是成功的。Mor+PAT 1.0组和Mor+PAT 3.0组训练后的CPP值比Mor+water组和Mor+PAT 0.3组明显降低(Plt;0.05),且3.0 g/kg PAT组训练后的CPP值几乎接近于训练前的CPP值(Pgt;0.05),提示PAT剂量相关地抑制吗啡诱导的CPP形成,见表1。
表1 口服PAT对吗啡诱导的CPP值的影响
1.2Nor-BNI完全逆转PAT对吗啡CPP形成的抑制作用 训练前各组大鼠CPP值无显著差异(Pgt;0.05)。Saline+Mor+water组训练后的CPP值比训练前明显升高(Plt;0.05)。Saline+Mor+PAT 3.0组训练后的CPP值比吗啡组明显降低(Plt;0.05),且与训练前相比无显著差异(Pgt;0.05)。然而,当吗啡注射前2 h给予nor-BNI,即nor-BNI+Mor+PAT 3.0组训练后的CPP值比saline+Mor+PAT 3.0组明显升高(Plt;0.05),且与saline+Mor+water组相比无显著差异(Pgt;0.05),提示Nor-BNI完全拮抗了PAT对吗啡CPP形成的抑制作用。Nor-BNI+Mor+water组训练后的CPP值与saline+Mor+water组相比无显著差异(Pgt;0.05),提示nor-BNI本身对吗啡诱导的CPP形成没有影响,见表2。
表2 Nor-BNI对PAT抑制吗啡CPP形成的影响
2训练后大鼠脑伏隔核内强啡肽浓度的变化
没有给拮抗剂nor-BNI时,训练后大鼠脑伏隔核内强啡肽浓度见表3。与saline+water组相比,Mor+water组伏隔核内强啡肽浓度升高,但是没有显著差异。与saline+water组和Mor+water组相比,Mor+PAT 1.0 组和Mor+PAT 3.0组大鼠脑伏隔核内强啡肽浓度明显升高(Plt;0.05),Mor+PAT 3.0组比Mor+PAT 1.0 组组高(Plt;0.05),且Mor+PAT 2.0组和Mor+PAT 3.0组均比Mor+PAT 0.3组高(Plt;0.05),提示PAT剂量相关地升高了大鼠脑伏隔核内强啡肽的浓度。给予拮抗剂nor-BNI,训练后伏隔核内强啡肽浓度见表4。Saline+Mor+water组和nor-BNI+Mor +water组大鼠脑伏隔核内强啡肽的浓度无显著差异(Pgt;0.05)。Saline+Mor+PAT 3.0组和nor-BNI+Mor+PAT 3.0组相比强啡肽浓度也无显著差异(Pgt;0.05),PAT处理组伏隔核内强啡肽浓度均比非PAT处理组高(Plt;0.05)。这些结果提示口服PAT增加了大鼠脑伏隔核内强啡肽浓度,而kappa受体拮抗剂nor-BNI本身并不影响强啡肽浓度的变化,nor-BNI拮抗PAT的抗成瘾作用可能是通过拮抗强啡肽对kappa受体的激动作用而产生的。
表3 口服PAT对吗啡诱导的CPP训练后大鼠脑伏隔核内强啡肽浓度的影响
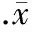
表4 Nor-BNI对PAT在吗啡CPP模型大鼠脑伏隔核内强啡肽浓度的影响
讨 论
桂枝加术附汤、牛车肾气丸等在临床上常用于治疗如糖尿病性神经痛等的慢性疼痛,附子是这些中成药中的重要组成生药。经过湿热处理减毒后的单剂PAT也被用于治疗各种慢性疼痛,其效果良好并且没有明显的副作用[7,9,10]。动物实验发现,PAT具有镇痛、抑制吗啡耐受等作用[6,11],其作用可能通过促进内源性强啡肽的释放,从而间接激动kappa受体有关[5,12]。近年来的研究[2,3]表明强啡肽/KOR系统参与了吗啡成瘾作用的调控,并且激动KOR具有抑制吗啡成瘾的作用。本研究证实了PAT在吗啡成瘾上的效果,这种作用可能与大鼠脑伏隔核内强啡肽浓度增加,从而激动KOR有关。
对PAT抗吗啡成瘾作用的机制研究,我们发现选择性kappa受体拮抗剂nor-BNI[13]能逆转PAT对吗啡CPP形成的抑制作用,而nor-BNI本身并不影响吗啡CPP形成,提示PAT拮抗吗啡的成瘾作用是通过激动kappa受体起作用的,这和我们以往在镇痛和吗啡耐受上的研究结果一致[5]。既往研究发现PAT的镇痛作用可被鞘内注射抗强啡肽的血清拮抗[14],间接提示其发挥镇痛作用可能和PAT增加脊髓强啡肽的产生和/或释放有关,但是既往的研究并没有提供直接的分子学证据,本研究采用放射免疫实验直接测定大鼠脑伏隔核内强啡肽的含量,发现给予吗啡后伏隔核内的强啡肽浓度有所增加,但是给予PAT后这种增加更为明显,和吗啡对照组相比有明显差异,并且这种作用是剂量相关的,而nor-BNI本身对脑伏隔核内强啡肽浓度没有明显影响。这些结果提示PAT对吗啡CPP形成的抑制效应是通过脑伏隔核内强啡肽的增加而产生的,nor-BNI的拮抗作用也主要是通过对强啡肽的kappa受体激动作用产生拮抗而发挥的。
近年来研究表明强啡肽/KOR系统可以通过调节突触前和突出后神经递质,诸如多巴胺、氨基丁酸和谷氨酸,参与药物奖赏机制的调节[2]。KOR在整个大脑、脊髓和外周组织都有广泛的表达,高水平的KOR mRNA可以在腹侧被盖区、伏隔核、额前皮质、海马、新纹状体和蓝斑等核团检出,这些大脑区域都和奖赏效应、情绪状态和认知功能的调节有关,其中伏隔核是最重要的核团,在药物成瘾的形成中可能起了枢纽和中转站的作用[2,3]。因此我们选择了直接测定大鼠脑伏隔核内强啡肽的含量来了解PAT产生抑制吗啡成瘾作用的分子依据,实验结果也验证了我们的推测。
既往研究证明激动kappa受体能减弱吗啡诱导的CPP和自我觅药行为,降低动物的复燃行为,并且激动kappa受体能拮抗可卡因、吗啡、海洛因和乙醇的强化和奖赏机制[2,3]。有意思的是,kappa受体激动剂有很强的镇痛、抑制吗啡耐受和药物成瘾的作用,其自身却没有明显的药物耐受和成瘾性[9]。使用kappa受体激动剂来治疗mu受体激动所产生的耐受或依赖等副作用可能是一个较好的选择,但是非肽类(non-peptidic)kappa受体激动剂却很有嗜睡、烦躁、人格分离、幻听、幻视等精神副作用而使其临床应用受到限制。虽然强啡肽等肽类kappa受体激动剂副作用较小[15],但强啡肽如果外周给药又难以通过血脑屏障而使其临床使用受限[9]。PAT通过增加大鼠伏隔核的强啡肽浓度抑制药物成瘾,相当于脑内靶点给药,因此副作用小而效果良好,具有较大的药物开发价值。本研究为治疗吗啡药物成瘾提供了一个新的思路和药物选择,但是这种药物成瘾抑制作用能持续多长时间,以及对已经形成吗啡成瘾后的动物给予PAT治疗是否有效在本研究尚未涉及,有待于进一步的实验研究来证实。
[1]吕俊华,叶开和,李俊杰.多巴胺受体阻滞剂协调吗啡镇痛及其镇痛机制分析[J].中国病理生理杂志,2002,18(2): 185-188.
[2]Wee S,Koob GF.The role of the dynorphin-kappa opioid system in the reinforcing effects of drugs of abuse[J].Psychopharmacology (Berl),2010,210(2):121-135.
[3]Wang YH,Sun JF,Tao YM,et al.The role of kappa-opioid receptor activation in mediating antinociception and addiction[J].Acta Pharmacol Sin,2010,31(9):1065-1070.
[4]Narita M,Kishimoto Y,Ise Y,et al.Direct evidence for the involvement of the mesolimbic kappa-opioid system in the morphine-induced rewarding effect under an inflammatory pain-like state[J].Neuropsychopharmacology,2005,30(1):111-118.
[5]Shu H,Arita H,Hayashida M,et al.Inhibition of morphine tolerance by processed Aconiti tuber is mediated by kappa-opioid receptors[J].J Ethnopharmacol,2006,106(2):263-271.
[6] Shu H,Arita H,Hayashida M,et al.Effects of processed Aconiti tuber and its ingredient alkaloids on the develop-
ment of antinociceptive tolerance to morphine[J].J Ethnopharmacol,2006,103(3):398-405.
[7]Shu H,Hayashida M,Chiba S,et al.Inhibitory effect of processed Aconiti tuber on the development of antinociceptive tolerance to morphine: evaluation with a thermal assay[J].J Ethnopharmacol,2007,113(3):560-563.
[8]Katz DH,Skidmore BJ,Katz LR,et al.Adaptive differentiation of murine lymphocytes.I.Both T and B lymphocytes differentiating in F1 transplanted to parental chimeras manifest preferential cooperative activity for partner lymphocytes derived from the same parental type corresponding to the chimeric host[J].J Exp Med,1978,148(3):727-745.
[9]Shu H,Hayashida M,Huang W,et al.The comparison of effects of processed Aconiti tuber,U50488H and MK-801 on the antinociceptive tolerance to morphine[J].J Ethnopharmacol,2008,117(1):158-165.
[10]Shu H,Hayashida M,Arita H,et al.High doses of processed Aconiti tuber inhibit the acute but potentiate the chronic antinociception of morphine[J].J Ethnopharmacol,2008,119(2):276-283.
[11]Oyama T,Isono T,Suzuki Y,et al.Anti-nociceptive effects of aconiti tuber and its alkaloids[J].Am J Chin Med,1994,22(2):175-182.
[12]Omiya Y,Goto K,Suzuki Y,et al.Analgesia-producing mechanism of processed Aconiti tuber: role of dynorphin,an endogenous kappa-opioid ligand,in the rodent spinal cord[J].Jpn J Pharmacol,1999,79(3):295-301.
[13]Endoh T,Matsuura H,Tanaka C,et al.Nor-binaltorphimine: a potent and selective kappa-opioid receptor antagonist with long-lasting activityinvivo[J].Arch Int Pharmacodyn Ther,1992,316:30-42.
[14]Omiya Y,Goto K,Suzuki Y,et al.Analgesia-producing mechanism of processed Aconiti tuber: role of dynorphin,an endogenous kappa-opioid ligand,in the rodent spinal cord[J].Jpn J Pharmacol,1999,79(3):295-301.
[15]Kreek MJ,Schluger J,Borg L,et al.Dynorphin A1-13causes elevation of serum levels of prolactin through an opioid receptor mechanism in humans: gender differences and implications for modulation of dopaminergic tone in the treatment of addictions[J].J Pharmacol Exp Ther,1999,288(1):260-269.
EffectsofprocessedAconitituberonmorphine-inducedconditionedplacepreferenceinrats
WU Gui-yun1,HUANG Wen-qi1,SHU Hai-hua1,ZHANG Hui1,CHEN Shan2,ZHOU Jun1
(1DepartmentofAnesthesiology,2DepartmentofStomatology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:shuhaihua@gmail.com)
AIM: To investigate the effect of processedAconitituber(PAT) on morphine-induced conditioned place preference (CPP) in rats.METHODSForty rats were randomly divided into 5 groups (n=8): saline group,morphine group,and morphine plus PAT 1,PAT 2 and PAT 3 groups.The rats in the latter 4 groups were subcutaneously injected with morphine (5 mg/kg) or saline alternately for 8 days and orally administrated with water or PAT at the dose of 0.3,1.0 or 3.0 g/kg once daily.Other 32 rats were also randomly divided into 4 groups: morphine group,morphine + nor-binaltorphimine (nor-BNI,a kappa receptor antagonist) group,morphine + PAT group and morphine + PAT + nor-BNI group.The CPP model was established.The rats were subcutaneously injected with nor-BNI (5 mg/kg) or saline 120 min before morphine was given.Oral PAT (3.0 g/kg) was administrated to PAT-treated rats and oral water was administrated to the other 2 groups once daily.CPP was measured on the day before CPP training and on the 9th day after CPP training.After the last CPP measurement,the nuclei accumbens (NAc) of the rats were obtained and the dynorphin concentration in NAc was measured by radioimmunoassay.RESULTSMorphine induced the increase in CPP scores of the rats after 8-day CPP training.PAT at 1.0 or 3.0 g/kg dose-dependently reduced morphine-induced increase in CPP scores.Nor-BNI completely antagonized the inhibitory effect of PAT (3.0 g/kg) on morphine-induced CPP.PAT dose-dependently increased dynorphin content in rat NAc after CPP training.CONCLUSIONPAT dose-dependently inhibits morphine-induced CPP in rats.This inhibitory effect is probably mediated by activation of kappa opioid receptors through increasing dynorphin content in rat NAc.
ProcessedAconitituber; Morphine; Conditioned place preference; Receptors,opioid,kappa; Dynorphins
1000-4718(2011)05-0911-05
R749.1
A
10.3969/j.issn.1000-4718.2011.05.015
2010-12-26
2011-03-28
广东省自然科学基金资助项目(No.0700904);教育部留学回国人员科研启动基金资助项目(No.[2008]890);教育部高等学校博士学科点专项科研基金资助项目(No.[2008]220)
△通讯作者 Tel:020-87755766-8273;E-mail:shuhaihua@gmail.com

