液态发酵法制备菜籽ACE 抑制肽发酵条件优化
鞠兴荣 金 晶 王立峰,2 袁 建 何 荣,2
(南京财经大学食品科学与工程学院 江苏省粮油品质控制及深加工技术重点实验室1,南京 210003)(江南大学食品学院2,无锡 214122)
液态发酵法制备菜籽ACE 抑制肽发酵条件优化
鞠兴荣1金 晶1王立峰1,2袁 建1何 荣1,2
(南京财经大学食品科学与工程学院 江苏省粮油品质控制及深加工技术重点实验室1,南京 210003)(江南大学食品学院2,无锡 214122)
以菜籽粕为原料,通过枯草芽孢杆菌液态发酵生产菜籽 ACE抑制肽。先以肽得率、ACE抑制率为指标通过单因素试验得到液态发酵的发酵条件,再以响应面法分析法,优化了枯草芽孢杆菌液态发酵的工艺条件,确定枯草芽孢杆菌液态发酵生产菜籽 ACE抑制肽的最佳发酵工艺条件为发酵时间,发酵温度和接种量,最佳工艺条件分别为 20 h、38℃和 1×108个 /mL。优化后的菜籽 ACE抑制肽抑制率达到 70.95%。
枯草芽孢杆菌 菜籽肽 液态发酵 ACE抑制肽 响应面分析法
ACE(血管紧张素转化酶)抑制剂通过抑制 ACE的活性而达到降血压的作用,目前使用的很多合成的ACE抑制剂在降血压的同时会产生一定的副作用[1],而植物源 ACE抑制肽具有安全性高,副作用少,易吸收的优点[2],因此成为了ACE抑制肽研究的热点。菜籽粕是菜籽榨油之后的副产品,其中蛋白质量分数为 35%~42%,且为优质的蛋白质[3-4]。将菜籽粕发酵制备 ACE抑制肽,可以充分的利用菜籽蛋白资源,达到变废为宝的作用。目前发酵法制备大豆和牛奶的ACE抑制肽的研究在我国已有报道[5-7],而使用液态发酵制备菜籽ACE抑制肽的研究目前在国内还属于空白,因此具有很高的研究价值。
在利用枯草芽孢杆菌 10160液态发酵生产菜籽肽培养基优化的基础上,着重探讨了摇床转速、接种量、发酵温度、发酵时间对发酵效果的影响,应用单因素和响应面分析法 (Response surface analysis,RSA)对菜籽液态发酵的发酵工艺条件进行优化,以ACE抑制率为响应值,采用多元二次回归拟合出方程,得到了液态发酵生产菜籽蛋白肽的最佳发酵工艺条件。
1 材料与方法
1.1 材料
B acillus.subtilis10160等产蛋白酶菌种:中国工业微生物菌种保藏中心;菜籽粕,以 canola菜籽为原料,通过索氏抽提脱油制得,含粗蛋白 43.26%;牛血清白蛋白、细胞色素、钴胺酰胺 (VB12)、Gly-Gly-Tyr-Arg、ACE(0.25U)、HHL、Gly-Gly-Tyr-Arg:Sigma公司;其他试剂均为分析纯。
1.2 主要仪器与设备
立式电热压力蒸汽灭菌锅:上海申安医疗器械厂;GL-20B型高速冷冻离心机:上海安亭科学仪器厂;全温立式振荡培养箱:太仓市实验设备厂;722N紫外可见分光光度计:上海精密科学仪器厂;HH-4数显恒温水浴锅:国华电器有限公司。
1.3 方法
1.3.1 斜面培养
将保藏的枯草芽孢菌种接入基础培养基 (牛肉膏 0.3 g/100 mL,蛋白胨 1 g/100 mL,氯化钠 0.5 g/100 mL,琼脂 2.5 g/100 mL),在 30℃下进行恒温静止培养 24 h,使其转接活化。
1.3.2 种子培养
挑取 2环枯草芽孢杆菌种子培养基活化后菌株,接入装有 100 mL种子培养基 (牛肉膏 0.3 g/100 mL,蛋白胨 1 g/100 mL,氯化钠 0.5 g/100 mL)的250 mL锥形瓶中,8层纱布封口,在恒温振荡培养箱中进行扩大培养,控制温度 30℃,转速 180 r/min,培养 24 h,使其菌体浓度达到 108个 /mL。
1.3.3 发酵培养
从已制备好的种子培养基中取出一定体积的菌悬液接入已灭菌的装有 100 mL发酵培养基 (磷酸二氢钾 0.45 g/100 mL,葡萄糖 0.8 g/100 mL,料液比1∶23)的 250 mL锥形瓶中进行液态发酵,发酵锥形瓶用 8层纱布封口,控制在 38℃,180 r/min的恒温振荡培养箱内进行培养,培养一定时间后取样进行测定。
1.3.4 发酵液处理
将培养一定时间的发酵产物取出,2~4℃下4 000×g离心 15 min,测定其上清液体积,用 0.45 μm微孔滤膜过滤上清液,除去不溶物和细菌,备用。
1.3.5 枯草芽孢杆菌生长曲线的测定
从活化后的枯草芽孢杆菌斜面上挑取 2环接入液体种子培养基中,控制培养温度 30℃,转速 180 r/min,每隔 2 h取一次样 (5 mL),高速离心下沉淀菌体 (4 000×g,15 min),去除上清液后,菌体沉淀以无菌蒸馏水悬浮,混匀定容至 10 mL,于 600 nm处测定其吸光度。
1.3.6 细菌数量测定
血球板计数法测定[8]。
1.3.7 菜籽多肽得率测定
参照文献[9]所述方法,取 2.5 mL处理液,加入等体积 10%的三氯乙酸 (TCA),静置 30 min,2~4℃下,5 000×g离心 20 min,取 2 mL上清液,加 8 mL双缩脲试剂,25℃下静置 30 min,测 OD540值。肽得率按公式 (1)计算:

1.3.8 ACE抑制活性的测定
ACE抑制活性的测定参照 Cushman等[10]的方法,做出适当的修改,具体步骤如下:用含有 0.3 mol/L NaCl的 0.1 mol/L硼酸盐缓冲液 (pH 8.3)将 HHL配制成 5.0 mmol/L的溶液。取 100μL的 HHL和40μL的水解产物混合,于 37℃下保温 3 min后,加入 10μL ACE(溶于蒸馏水,活力为 0.1 U/mL),混匀后 37℃保温 30 min,再加入 250μL的 1 mol/L的HCl溶液以终止反应,再加入 1.7 mL醋酸乙酯,15 s振荡混匀,5 000×g离心 10 min,用移液管吸取1 mol/L醋酸乙酯层,真空冷冻干燥 2 h后,加入 3 mL蒸馏水,在 228 nm处测定其吸光度。ACE抑制活性按公式 (2)计算:

式中:A为含有菜籽多肽液和 ACE溶液时所测的吸光度;B为不含有菜籽多肽液,但含有 ACE溶液时所测的吸光度;C为含有菜籽多肽液,但不含 ACE溶液时所测的吸光度。
2 结果与分析
2.1 枯草芽孢杆菌生长曲线
枯草芽孢杆菌生长繁殖比较快,在适宜条件下,20~30 min就可以分裂一次,从图 1可以看到,在发酵的开始阶段,菌体数目增加并不多 (0~10 h),一定时间后,菌体数目增长很快 (12~28 h),随后菌体增长进入稳定期 (24~32 h),在 34 h后,随着菌体数目增长,培养基内营养物质的消耗和自身代谢产物的大量产生,菌体进入衰亡期。因此,12~28 h是本菌株的对数期,由于对数期的微生物细胞生长平衡,菌体内酶系活跃,代谢旺盛,群体的形态与生理特征最一致,并且抗不良环境的能力强,所以在试验中,均以培养 20 h左右的菌株为种子液。

图 1 枯草芽孢杆菌生长曲线图
2.2 肽含量标准曲线
用 5%TCA配制不同浓度的 Gly-Gly-Tyr-Arg标准溶液,按照多肽含量测定方法显色,于 540 nm下测定OD值。以多肽质量为横坐标 x(mg),OD值为纵坐标 y,制作标准曲线 (图 2),得到回归方程y=0.025 7x+0.002 9,R2=0.999 5。

图 2 Gly-Gly-Tyr-Arg四肽标准曲线
2.3 摇床转速对液态发酵肽得率和 ACE抑制率的影响
在液态发酵当中,摇床的转速会影响液态发酵培养基的通气量,使得培养基中溶氧量变化,从而影响菌种的生长和发酵。由图 3可以看出,摇床转速对液态发酵的影响不是很明显,ACE抑制活性极差为 0.6%。这可能是由于液态发酵时液态培养基接触空气的面积较大,且处于不断震荡当中,培养基的溶氧充足,在较低转速下即可满足微生物生长对氧气的需求,因此,当转速改变,对发酵结果的影响不是很明显,当摇床转速达到 180 r/min时,为液态发酵的最优转速,肽得率可以达到 23.19%,ACE抑制活性达到 62.08%。
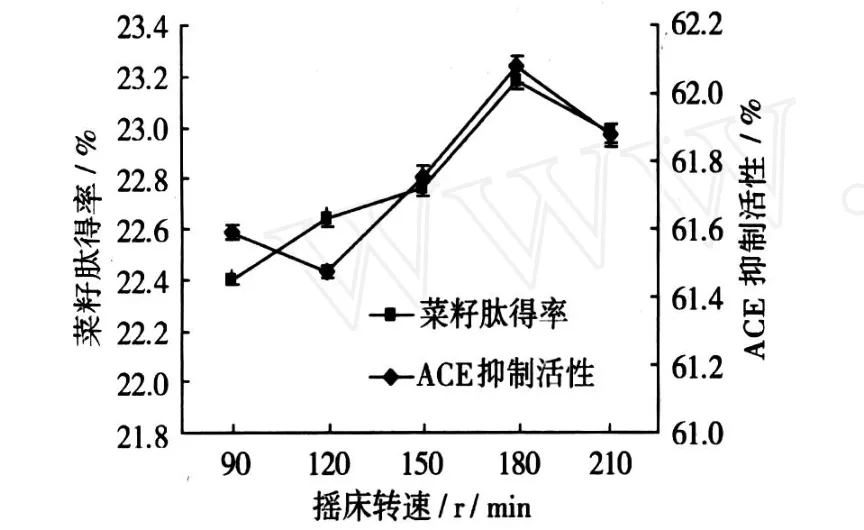
图 3 摇床转速对肽得率和ACE抑制活性的影响
2.4 接种量对液态发酵肽得率和 ACE抑制率的影响
由图 4可以看出,接入枯草芽孢杆菌的量对液态发酵会产生一定的影响,当接种量过少,产生的蛋白酶量会较少,从而使得肽得率较少,ACE抑制活性较低,而接种量过多,培养基中的营养物质不能完全满足枯草芽孢杆菌的生长需要,也会使得枯草芽孢杆菌生长受到限制,导致发酵效果不佳。当接种量达到 1×108个 /mL时,肽得率和 ACE抑制活性均达到最高值,再增加接种量,会导致肽得率的明显降低,因此,液态发酵培养基的接种量为 1×108个 /mL。

图 4 接种量对肽得率和ACE抑制活性的影响
2.5 发酵温度对液态发酵肽得率和 ACE抑制率的影响
温度是影响微生物生长繁殖以及产酶的主要因素之一,因此,在液态发酵中,对发酵温度的控制十分关键。由图 5可以看出,温度过低和过高都不利于枯草芽孢杆菌液态发酵。当温度过低,枯草芽孢杆菌生长不佳,产酶量也较少,而温度过高,会抑制其生长,甚至导致其死亡。当发酵温度在 38℃时,菜籽肽得率和 ACE抑制活性均达到最大值,分别为23.36%和 62.47%,因此,液态发酵的最优温度条件为 38℃。
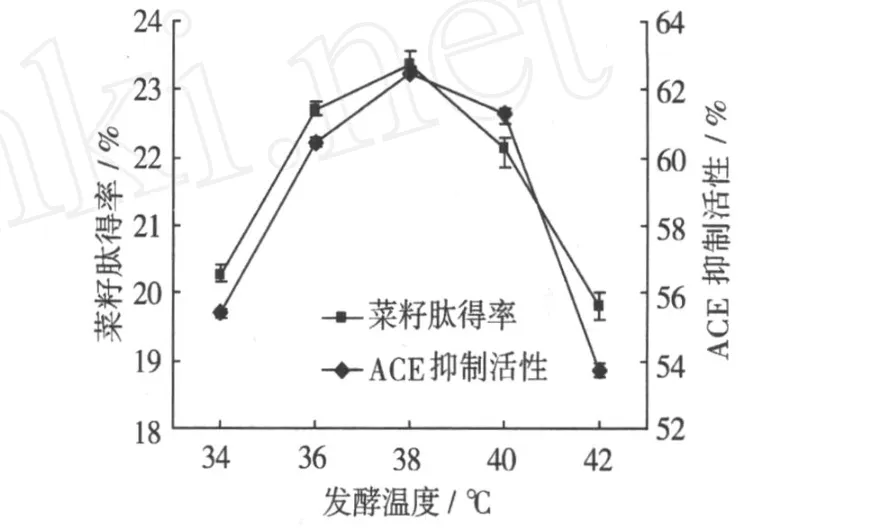
图 5 发酵温度对肽得率和ACE抑制活性的影响
2.6 发酵时间对液态发酵肽得率和 ACE抑制率的影响
由图 6可以看出,发酵时间对液态指标有显著的影响。当发酵进行到 24 h时,肽得率和 ACE抑制活性均达到最高值,而随着发酵时间的延长,肽得率和ACE抑制活性逐步降低,推测其原因是由于随着发酵的进行,已经得到的小肽进一步水解,从而肽得率明显降低,而随着小肽的水解,一些具有 ACE抑制活性的小肽也被进一步的水解成为了不具有ACE抑制活性的短肽或氨基酸,因此,ACE抑制活性也随着发酵时间的延长而逐步降低。因此,液态发酵的最优时间为 24 h,此时的肽得率和 ACE抑制活性均为最高,分别为 23.85%和 64.38%。
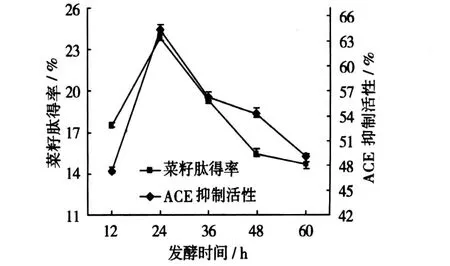
图 6 发酵时间对肽得率和ACE抑制活性的影响
2.6 响应面分析法优化发酵条件结果分析
2.6.1 响应面分析法分析因素的选取及试验结果
在单因子试验结果基础上,根据 Box-Behnken的中心组合设计原理,对液态发酵影响较大的 3个因素设计响应曲面试验以确定最优的培养基条件。以菜籽肽 ACE抑制率为响应值,自变量为发酵时间,发酵温度和接种量,分别以 X1、X2和 X3代表,按方程 xi=(Xi-X0)/ΔX对自变量进行编码,其中,xi为自变量的编码值,Xi为自变量的真实值,X0为试验中心点处自变量的真实值,ΔX为自变量的变化步长。因子编码及各自变量水平见表 1。
为了最优拟合多元二次模型方程各项系数,依据统计学实验设计要求,对影响菜籽肽得率的发酵培养基关键内在因素进行了 15组试验,15组试验分为析因点和零点,试验号 1~12是析因试验,13~15是中心试验。其中析因点为自变量取值在 x1,x2,x3所构成的三维定点,零点区域为中心点,零点试验重复 3次,以估计试验误差,试验结果见表 2。
利用Designexpert软件对表试验数据进行多元回归拟合,获得枯草芽孢杆菌液态发酵菜籽产 ACE抑制肽发酵条件编码自变量的二次多项回归方程为:

其中 Y为 ACE抑制率,X1、X2、X3分别代表发酵时间,发酵温度和接种量。方程中 X1,X2的系数均较大,表明发酵时间和发酵温度对 ACE抑制效率最具有显著意义。一次项,二次项和交互项系数大多为负值,可以认为一次项,二次项和交互项方程主要对ACE抑制率起负作用。
从该模型的方差分析表 3可见,试验所选用的二次多项模型具有高度的显著性 (P=0.001 9),P值越小,其因子越显著。失拟项在 a=0.05水平上不显著 (P=0.120 0>0.05),其校正决定系数为0.927 2,表明此模型拟合优度好,ACE抑制率仅有7.28%的总变异不能由此模型进行解释。
对上述方程的回归系数显著性检验表明 (见表4),发酵时间对 ACE抑制率的影响极显著 (P<0.01),发酵温度对 ACE抑制率的影响显著 (P<0.5),表明在发酵培养基中,发酵温度和发酵时间对ACE抑制率有显著影响;3个因素之间的交互作用影响也都显著,说明在培养基中,发酵时间,发酵温度和接种量之间的交互作用亦能对ACE得率造成显著影响。通过显著性检验可以看出,发酵时间对菜籽肽得率的影响最大,发酵温度的影响次之,接种量的影响在本试验范围内最小。

表 1 Box-Behnken中心组合试验设计因素水平及编码

表 2 Box-Behnken试验设计及菜籽肽得率实测值及预测值

表 3 菜籽肽得率二次多项模型方差分析表

表 4 菜籽肽得率回归方程系数显著检验
2.6.2 ACE抑制率的响应面分析与优化
模型的响应面图及其等高线图可比较直观地解释各变量和变量之间对响应值的影响。等高线图还可揭示出各变量之间交互作用的显著性。在接种量保持固定的情况下,发酵时间 (A)和发酵温度 (B)对ACE抑制活性影响交互作用的等高线图和曲面图如图 7所示,发酵温度 (B)和接种量 (C)对 ACE抑制活性影响交互作用的等高线图和曲面图如图 8所示。

通过图 7可以对发酵时间和温度交互影响 ACE抑制活性的效应进行分析和评价,并从中确定最佳的因素水平范围。由图 7可以看出,当发酵时间在12~22.8 h,发酵温度在 37.5~38.8℃,ACE抑制率高于 70%。
通过图 8可以对发酵温度和接种量交互影响ACE抑制活性的效应进行分析和评价,并从中确定最佳的因素水平范围。由图 8可以看出,当发酵温度在 37.5~38.4℃接种量在 0.6×108~2×108个 /mL,ACE抑制率高于 70%。
2.6.3 液态发酵生产ACE抑制肽最优条件的确立
从图 7、图 8中可以看出 X1、X2、X3存在极值点,为了进一步验证最佳点的值,对回归方程 (3)取一阶偏导等于零并整理得:-2.07-1.98X2+0.6X3-3.88X1=0;-0.63-1.98X1-2.69X3-10.9X2=0;0.17+0.6X1-2.69X2-11.74X3=0,解得 X1=-0.57、X2=0.05、X3=-0.03。代入回归方程 (3),解得预测的最高ACE抑制率为 70.95%。转换后得到最佳培养基配比为发酵时间 19.2 h,发酵温度38.1℃,接种量 1×108个 /mL。为了方便培养基的配制,确定培养基的最优配方为:发酵时间 20 h,发酵温度38℃,接种量 1×108个 /mL。
2.6.4 模型验证试验
根据 Box-Behilken试验所得的结果和二次多项回归方程,利用 Designexpert软件获得了 ACE抑制活性最高时的最佳工艺条件。为了验证其优化结果的可靠性,在最佳发酵培养基中进行 5组平行试验,所得ACE抑制活性分别 70.08%、71.53%、71.14%、70.69%、69.95%,平均值为 70.68%,回归方程所得到的ACE抑制活性预测值与验证试验的平均值相接近,说明该模型能够较好地预测 ACE抑制活性值。
3 结论
以ACE抑制率为考察指标,经单因素试验确定发酵时间,发酵温度和接种量对 ACE抑制率有显著影响,在此基础上,采用响应面分析方法,根据 Box-Behnken中心组合原理设计了 3因素 3水平试验,用Design-Expert软件处理试验数据,得到了一个 ACE抑制率回归模型以及取得模型最优值时各因素水平。试验结果表明,枯草芽孢杆菌液态发酵中发酵时间,发酵温度和接种量的最佳工艺条件分别为20 h、38℃和 1×108个 /mL,在该最佳工艺条件下,ACE抑制率可达 70.95%。在枯草芽孢杆菌液态发酵培养基优化的基础上,ACE抑制率又提高了大约2%。综合枯草芽孢杆菌液态发酵菜籽粕生产 ACE抑制肽的培养基优化结果和发酵条件优化结果,可以得出其最佳发酵条件为:磷酸二氢钾 0.45%,葡萄糖 0.8%,料液比 1∶23,初始 pH7,摇床转速 180 r/min,发酵时间 20 h,发酵温度 38℃,接种量 1×108个 /mL,在此基础上,ACE抑制活性可达 70.95%。
微生物作为酶制剂的重要来源,采用液态发酵法制备 ACE抑制肽,可以很好的节约成本,为工业化大规模生产菜籽 ACE抑制肽提供一条可行的途径,同时,还可以通过液态发酵的方法将脱苦和制肽一步完成,通过絮凝剂将微生物沉淀,并联用多种分离纯化技术,可以制得高纯度的ACE抑制肽。
菜籽 ACE抑制肽可以广泛的运用到食品,医疗行业,具有很高的利用价值,本试验运用枯草芽孢杆菌液态发酵法制备菜籽 ACE抑制肽具有生产成本低、肽得率高、ACE抑制率高等特点,在工业化生产菜籽ACE抑制肽上是很有潜力的方法。
[1]Brown J P,Vaughan D E.Angiotensin-converting enzyme inhibitors[J].Circulation,1998,97(14):1411-1420
[2]Wu J,DingX.Characterization of inhibition and stabilityof soy-proteinderived angiotensin I-converting enzyme inhibitory peptides[J].Food Research International,2002,35:367-375
[3]王立峰,袁建,鞠兴荣,等.双低油菜籽油脂加工副产品的研究现状与发展趋势[J].中国油脂,2005,30(9):11-14
[4]周瑞宝.植物蛋白功能原理与工艺 [M].北京:化学工业出版社,2008
[5]Shin Joung Rho,Ji-Soo Lee,Yong II chung,et al.Purifica2 tion and identification of an angiotensin I-converting enzyme inhibitory peptide from fermented soybean extract[J].Process Biochemistry,2009,44:490-493
[6]Yamamoto N,MaenoM,Takano T.Purification and character2 ization of an antihypertensive peptide froma yogurt-like product fermented by Lactobacillus helveticus CPN4[J].Journal ofDairy Science,1999,82:1388-1393
[7]Mette S Nielsen,Torben Martinussen,Bénédicte Flambard,et al.Peptide profiles and angiotensin-I-converting enzyme inhibitory activity of fer mented milk products:effect of bacte2 rial strain,fermentation pH,and storage ti me[J].Internation2 alDairy Journal,2009,19:155-165
[8]张玲.微生物实验指导[M].北京:北京交通大学出版社,2007:54-56
[9]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171
[10]Cushman,DW,Cheung HS.Spectrophotometric assay and properties of the angiotensin I-converting enzyme of rabbit lung[J].Biochem Phar macol,1971,20:1637-1648.
Opti mization ofLiquid Fer mentation for Producing Rapeseed Angiotensin I-Converting Enzyme Inhibitory Peptides
Ju Xingrong1Jin Jing1Wang Lifeng1,2Yuan Jian1He Rong1,2
(College of Food Science and Engineering,NanjingUniversity of Finance&Economics,Key Laboratory of Grain&OilsQuality Control and Deep-Utilizing Technology of Jiangsu Province1,Nanjing 210003)
(School of Food Science and Technology,Jiangnan University2,Wuxi 214122)
Rapeseed mealwas used to produce angiotensin I-converting enzyme(ACE)inhibitory peptides withB acillus subtilisliquid-state fermentation.W ith rapeseed peptide yield and ACE inhibitory rate as indexes for single factor test,the technology conditions for producingACE inhibitory peptideswere optimized by response surface analysis.Results:The optimal conditions are fer mentation ti me 20 h,fer mentation temperature 38℃,and inoculum size 1×108ind/mL.Under the above conditions,the ACE inhibitory rate reaches 70.95%.
Bacillus subtilis,rapeseed peptide,liquid-state fermentation,ACE inhibitory peptides,response surface methodology
TS209
A
1003-0174(2011)01-0096-06
863计划(2007AA10Z331),国家农业成果转化资金项目(2009C10045),江苏省自然科学基金项目,江苏省农业科技自主创新资金项目[cx(10)444]
2010-01-11
鞠兴荣,男,1957年出生,教授,博士,食品营养及功能性成分研究与开发

