比索洛尔对心力衰竭兔心房肌细胞钾通道表达的影响
李 溪,马爱群,任京婷,王亭忠,韩 克,卢 群,卓小桢 (西安交通大学医学院第一附属医院心内科,教育部环境与疾病相关基因重点实验室/心血管离子通道病研究室,陕西省分子心脏病学重点实验室,西安 710061;通讯作者,E-mail:maaiqun@medmail.com.cn)
慢性心力衰竭(chronic heart failure,CHF)时房性心律失常的发生率明显升高,是心房纤颤(atrial fibrillation,AF)发生的主要原因之一,房性心律失常与心房的电重构有关[1-3]。瞬时外向钾电流(transient outward potassium current,Ito)、快激活延迟整流钾电流(rapidly activated delayed rectifier potassium current,IKr)、慢激活延迟整流钾电流(slowly activated delayed rectifier potassium current,IKs)和内向整流钾电流(inward rectifier potassium current,IK1)是形成心肌动作电位的主要外向电流[2]。Ito是形成心房肌细胞动作电位复极的1期。Ito分为快成分Ito,f和慢成分Ito,s两种。Ito,f的 α 亚基由 Kv4.3 编码,而Ito,s的 α亚基由Kv1.4编码。延迟整流钾电流(delayed rectifier potassium current,IK)是心房肌动作电位复极的主要电流。IK分为IKr和IKs。IKr的α亚基由ERG编码,IKs通道 α亚基由KvLQT1编码,IKs通道的 β亚基由minK编码。IK1主要参与心房肌静息电位的形成,直接影响动作电位的平台期,决定去极化反应时间。多项研究结果显示,β受体阻滞剂抗心律失常的作用机制之一是对离子通道的影响,从而起到防止心律失常的作用[4]。
离子通道表达的变化是离子通道重构的分子基础。因此我们以容量负荷联合压力超负荷心力衰竭兔为研究对象,观察左房心肌细胞K+通道表达的变化,以探讨心衰时房性心律失常发生的机制。同时观察比索洛尔干预对K+通道表达的影响,以探讨比索洛尔抗心律失常的分子机制。
1 材料与方法
1.1 实验动物分组及心衰模型的构建 选择由西安交通大学医学院实验动物中心提供的新西兰兔39只,均为雄性,体重 2.5-3.0 kg,常规饲养。术前经心动超声检查排除心脏器质性病变后,随机分为假手术组(sham operation,SO组;n=10)、心衰组(heart failure,HF组n=15)和比索洛尔干预组(heart failure with bisoprolol,BF 组;n=14)。
按照以往文献方法[5]制作容量联合压力超负荷心力衰竭兔模型。于耳缘静脉给予戊巴比妥钠(30 mg/kg)麻醉后,将兔固定于动物手术台,取颈部正中切口,钝性分离右侧颈动脉,将4F造影导管(Cordis,美国强生公司)末端连接压力换能器(成都泰盟科技公司),导管插入颈动脉,快速、反复通过主动脉瓣,直到脉压(arterial pressure,AP)升高了50%以上,表示诱导主动脉瓣关闭不全成功,形成容量超负荷。术后每只给予青霉素8万U/d连续肌注3 d。2周后通过腹主动脉缩窄术诱导压力超负荷。术前禁食24 h,麻醉同前。右侧卧位,取左侧肋缘中点,纵向切口,钝性分离腹主动脉(左侧肾动脉上)。用5F或6F造影导管紧贴腹主动脉,用4号手术线环扎,然后取出导管,形成腹主动脉50%狭窄。术后每只均给予青霉素8万U/d,连续肌注7 d。假手术组兔在2次手术中,只分离和结扎右侧颈动脉及钝性分离腹主动脉,术后处理同心力衰竭组。比索洛尔干预组,则是在诱导主动脉瓣关闭不全术后第2天给予比索洛尔(富马酸比索洛尔,康忻,德国默克)1 mg/(kg·d)灌胃6周,其余处理同心力衰竭组。
1.2 心功能检测 手术后8周分别通过以下检查评估心功能。①心动超声检测。用美国惠普公司的HP Sonos 2500型多功能超声检查仪及7.5 MHz相控阵探头检测左房内径(left atrium diameter)、左室舒张末期内径(left ventricular diastolic diameter,LVDD)、左室收缩末期内径(left ventricular systolic diameter,LVSD)、左室射血分数(left ventricular ejection fraction,EF)、舒张早期二尖瓣血流速度E峰与舒张晚期血流速度A峰比值(E/A比值)、短轴速率(fraction shortening,FS)。②血清脑钠肽(brain natriuretic peptide,BNP)测定。由腹主动脉抽取动脉血,EDTA抗凝,3 000 r/min离心10 min,取血清,用西唐生物公司兔脑钠肽ELISA试剂盒检测。③心体比等指标。麻醉同前,打开腹腔、胸腔,观察有无积水,迅速取出心脏,用4℃PBS冲去残血,滤纸吸干称重,计算心脏、左室、肺脏与体重比。心房组织用液氮速冻后,转至-80℃保存。
1.3 反转录及real-time PCR检测 TRIZOL(Sigma,美国)提取3组兔心房组织的总RNA,经过纯度检测A260/A280在1.8-2.0之间,符合 RNA 样品检测要求。按TaKaRa反转录试剂盒操作,反转录条件为37℃ 15 min(反转录反应),85℃ 5 s(反转录酶的失活反应)进行cDNA合成。
以 NCBI Genebank提供的兔的 GAPDH、Kir 2.1、Kv4.3、Kv1.4、KvLQT1 minK、ERG 的 cDNA 序列为模板,由北京奥科生物公司合成引物(见表1)。按照TaKaRa real-time PCR试剂盒操作,采用两步法PCR扩增程序:第一步,预变性:95℃ 10 s,1个循环;第二步,PCR反应:95℃ 5 s,60℃(各个目的基因的核酸解链温度)30 s,50个循环,扩增曲线完毕后,自动生成溶解曲线。反应结束后确认realtime PCR的扩增曲线和溶解曲线。用iQ5 Real-time PCR仪的软件得出各个样本的CT值,按照2-ΔΔCT法计算各组基因表达与假手术组的比值。用2%的琼脂糖凝胶电泳检验PCR产物,只有单一的扩增条带,未见引物二聚体等非特异性条带,说明扩增反应是特异的。

表1 各目的基因的引物序列Tab 1 Specific primers for rabbit target genes
2 结果
2.1 心力衰竭模型的建立 心衰组和比索洛尔干预组兔术后出现精神状态差,进食量减少,呼吸费力、口鼻发绀等。假手术组兔精神状态及进食量较好。实验过程中,假手术组死亡1只,心衰组死亡3只,比索洛尔干预组死亡3只。术后死亡原因主要为急性心力衰竭、腹腔感染,尸检发现双肺充血呈粉红色、肠粘连、腹腔积液。8周处死时见心衰组大部分大白兔出现胸腔积液和腹水。三组在8周时心动超声、血清BNP、心体比参数证实心力衰竭模型的建立(见表2)。与假手术组对比,心衰组兔心动超声结果显示 LAD、LVDD、LVDS、FS明显升高(P<0.01)、EF和 E/A 比值明显降低(P<0.01),血清BNP水平明升高了近2倍(P<0.01),心体比明显增大(P<0.01)。比索洛尔干预6周,兔的 LAD、LVDD、LVDS、FS 比心衰组降低(P<0.05),EF、FS和E/A比心衰组明显提高(P<0.05),BNP水平和心体比比心衰组显著降低(P<0.01)。这说明比索洛尔干预后可以明显改善心衰兔的心功能,使左房、左室缩小。
表2各组兔心功能指标比较(±s)Tab 2Characteristics of heart function measurement in three groups(±s)
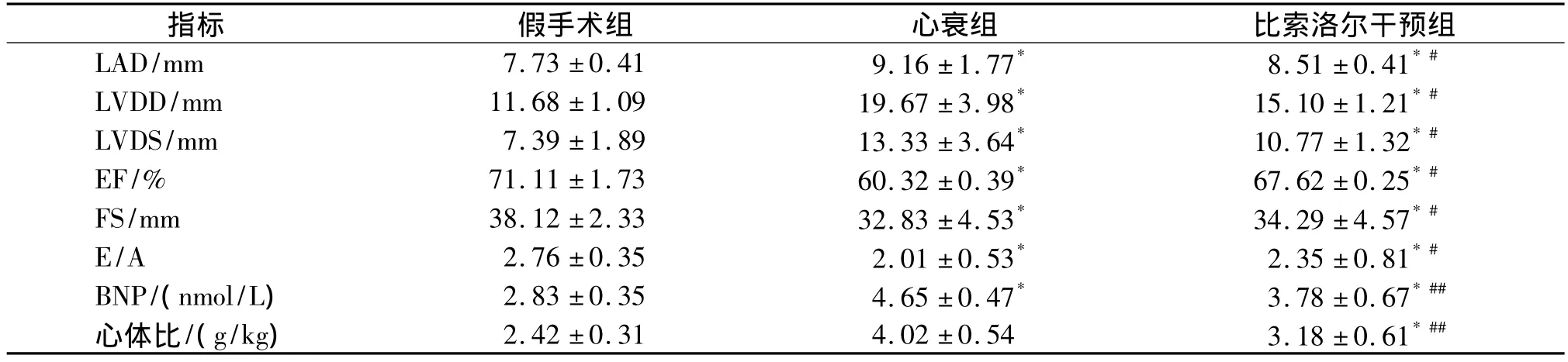
表2各组兔心功能指标比较(±s)Tab 2Characteristics of heart function measurement in three groups(±s)
与假手术组比较,*P <0.05;与心衰组比较,#P <0.05,##P<0.01
指标 假手术组 心衰组 比索洛尔干预组LAD/mm 7.73 ±0.41 9.16 ±1.77* 8.51 ±0.41*#LVDD/mm 11.68 ±1.09 19.67 ±3.98* 15.10 ±1.21*#LVDS/mm 7.39 ±1.89 13.33 ±3.64* 10.77 ±1.32*#EF/% 71.11 ±1.73 60.32 ±0.39* 67.62 ±0.25*#FS/mm 38.12 ±2.33 32.83 ±4.53* 34.29 ±4.57*#E/A 2.76 ±0.35 2.01 ±0.53* 2.35 ±0.81*#BNP/(nmol/L) 2.83 ±0.35 4.65 ±0.47* 3.78 ±0.67*##心体比/(g/kg) 2.42 ±0.31 4.02 ±0.54 3.18 ±0.61*##
2.2 三组兔左心房肌细胞的Ito通道mRNA的表达Kv4.3 编码Ito,f通道 α 亚基,Kv1.4 编码Ito,s通道α亚基。以假手术组兔的Kv4.3和Kv1.4 mRNA表达为1,心衰组的 Kv4.3和 Kv1.4 mRNA分别为0.41 ±0.03 和 0.71 ±0.05(vsSO,P<0.01);比索洛尔干预组的Kv4.3和Kv1.4 mRNA相对表达量分别为 0.62 ±0.02 和 0.85 ±0.03(vsSO,P<0.01)。结果显示,心力衰竭时 Kv4.3 和 Kv 1.4 mRNA分别下调60%和30%,Kv4.3的mRNA水平下降比Kv1.4明显;比索洛尔干预后Kv4.3和Kv 1.4 mRNA表达上调了20%和15%,说明比索洛尔可以部分逆转Kv4.3和Kv1.4 mRNA表达的下调。
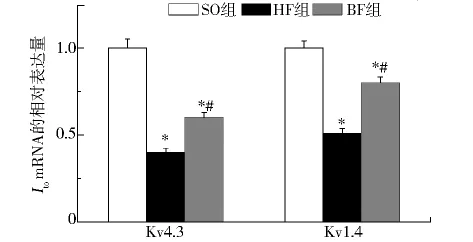
图1 Kv4.3和 Kv1.4 mRNA 的表达Fig 1 Relative expression of Kv4.3 and Kv1.4 mRNA in three groups
2.3 三组兔左心房肌细胞的IKs和IKr通道mRNA的表达 ERG和KvLQT1分别编码IKr和IKs的的α亚基,minK编码β亚基。以假手术组兔的mRNA表达量为1,心衰组和比索洛尔干预组ERG mRNA分别为 0.95 ±0.07 和 0.96 ±0.06(vsSO,P>0.05)。心衰组和比索洛尔干预组KvLQT1的mRNA 水平为0.68±0.02(vsSO,P<0.01)和 0.88 ±0.03(vsSO,P<0.01;vsHF,P<0.01)。心衰组和比索洛尔干预组minK mRNA的水平分别为0.71±0.04(vsSO,P<0.01)和 0.85 ± 0.05(vsSO,P<0.01;vsHF,P<0.01)。结果显示,心力衰竭时 Kv-LQT1和minK的mRNA下调了32%和29%,ERG没有明显变化;比索洛尔干预后可以使KvLQT1和minK mRNA表达上调20%和14%。
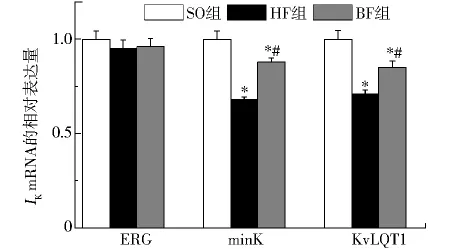
图2 ERG、minK和KvLQT1基因mRNA水平Fig 2 Relative expression of ERG,minK and KvLQT1 mRNA in three groups
2.4 三组兔左心房肌细胞的IK1通道mRNA的表达Kir2.1编码IK1通道的α亚基。以假手术组兔的mRNA表达为1,心衰组和比索洛尔干预组的Kir2.1 mRNA相对表达量分别为0.78±0.03(vsSO,P<0.01)和 0.89 ± 0.06(vsSO,P< 0.01;vsHF,P<0.01)。心力衰竭时心房肌细胞Kir2.1的mRNA表达降低了22%,比索洛尔整体干预后升高Kir2.1的mRNA表达增加了11%,逆转了IK1通道表达的下调。
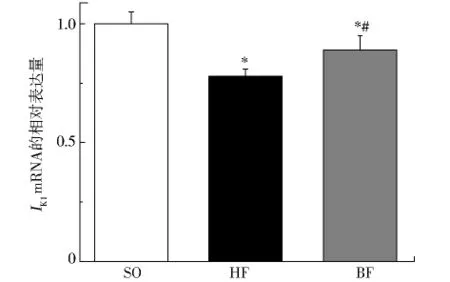
图3 Kir2.1 mRNA的表达Fig 3 Relative expression of Kir2.1 mRNA in three groups
3 讨论
本研究中,我们用容量负荷联合压力超负荷心力衰竭兔研究心房肌细胞Ito、IKs、IK1通道表达下调,比索洛尔干预6周可以部分逆转Ito、IKs、IK1通道mRNA表达的下调。
在本研究中,我们发现容量负荷联合压力超负荷心力衰竭兔左房心肌Ito、IKs、IK1通道表达下降。这种因心力衰竭导致的离子通道重构与房颤引起的离子通道重构有所不同。心力衰竭是房颤发生的病因之一[6]。持续的房性心动过速引起动作电位时程(action potential duration,APD)缩短,减弱APD 频率依赖性[7]。尽管心力衰竭也是引起房颤的病因之一,但心力衰竭时APD缩短,而且APD的频率依赖性减弱没有房性心动过速时显著。房颤和心力衰竭时APD的不同改变,其原因在于心房肌离子通道不同的重构导致的。多项研究表明房颤时心房肌离子通道发生重构[1,2],如Ito、IKs减弱,而IK1不变,但是在慢性心力衰竭兔的心房肌中Ito、IKs和IK1都是减弱的[8]。目前研究结果显示Ito通道在心衰和房颤心房肌细胞的变化是一样的,都为表达下调[9]。房性心动过速时APD缩短是导致房颤多发折返的原因,但是心力衰竭时APD并不缩短,而是延长。这说明心力衰竭引起房颤不是通过损害APD频率依赖性,而是通过其他的原因。慢性心力衰竭时心肌纤维化、心肌缺氧及缝隙连接蛋白43表达下降引起心肌传导异常及自律性下降。这些变化可能是慢性心力衰竭引发房颤的主要原因[10,11]。此外慢性心力衰竭时IK1的下降引起细胞向阈电位去极化,导致异常冲动如晚后除极(DADs)发生[1]。
本研究中心衰时心房肌细胞Ito与心室肌细胞中Ito的变化相比[12],我们发现,心房肌细胞中Ito变化比心室肌中的明显,这说明Ito通道在心房肌细胞复极中起着重要的作用。
本文研究表明,当CHF患者出现AF时,AF发生的机制与房性心动过速引起的离子通道重构不一样,其发生的原因更多是由于心衰导致的离子通道重构。但是当CHF患者AF发生后,是否会因房性心动过速引起离子通道再次发生重构,这需要进一步的研究。了解到CHF和房性心动过速引起的离子通道重构的不同,有助于我们加深对AF时离子通道重构机制的认识,从而对AF的药物治疗有一定的指导意义。
CIBISⅡ试验(cardiac insufficiency bisoprolol study)表明比索洛尔可显著地降低心衰患者病死率和猝死率[13]。这些数据充分表明,比索洛尔作为β1选择性受体阻滞剂,它在心衰治疗中抗心律失常的作用。以往的研究表明β受体阻滞剂有逆转心衰时离子通道重构的作用[14]。我们另一项研究结果显示比索洛尔可以部分逆转心衰时心室肌K+通道重构[12]。在本研究中,比索洛尔可以部分逆转心房肌Ito、IKs、IK1表达下调。这说明比索洛尔对离子通道重构的影响可能是其抗心律失常的机制之一。左房直径与房颤的发生密切相关,而我们的研究发现比索洛尔干预后,左房的直径较心衰时也明显缩小。这说明比索洛尔也能抑制心房结构,这可能也有益于房颤的防治。
心肌细胞离子通道重构受到离子通道磷酸化、神经体液因子、细胞内信号分子等的调节。心力衰竭时β肾上腺素信号通路也发生重构[15,16],与神经体液因子的作用是心肌离子通道重构发生的机制[17]。
本研究发现心力衰竭时心房肌细胞K+通道表达下调可能是心力衰竭时AF发生的离子通道机制。因此在心衰治疗选择药物不仅具有抑制心室重构、改善心肌缺血等作用,也要兼顾到对离子通道的影响。心衰时心房肌离子通道重构与房性心动过速时引起的离子通道重构不一致,对两种病因引起的AF给予不同的防治策略。
[1] Michael G,Xiao L,Qi XY,et al.Remodeling of cardiac repolarization:how homeostatic responses can lead to arrhythmogenesis[J].Cardiovasc Res,2009,81(3):491-499.
[2] Nattel S,Maguy A,Le Bouter S,et al.Arrhythmogenic ion-channel remodeling in the heart:heart failure,myocardial infarction,and atrial fibrillation[J].Physiol Rev,2007,87(2):425-456.
[3] 付新,黄振文.门冬氨酸钾镁治疗心力衰竭并心律失常的临床分析[J].中国心血管病研究,2008,6(12):913-915.
[4] Zicha S,Tsuji Y,Shiroshita TA,et al.Beta-blockers as antiarrhythmic agents[J].Handb Exp Pharmacol,2006,6(171):235-266.
[5] Den Ruijter HM,Berecki G,Verkerk AO,et al.Acute administration of fish oil inhibits triggered activity in isolated myocytes from rabbits and patients with heart failure[J].Circulation,2008,117(4):536-544.
[6] Murgatroyd F,Camm AJ.Atrial arrhythmias[J].Lancet,1993,341(8856):1317-1322.
[7] Kaab S,Nuss HB,Chiamvimonvat N,et al.Ionic mechanism of action potential prolongation in ventricular myocytes from dogs with pacing-induced heart failure[J].Circ Res,1996,78(2):262-273.
[8] Verkerk AO,Wilders R,Coronel R,et al.Ionic remodeling of sinoatrial node cells by heart failure[J].Circulation,2003,108(6):760-766.
[9] Hesse M,Kondo CS,Clark RB,et al.Dilated cardiomyopathy is associated with reduced expression of the cardiac sodium channel Scn5a[J].Cardiovasc Res,2007,75(3):498-509.
[10] Nattel S,Li D,Yue L.Basic mechanisms of atrial fibrillation:very new insights into very old ideas[J].Annu Rev Physiol,2000,62:51-77.
[11] Li D,Fareh S,Leung TK,et al.Promotion of atrial fibrillation by heart failure in dogs:atrial remodeling of a different sort[J].Circulation,1999,100(1):87-95.
[12] Li X,Wang TZ,Han K,et al.Bisoprolol reverses down-regulation of potassium channel of ventricular tissues in heart failure rabbit[J].Journal of Biomedical Research,2011,25(4):274-279.
[13] CIBISⅡInvestigators and Committees.The cardiac insufficiency bisoprolol study Ⅱ(CIBIS-Ⅱ):a randomised trial[J].Lancet,1999,353(9146):9-13.
[14] Cheng J,Niwa R,Kamiya K,et al.Carvedilol blocks the repolarizing K+currents and the L-type Ca2+current in rabbit ventricular myocytes[J].Eur J Pharmacol,1999,376(1-2):189-201.
[15] El-Armouche A,Eschenhagen T.Beta-adrenergic stimulation and myocardial function in the failing heart[J].Heart Fail Rev,2009,14(4):225-241.
[16] 孔一慧,甘润韬,李为民.β受体亚型及其信号通路干预治疗慢性心力衰竭研究进展[J].心血管病学进展,2009,30(1):151-151.
[17] Rosati B,McKinnon D.Regulation of ion channel expression[J].Circ Res,2004,94(7):874-883.

