AB-8树脂纯化柿叶总黄酮的工艺研究
马燕燕,鲁晓翔
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
AB-8树脂纯化柿叶总黄酮的工艺研究
马燕燕,鲁晓翔*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
目的:筛选出分离纯化柿叶总黄酮的最佳树脂,并对影响分离纯化的因素进行研究,得到优化的纯化条件。方法:选用AB-8、ADS-17和D3520三种型号大孔吸附树脂,采用动态吸附-解吸方法,利用分光光度法测定黄酮含量,研究了不同的大孔吸附树脂及其不同的工艺条件对柿叶黄酮分离纯化的影响。结果:实验表明AB-8树脂的分离效果最好,其最佳工艺为:上柱液pH6,上柱液流速2BV/h,样液浓度为3mg/mL,70%乙醇为洗脱液,洗脱液流速控制在2BV/h,洗脱液用量为3BV。在此条件纯化后,柿叶黄酮提取物中黄酮含量由9%提高到34%。结论:AB-8大孔树脂可以较好地分离纯化柿叶黄酮。
柿叶,总黄酮,大孔吸附树脂,分离纯化
柿属植物在我国大约有40余种,以柿最为常见,分布十分广泛。柿叶[1-3]是柿的新鲜或干燥叶片,其味苦,具有止血、清热解毒、抗癌等多种医疗保健功能。柿叶的主要有效成分是黄酮类化合物,目前已发现的柿叶黄酮类化合物有黄芪苷、杨梅树皮苷、异槲皮素[4]、山萘酚、槲皮素、卢丁、金丝桃苷[5]。在我国,柿叶主要制成柿叶茶,但大多数柿叶却被当作废物扔掉,所以提高柿叶的利用率是研究的一个目标。大孔吸附树脂是一类不溶于酸、碱及各种有机溶剂且有较好吸附性能的有机高聚物吸附剂,具有物理化学稳定性高、吸附容量大、选择性好、再生处理方便等诸多优点,尤其适用于黄酮类化学物的分离纯化[6-8],近年来逐渐被应用于中草药化学成分的分离纯化。本实验选择三种树脂(AB-8、ADS-17和D3520),进行对柿叶中黄酮的吸附与分离性能的研究。
1 材料与方法
1.1 材料与仪器
柿叶 采于天津蓟县,洗净、干燥后粉碎成粉,过40目筛;芦丁标准品 国药集团化学试剂有限公司;AB-8、ADS-17、D3520型大孔树脂 南开大学化工厂。
RE-52A旋转蒸发器 上海亚荣生化仪器厂;UV-1700紫外可见分光光度计、AUY120电子分析天平 岛津;FD-1冷冻干燥机 郑州长城科工贸有限公司;CXG-1电脑恒温层析柜 上海沪西分析仪器厂有限公司。
1.2 实验方法
1.2.1 大孔吸附树脂预处理 树脂预处理:树脂使用前预处理可以除去其中所含的低聚物、有机物及有害离子。首先将大孔吸附树脂浸泡在95%乙醇中24h,充分溶胀,用乙醇清洗至流出液加适量蒸馏水无混浊。再用蒸馏水洗尽乙醇,树脂装柱后,用5% HCl溶液以2BV/h流速酸洗,蒸馏水洗至中性;用5%NaOH溶液以2BV/h流速碱洗,用水冲洗至中性,树脂备用。
1.2.2 样品的制备方法 称取一定量柿叶样品,以70%乙醇做溶剂,按固液比1∶30加入70%乙醇,于50℃水浴器中提取2次,每次2h,合并提取液,减压浓缩,冷冻干燥。
1.2.3 大孔吸附树脂对柿叶黄酮的静态吸附和解吸实验
1.2.3.1 静态吸附和解吸实验 取3份浓度为1mg/mL的样品液各20mL装入50mL三角瓶中,分别加入3种型号的树脂各1g,室温置于摇床上振荡6h。将充分吸附后的树脂过滤,置于50mL三角瓶中,再用70%的乙醇解吸,室温置于摇床上振荡6h,测定吸附前后样液的黄酮浓度,选出吸附率和解吸率都好的树脂;同时考察吸附温度和吸附pH对静态吸附的影响。按式(1)、式(2)计算树脂吸附率和解吸率。
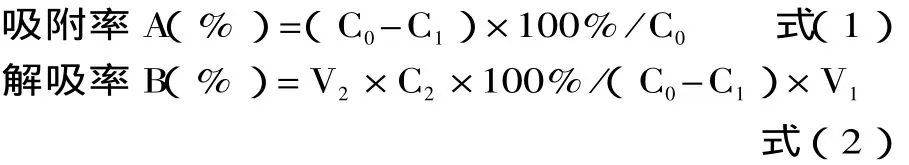
其中:A为吸附率(%)、B为解吸率(%);C0为起始浓度、C1为平衡浓度、C2为解吸液浓度(mg/mL);V1为吸附液体积、V2为解吸液体积(mL)。
1.2.3.2 静态吸附动力学曲线 称取10.0g AB-8湿树脂于500mL三角瓶中,加入黄酮浓度为1mg/mL的样液200mL,室温置于摇床上,振荡12h,每小时定时取样2.5mL,测定吸附余液黄酮的浓度,计算吸附率。
1.2.4 大孔树脂对柿叶黄酮的动态吸附和解吸 将预处理好的AB-8树脂湿法装入(1cm×40cm)玻璃层析柱中,将柿叶黄酮提取液上柱,对上样流速、浓度、洗脱液浓度及流速等进行动态吸附与解吸实验。实验中待样液全部通过树脂柱后,用去离子水洗至流出液无色,再用不同浓度的乙醇以一定速度洗脱,收集洗脱液,测定总黄酮含量。
1.2.5 总黄酮的测定方法 以芦丁为对照品,采用三氯化铝比色法[9]。
标准曲线绘制:精确称取一定量经干燥至恒重的芦丁标准品,用30%乙醇配制0.1mg/mL的芦丁标准溶液。分别量取芦丁标准液0.0、1.0、2.0、3.0、4.0、5.0mL于6个25mL容量瓶中,各加入1%AlCl3溶液10mL,用30%乙醇定容至25mL,静置15min。在416nm处,以零管作参比,测定各组溶液的吸光度值,并以吸光度值(A)为纵坐标,芦丁浓度(mg/mL)为横坐标,绘制标准曲线,如图1所示,求得回归方程为y=27.757x+0.0028,R2=0.9999。在相同条件下测定各样品的吸光度,并由式(3)计算样品的黄酮得率。
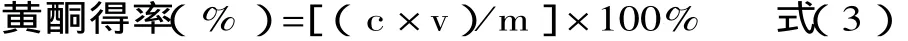
式中:c为提取液总黄酮的浓度(mg/mL);v为提取液的总体积(mL);m为样品的质量(mg)。

图1 芦丁对照品标准曲线
1.2.6 数据统计 实验数据用Excel统计软件进行分析统计。
2 结果与分析
2.1 大孔吸附树脂的静态吸附实验结果
2.1.1 不同树脂对柿叶黄酮的吸附率及解吸率 由图2可以看出,ADS-17树脂的吸附率太低,AB-8、D3520树脂都具有较大的吸附率和解吸率,而且比较接近,从价格上考虑,本实验确定AB-8树脂为实验用树脂。

图2 三种树脂对柿叶黄酮的吸附率及解吸率
2.1.2 AB-8树脂对柿叶黄酮的静态吸附动力学特性实验结果 合适的吸附树脂除了具有较大的吸附容量、吸附率和解吸率外,同时还要有较快的吸附速率。实验对AB-8树脂进行吸附动力学实验,结果如图3所示。

图3 AB-8树脂的静态吸附动力学曲线
从图3可以看出,AB-8树脂对柿叶黄酮的吸附为快速平衡型,在5h后基本达到平衡,起始阶段的吸附量都较大,但总体上来看,AB-8型树脂对柿叶黄酮具有良好的吸附动力学特性。综上分析可知,AB-8树脂对柿叶黄酮具有良好的吸附解吸特性,适合柿叶黄酮的分离纯化。
2.1.3 AB-8树脂对柿叶黄酮的静态吸附结果
2.1.3.1 吸附温度的影响 不同的温度下树脂对柿叶黄酮吸附率的影响,结果如图4所示。
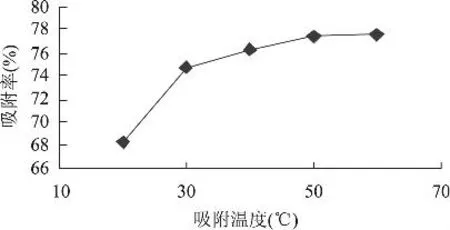
图4 吸附温度对柿叶黄酮吸附率的影响
从图4中可以看出,随着吸附温度的升高,吸附率逐渐提高,20℃的吸附率为68.3%,30℃的吸附率为74.7%,40℃的吸附率为76.3%,可见30℃之后,吸附率随温度升高就不再明显,且温度越高对实际生产而言成本也就越大。综合考虑选择30℃作为吸附温度。
2.1.3.2 吸附pH的影响 不同pH条件对树脂吸附柿叶黄酮的影响,结果如图5所示。

图5 吸附pH对柿叶黄酮吸附率的影响
从图5可以看出,pH对吸附率的影响不明显,柿叶黄酮提取液自身的pH为6,在此条件下的吸附率也较高,考虑到实际操作难易,实验选择提取液自身的pH条件。
2.2 AB-8树脂对柿叶黄酮的动态吸附结果
2.2.1 上样流速的影响 通过调节流速对上柱样液进行吸附流速的选择,上样浓度均为3mg/mL,制流速分别为1、2、3、4、5BV/h,进行动态吸附,五种流速下的吸附率如图6所示。
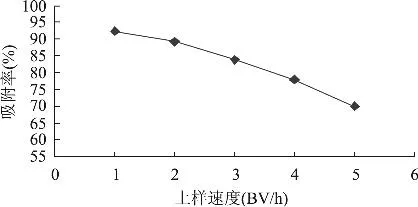
图6 上样速度对柿叶黄酮吸附率的影响
由图6可知,流速为1BV/h时吸附率最大,但是1BV/h的流速因为过慢,上样时间长,导致循环周期延长,并且由计算得出流速为1BV/h与流速为2BV/h时的漏点分别出现在26mL和22mL,两者相差不大,所以选择2BV/h的流速比较合适。
2.2.2 上样浓度的影响 通过调节上柱样液浓度分别为1、2、3、4、5mg/mL,进行吸附浓度的选择,控制流速为2BV/h进行动态吸附,五种吸附浓度下的吸附率如图7所示。
由图7可知,随着上样浓度的增加,吸附率也不断增大,当上样浓度达到3mg/mL时变化很小,且浓度越大越容易出现沉淀,所以选择上样浓度为3mg/ mL比较合适。
2.2.3 洗脱液浓度的影响 分别用 40%、50%、60%、70%、80%的乙醇溶剂进行洗脱,解吸流速控制为2BV/h,分别将各次洗脱的组分合并,然后测定它们的吸光度,计算解吸率,结果见图8所示。

图7 上样浓度对柿叶黄酮吸附率的影响
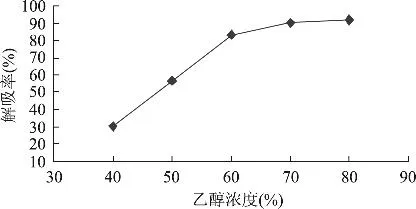
图8 乙醇浓度对柿叶黄酮吸附率的影响
由图8可以得出,以80%乙醇和70%乙醇洗脱效果最好,且比较接近,其次为60%的乙醇。综合考虑解吸率和原料节省,选择70%的乙醇作为洗脱剂较好。
2.2.4 洗脱流速的影响 在确定洗脱剂的最佳浓度后,还需要对洗脱流速进行确定,用70%的乙醇洗脱,控制流速分别为1、2、3、4、5BV/h,进行动态解吸,五种洗脱流速下的解吸率如图9所示。

图9 洗脱流速对柿叶黄酮吸附率的影响
由图9可以看出,以1BV/h和2BV/h的流速进行洗脱得到的解吸率均较高,为了缩短循环周期,选择流速较大的2BV/h为宜。
2.3 AB-8树脂对柿叶黄酮的动态解吸曲线
将3mg/mL的上样液加入到预处理好的AB-8树脂柱中,按上述确定的吸附洗脱条件进行动态吸附和洗脱。分段收集洗脱液,测定吸光度,绘制洗脱曲线,结果见图10。
由图10可知,在此条件下洗脱曲线峰窄,且没出现拖尾现象。当洗脱剂体积为40mL时,乙醇洗脱液中总黄酮含量最高,故确定洗脱液体积为80mL(约3BV)。

图10 流出液体积与吸光度的关系图
3 结论
通过对所选三种树脂对柿叶黄酮的吸附与解吸性能的研究,筛选出AB-8树脂为理想的柿叶黄酮分离纯化的树脂,其吸附率为70.9%,解吸率为93.3%,吸附5h达到平衡。AB-8树脂在30℃下对柿叶黄酮吸附分离的最佳工艺参数为:上柱液pH为6,上柱速度2BV/h,上样浓度为3mg/mL,以70%乙醇为洗脱液控制洗脱液流速2BV/h,洗脱剂用量3BV。在此条件下,柿叶黄酮的含量由9%提高到34%,说明AB-8树脂可有效地分离纯化柿叶黄酮。
[1]谭仁祥.植物成分分析[M].北京:科学出版社,2002:486-502.
[2]江苏新医学院.中药大辞典(下册)[M].上海:上海科学技术出版社,1986:1526-1527.
[3]吴小南,汪家梨.柿叶茶抗氧化、降血脂保健作用的初步实验[J].食品科学,1998,19(11):39-41.
[4]盛敬伟,徐萍,李学林.柿叶的药用[J].河南中医药学刊,1995,10(6):24,33.
[5]郭玟,董晓萍,徐文萍.柿叶的研究概况[J].甘肃中医学院学报,2000(S1):164-166,132.
[6]何伟,李伟.大孔树脂在中药成分分离中的应用[J].南京中医药大学学报,2005,21(2):134-136.
[7]郁建生.大孔吸附树脂分离纯化野菊花总黄酮[J].中国中药杂志,2007(20):21-23.
[8]向大雄,李焕德,朱叶超,等.大孔吸附树脂分离纯化葛根总黄酮的研究[J].中国药学杂志,2003,38(1):35.
[9]田金河,曾庆孝,杨程芳.黄酮含量的比较研究[J].粮油加工与食品机械,2003(11):60-62.
Separation and purification process of total flavonoids from persimmon leaf with AB-8 resin
MA Yan-yan,LU Xiao-xiang*
(Biotechnology and Food Science College,Tianjin University of Commerce,Tianjin Key Laboratory Food of Biotechnology,Tianjin 300134,China)
Objective:To choose the optimum resin for separation and purification of persimmon leaf flavonoids and analyze influenceable factors of separation and purification process.Methods:Three macroporous resins including AB-8,ADS-17and D3520 were used for separation of total flavonoids from persimmon leaf.During the adsorption and desorption process,with UV to assay total flavonoids,the different macroporous resins and their capacities were studied.Results:AB-8 resin possesses had much higher adsorption and desorption capacity.The optimum conditions were:the pH value of sample 6,current velocity 2BV/h,concentration of sample 3mg/mL,70%alcohol as eluant for desorption,current velocity 2BV/h and eluant volume 3BV.An enriched total flavonoids extract with 34%purity can be separated from crude persimmon leaf extrac(tabout 9%purity)in this way.Conclusion:lt is feasible to separate and purify persimmon leaf flavonoids with AB-8 resin.
persimmon leaf;flavomoids;macroporous resin;separation and purification
TS201.1
B
1002-0306(2011)01-0243-04
2010-01-14 *通讯联系人
马燕燕(1985-),女,在读硕士,研究方向:食物资源研究与开发。

