活性炭纤维对水中敌草隆的吸附性能*
徐建华 孙亚兵** 冯景伟 朱 艳
(1.污染控制与资源化国家重点实验室,南京大学环境学院,南京,210046;2.合肥工业大学,土木与水利工程学院,合肥,230009)
活性炭纤维对水中敌草隆的吸附性能*
徐建华1孙亚兵1**冯景伟2朱 艳2
(1.污染控制与资源化国家重点实验室,南京大学环境学院,南京,210046;2.合肥工业大学,土木与水利工程学院,合肥,230009)
探讨了活性炭纤维对水中敌草隆的吸附.结果表明,在pH=2.9时,吸附量最大;活性炭纤维的吸附能力随着温度的升高而升高;Redlich-Peterson方程更适合描述敌草隆的吸附行为;Gibbs自由能(ΔG0)值小于零,说明此吸附过程是自发进行的吸附过程;假二级方程更适用于描述活性炭纤维对水中敌草隆的吸附动力学过程.
活性炭纤维,吸附,敌草隆.
除草剂在农业中被广泛使用,而由此所引起的除草剂污染也已成为人们日益关注的焦点.除草剂及其自然降解所产生的副产物不仅能杀灭病原体和害虫,还使得许多生物和植物受到威胁,严重破坏了生态平衡[1-2].敌草隆是一种内吸性传导作用和触杀作用的除草剂,已被广泛应用40多年.作为一种苯基脲除草剂,敌草隆具有高度的持久性.加之溶解度低,化学性质稳定,它会慢慢渗入地下从而污染饮用水源[3-4].
许多学者研究发现,敌草隆的降解产物具有更强的毒副作用,3,4-二氯苯胺便是其中的一种,它还会被进一步降解为偶氮苯衍生物[4-6].从这个角度而言,吸附法显示出了自身独有的优势.
本文以活性炭纤维为吸附剂,经煮沸、水洗后对水中敌草隆进行吸附研究.探讨了溶液pH、吸附剂量和温度对活性炭纤维吸附水中敌草隆的影响,并通过对相关数据进行非线性拟合,进一步研究了该吸附过程的热力学和动力学.
1 实验部分
1.1 实验材料及仪器
主要试剂和材料:盐酸(AR级,购自南京化学试剂有限公司);氢氧化钠(AR级,购自天津金汇太亚化学试剂有限公司);活性炭纤维(ST1300,购自南通森友炭纤维有限公司);敌草隆(纯度99.5%,购自Sigma公司),其结构式如下:

主要仪器和设备:FA1604电子天平(上海楚定分析仪器有限公司);pHS-3C酸度计(常州翔天实验仪器厂);TS-211B摇床(常州诺基仪器有限公司);UV751GD紫外/可见分光光度计(成都一科仪器设备有限公司);HJ-3数显恒温磁力搅拌器(国华电器有限公司).
1.2 实验方法
(1)活性炭纤维的预处理
先将活性炭纤维剪成1 cm×1 cm的片状,然后用蒸馏水煮沸2 h,并用蒸馏水洗涤3次,以去除残留在活性炭纤维中的有机和无机杂质.洗净的活性炭纤维放入电热恒温鼓风干燥箱于105℃干燥48 h,装入密封袋置于干燥器中备用.
(2)模拟溶液的选择
所研究对象为模拟被敌草隆污染了的地表水.由于敌草隆不溶于水,25℃时在水中的溶解度仅为42 mg·L-1[7].所以,为使模拟溶液更加贴近实际的地表污染水,故将其浓度定为(20 ±0.1)mg·L-1,且将pH值调整为6.4.
(3)pH值对吸附的影响
分别取9份100 mL(20±0.1)mg·L-1敌草隆溶液于250 mL锥形瓶中,用盐酸和氢氧化钠溶液将其pH 值依次调至 2.1、2.9、4.1、6.4、7.0、10.0、10.4、11.1、12.0,并分别加入(14.5 ±0.1)mg 活性炭纤维,在298 K,150 r·min-1的条件下,振荡2 h至吸附平衡,用0.45 μm的微孔滤膜过滤后,测定其平衡浓度.
(4)吸附等温线的测定
称取不同质量的活性炭纤维(2.6—14.6 mg)分别投入盛有100 mL(20±0.1)mg·L-1敌草隆溶液的250 mL锥形瓶内,在298 K、308 K和318 K 3个不同温度下振荡2 h至吸附平衡,然后采用0.45 μm的微孔滤膜过滤后,测定其平衡浓度.
活性炭纤维吸附敌草隆的平衡吸附量(qe)根据式(1)计算:

吸附率(AE)通过式(2)计算:

其中C0和Ce分别为溶液中敌草隆的初始浓度和吸附平衡浓度(mg·L-1),V为溶液体积(L),W为活性炭纤维的质量(g).
(5)吸附动力学研究
分别称取(14.5±0.1)mg活性炭纤维置于若干个250 mL锥形瓶中,然后分别加入100 mL(20±0.1)mg·L-1敌草隆溶液,在298 K、308 K 和318 K 3 个不同温度下振荡反应,在 5 min、10 min、15 min、20 min、30 min、40 min、50 min、60 min、90 min、120 min 取样,分别采用0.45 μm 的微孔滤膜过滤后,测定其平衡浓度.
2 结果与讨论
2.1 活性炭纤维的表征
相比活性炭而言,活性炭纤维具有更高的吸附动力学和吸附容量,这主要归因于两者孔隙结构的差异[8].活性炭微孔与中孔、大孔交互连接后才与外表面相通.据图1显示,活性炭纤维的微孔几乎直接与外表面相通[3],所以吸附分子无需克服中孔和大孔的扩散阻力而直接到达微孔的吸附位点,从而大大提高了活性炭纤维的吸附速率和吸附容量.

图1 活性炭纤维的电镜图Fig.1 The SEM images of ACF
从表1可以看出,活性炭纤维具有较大的比表面积和孔径,这也进一步印证了活性炭纤维具有较高吸附容量.

表1 活性炭纤维的主要性能表征Table 1 Main characteristics of ACF
2.2 吸附平衡时间的确定
敌草隆微溶于水且具有较大的偶极矩,因此可以通过疏水性和范德华力之间的相互作用而强烈吸附到疏水性的碳表面.除此之外,敌草隆自身苯环所具有的高电子密度也增强了色散力的作用[9].从图2可以看出,敌草隆的前期吸附速率较快,随着时间的推移逐渐达到平衡,平衡时间为2 h.
2.3 pH对吸附的影响
溶液pH是影响吸附过程的重要参数,对吸附剂表面化学性质、吸附质在溶液中的存在形态及溶液的化学属性都有较大的影响,从而使吸附剂与吸附质之间的作用发生变化[10].
图3给出了不同pH值条件下吸附量的变化曲线.由图3可知,pH=2.9时,活性炭纤维对水中敌草隆的吸附量最大.当溶液pH小于或大于这个值时,吸附量都会减小.这主要是由于活性炭纤维表面化学性质造成的.当pH<2.9时,敌草隆分子及活性炭纤维表面呈正电性,因此,静电力占主导作用;在pH=2.9时,敌草隆分子及活性炭纤维表面呈电中性,因此非静电力占主导作用使得吸附量达到最大;当pH>2.9时,敌草隆分子和活性炭纤维表面开始呈现电负性,使得非静电力的主导作用逐渐减弱,从而导致吸附量逐渐降低[11].

图2 时间对活性炭纤维吸附水中敌草隆的影响Fig.2 The effect of time on adsorption of diuron on ACF
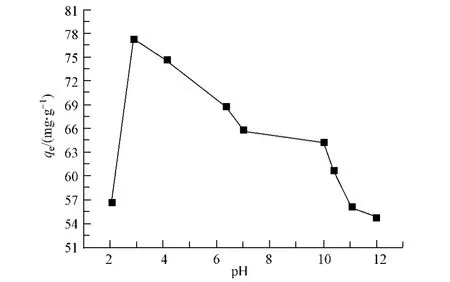
图3 pH对活性炭纤维吸附水中敌草隆的影响Fig.3 The effect of pH on adsorption of diuron on ACF
2.4 吸附等温线
采用Langmuir、Freundlich及Redlich-Peterson等温方程对298K、308K和318K下的平衡数据进行非线性拟合,拟合所得的参数见表2.其中Redlich-Peterson等温方程是由Redlich和Peterson结合Langmuir和Freundlich等温式提出的[12],其表达式如下:

其中,KL为 Redlich-Peterson 常数(L·g-1);α 为 Redlich-Peterson 常数(L·mg-1);β 为 Redlich-Peterson常数.
通过比较拟合相关系数R2,很容易发现Redlich-Peterson吸附等温方程更适合描述活性炭纤维对水中敌草隆的吸附过程.这表明活性炭纤维吸附位点的能量分布是指数型而非统一的形式,在这种情况下,一些位点是高能量位点,对敌草隆的吸附能力强,而另一些则相对比较弱,活性炭纤维对水中敌草隆的吸附更倾向于多分子层吸附.
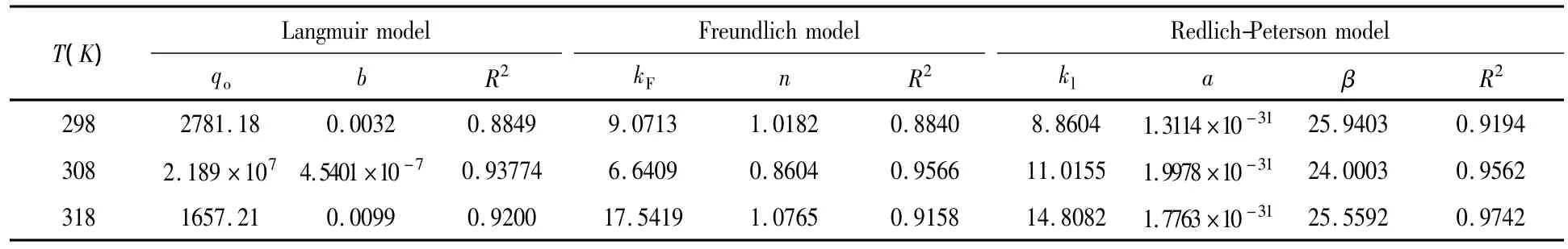
表2 不同温度下等温吸附方程的参数Table 2 Parameters of isotherm adsorption equations at different temperatures
2.5 吸附热力学
298 K、308 K和318 K时,活性炭纤维对水中敌草隆的吸附等温线如图4所示.由图4可知,活性炭纤维对敌草隆的平衡吸附量随溶液温度的升高而升高,表明敌草隆在活性炭纤维上的吸附为吸热反应.这主要归因于:活性炭纤维内部存在微孔,吸附剂的吸附和解吸过程都必须通过这些微孔才能达到吸附或解吸的效果.虽然吸附达到平衡,但仍有部分微孔吸附位点未被占据,升高温度,填补了吸附剂在这些位点上的吸附空白,与此同时,温度的升高也会令某些吸附位点发生解吸作用,但由于解吸下来的敌草隆分子受到微孔的阻挡作用,从而使得解吸效果表现得不明显.
此吸附过程的热力学参数ΔH0和ΔS0可通过式(4)计算[13]:

其中,ΔS0和 ΔH0分别为吸附熵变(J·mol-1K-1)和吸附焓变(J·mol-1),T 是绝对温度(K),R 是通用气体常数(8.314 J·mol-1K-1).在不同的温度下(298 K、308 K、318 K),根据不同的固定吸附由 Redlich-Peterson方程计算相应的平衡浓度.ΔS0和ΔH0可由lnCe对1/T作出的斜率和截距求得,如图5所示.线性方程的相关系数 (R2)分别为 0.9194、0.9562 和0.9742.根据 Gibbs方程(ΔG0= ΔH0-TΔS0),ΔS0和ΔH0的值用来计算固定温度下的ΔG0.相应的热力学参数见表3.

图4 温度对活性炭纤维吸附水中敌草隆的影响Fig.4 Effect of temperature on adsorption of diuron on ACF

图5 lnCe与1/T的拟合线Fig.5 Plot of lnCevs.1/T

表3 不同平衡吸附量、不同温度下的吸附热力学参数Table 3 Thermodynamic parameters evaluated at different equilibrium adsorption amounts and temperatures
由表3可以看出,吸附自由能变化(ΔG0)为负值,说明上述吸附过程是自发进行的.对于同样平衡吸附量的情况下,随着温度的升高,吸附自由能变化的绝对值变大.这说明当温度较高的情况下,化学吸附的作用愈加明显.
2.6 吸附动力学
采用假一级方程 Lagergren-first-order及假二级 Pseudo-second-order动力学方程分别对 298 K、308 K和318 K下的吸附数据进行origin非线性拟合,结果如图6和表4所示,利用假二级Pseudo-second-order动力学方程对所得数据进行非线性拟合,所得的相关系数R2均高于0.99,而且,从假二级方程计算得到的qe与实验得到的qe非常接近,以上结果表明活性炭纤维对水中敌草隆的吸附符合假二级方程.

图6 活性炭纤维吸附敌草隆的吸附动力学模型(a)假一级动力学模型;(b)假二级动力学模型Fig.6 Adsorption kinetic models of diuron onto ACF

表4 水中敌草隆在活性炭纤维上的吸附动力学拟合参数Table 4 Parameters of two kinetic models for adsorption of diuron onto ACF
3 结论
(1)pH对活性炭纤维吸附水中敌草隆有明显的影响,且在pH=2.9时,吸附量最大.
(2)活性炭纤维吸附水中敌草隆的吸附能力随着温度的升高而升高,且Redlich-Peterson方程更适合描述敌草隆在活性炭纤维上的吸附行为.
(3)Gibbs自由能(ΔG0)值小于零,说明此吸附过程是自发进行的吸附过程.
(4)假二级方程更适用于描述活性炭纤维对水中敌草隆的吸附动力学过程.
[1]Polcaro A M,Mascia M,Palmas S,et al.Electrochemical degradation of diuron and dichloroaniline at BDD electrode[J].Electrochimica Acta,2004,49(4):649-656
[2]Gilliom R J.Pesticides in U.S.Streams and Groundwater[J].Environmental Science & Technology,2007,41(10):3408-3414
[3]MacounováK,Krysová H,Ludvík J,et al.Kinetics of photocatalytic degradation of diuron in aqueous colloidal solutions of Q-TiO2particles[J].Journal of Photochemistry and Photobiology A:Chemistry,2003,156(1/3):273-282
[4]Tomlin C D S(Ed.).The Pesticide Manual,eleventh ed[M].Farnham:British Crop Protection Council,1997:443
[5]Esposito E,Paulillo S M,Manfio G P.Biodegradation of the herbicide diuron in soil by indigenous actinomycetes[J].Chemosphere,1998,37(3):541-548
[6]Tixier C,Bogaerts P,Sancelme M,et al.Degradation products of a phenylurea herbicide,diuron:Synthesis,ecotoxicity,and biotransformation[J].Environmental Toxicology and Chemistry,2001,20(7):1381-1389
[7]Fontecha-Cámara M A,López-Ramón M V,Pastrana-Martínez L M,et al.Kinetics of diuron and amitrole adsorption from aqueous solution on activated carbons[J].Journal of Hazardous Materials,2008,156(1/3):472-477
[8]Inagaki M,New Carbons.Control of Structure and Functions[M].Amsterdam:Elsevier,2005(Chapter 5)
[9]Moreno-Castilla C.Adsorption of organic molecules from aqueous solutions on carbon materials[J].Carbon,2004,42(1):83-94
[10]Radovic L R.Surface chemistry of activated carbon materials:state of the art and implications for adsorption//Schwarz J A,Contescu C I(Eds.),Surfaces of Nanoparticles and Porous Materials[M].NewYork:Marcel Dekker,1999:529-565
[11]Fontecha-Cámara M A,López-Ramón M V,Álvarez-Merino M A,et al.Effect of surface chemistry,solution pH,and ionic strength on the removal of herbicides diuron and amitrole from water by an activated carbon fiber[J].Langmuir,2007,23(3):1242-1247
[12]Redlich O,Peterson D L.A useful adsorption isotherm[J].J Phys Chem,1959,63(6):1024
[13]Lagergren S.About the theory of so-called adsorption of soluble substances[J].Kungliga Svenska Vetenskapsakademiens Handlingar,1898,24(4):1-39
DIURON ADSORPTION FROM AQUEOUS SOLUTIONS ONTO ACTIVATED CARBON FIBER
XU Jianhua1SUN Yabing1FENG Jingwei2ZHU Yan2
(1.State Key Laboratory of Pollution Control and Resource Reuse,School of the Environment,Nanjing University,Nanjing,210093,China;2.School of Civil Engineering of Hefei University of Technology,Hefei,230009,China)
This study explored the adsorption of diuron onto the activated carbon fiber(ACF).The results showed that the maximum adsorption amount was achieved at an optimum pH of 2.9;The equilibrium adsorption amount of diuron on the ACF increased with increasing temperature;The adsorption process could be depicted primely by Redlich-Peterson function;The Gibbs free energy(ΔG0)was below zero,which indicated the adsorption was a spontaneous process;The kinetics data were better fitted with the pseudo-second-order kinetic model.
activated carbon fiber,adsorption,diuron.
2011年3月2日收稿.
*水处理与水环境修复教育部工程研究中心开放基金资助项目(WTWER0709);污染控制与资源化研究国家重点实验室开放基金(PCRRF10016);合肥工业大学博士学位人员专项资助基金 (107-036416,GDBJ2009-027)资助.
**通讯联系人,E-mail:sybnju@163.com

