磺胺甲恶唑和甲氧苄氨嘧啶在土壤中的好氧降解及对微生物呼吸的影响*
巫 杨 陈东辉 SMITH Lester KOOKANA Rai
(1.东华大学环境科学与工程学院,上海,201620;2.上海应用技术学院,上海,200235;3.CSIRO Land and Water,Adelaide,5064,Australia)
磺胺甲恶唑和甲氧苄氨嘧啶在土壤中的好氧降解及对微生物呼吸的影响*
巫 杨1陈东辉2**SMITH Lester3KOOKANA Rai3
(1.东华大学环境科学与工程学院,上海,201620;2.上海应用技术学院,上海,200235;3.CSIRO Land and Water,Adelaide,5064,Australia)
实验研究了抗生素药物在不同土壤中(不同种类以及有无添加牛粪)的降解行为,同时采用基质诱导呼吸法考察了药物在土壤中对微生物呼吸的影响.结果表明,添加牛粪的土壤在前20 d内轻微促进了磺胺甲恶唑的降解效率,磺胺甲恶唑的快速降解主要是微生物作用引起,而甲氧苄氨嘧啶则在好氧条件下表现出较强的持久性.同控制土壤样品对比,药物对土壤微生物呼吸的短暂抑制作用出现在前2 d,随后快速恢复.100 d后,在添加不同浓度,单体或混合物的抗生素土壤中,总的矿化程度无较大差异.这表明2种抗生素的不同浓度,单独或混合的添加方式,100 d后对微生物呼吸造成的影响较小.
磺胺甲恶唑,甲氧苄氨嘧啶,好氧降解,矿化,微生物呼吸.
药物抗生素广泛用于人体和兽药中,许多药物不能被有机体完全代谢,大量未被利用的母体化合物及代谢产物可能通过各种不同的方式进入环境中.自1970年以来,环境中抗生素的相继检出及涉及到的环境风险引起了重视,这些在环境中残留累积的药物可能导致耐药菌的出现,以及越来越多的致病菌分子结构的重组[1-3].磺胺甲恶唑(SMX)是一种在全球广泛使用的磺胺类药物,通常和甲氧苄氨嘧啶(TRM)以5∶1的质量比联用,用来治疗由微生物引起的人体感染.此外,它们也常用作兽药,用来预防和治疗牲畜疾病及用作生长催化剂[4-7].近些年来,许多研究关注于SMX和TRM在不同环境母体中的痕量检测,在众多的污水处理厂、生物固体、沉积物、牲畜粪便、土壤及地下水中已经被相继报道检出[8-10].一些报道指出SMX不容易被生物降解,然而,同样有一些报道指出SMX暴露于碳源和氮源下,在盐性和淡水污泥、河底沉积物中可以得到较大程度降解.同SMX一样,TRM的生物降解也具有高度的变动性,且取决于不同的去除条件[9-10].Gulkowska等人[11]观察到在不同的污水处理厂,TRM的去除效率不同.此外,Gobel等人[12-13]报道了TRM在瑞士某传统的污水处理厂中,初级和二级污水处理过程中没有明显的去除作用,在另外一些污水处理厂中却发现了明显的去除效果.尽管如此,当前对于SMX和TRM在土壤中的环境行为研究报告还较少,含有这些抗生素且处于一定污染水平的动物粪便和生物固体常被用作肥料施于土壤,进而可能对土壤生态系统造成影响.
本文研究目的是为了调查SMX和TRM在3种添加及未添加牛粪的土壤中,在好氧状态下的降解过程,同时对土壤中添加不同浓度水平的SMX及SMX和TRM的混合物可能给微生物呼吸带来的影响进行了评估.
1 材料与方法
1.1 实验药物
实验中所用的SMX、TRM药物购买于Sigma公司.化合物均为分析纯.药物的理化性质如下:SMX分子量为 253.28,lgKow为 0.89,水中溶解度为0.6 g·L-1,pKa为 1.7/5.6.TRM 分子量为290.32,lgKow为 0.91,水中溶解度为0.3— 0.4 g·L-1,pKa为 1.3/7.4.储备溶液均配制溶于甲醇中(分析纯).
1.2 土壤及牛粪
实验所选用的土壤LB、MT和BL分别来自澳大利亚不同区域,取样深度在0—15 cm.所取土样在自然条件下风干并过2 mm筛.土壤的理化性质如表1所示.牛粪收集于澳大利亚当地居民家牛圈(37.8%C,2.3%N,pH 8.19).在使用之前,牛粪在25℃ 下自然风干,然后磨成细碎状.在进行实验之前,通过LC-ESI-MS/MS检测,所选用土壤和牛粪没有发现目标化合物的存在.

表1 实验所用3种土壤的理化性质Table 1 Physiochemical properties of three soils used in the study
1.3 好氧生物降解实验及土壤呼吸基质诱导实验(SIR)
好氧降解实验中,称取5 g土壤或5 g土壤+0.2 g牛粪的土壤放入30 mL的玻璃容器中,土壤湿度被调节到该土壤的最大持水量的60%.SMX和 TRM在土壤中的添加量分别为10 mg·kg-1和2 mg·kg-1.然后将容器敞口放入层流通风橱中,让甲醇得以充分挥发.称重检查并补加水分损失后,将容器盖疏松盖上,放置在(25±3)℃的暗室内并以铝箔纸包住(防止光降解).在整个培养期间,每周打开容器盖子2次,摇晃并鼓入空气,同时检查并补充水分损失.所有的灭菌控制样品在连续3 d内,于121 ℃灭菌室内灭菌30 min.在选定时间间隔内(0、4、10、20、40、60、80、100 d),测定土壤中残留物浓度.在所有实验进行之前,单一土壤和牛粪添加过的土壤均被预培2周.所有样品做3次重复.
为了研究所选药物对微生物呼吸的抑制作用,在好氧状态下,向单一的3种土壤中添加不同浓度的SMX及SMX和TRM的混合溶液,使其在土壤中的浓度分别为10 mg·kg-1SMX、100 mg·kg-1SMX、10 mg·kg-1SMX+2 mg·kg-1TRM、100 mg·kg-1SMX+20 mg·kg-1TRM.在开始实验前,10 g 土壤加入50%的最大持水量的超纯水预先培养2周,然后分别添加SMX和TRM的储备溶液,以达到上述土壤中所需浓度.添加0.1 mL的14C-葡萄糖,额外的碳源D-葡萄糖(2000 μg·g-1)到土壤中,土壤湿度添加到最终60%最大持水量.实验过程中控制样品也包含在内(未加药空白).土壤容器每周打开摇晃鼓入空气一次,并适时补充土壤湿度损失以维持原先状态.土壤在生化培养箱里25℃下进行培养,释放出来的14CO2通过 1 mol·L-1NaOH 吸收液吸收.吸收液采样时间为 0(5 h)、1、2、5、8、15、29、43、71、100 d.每次采样过后,更换新的NaOH吸收槽.实验做3次重复.14CO2用Perkin Elmer液能闪烁计数仪 (Tri-Carb 3110 TR)进行含量测定以比较矿化程度.
1.4 提取和分析方法
样品加入10 mL的混合溶剂(甲醇/EDTA-Mcllvaine 1∶1,pH=4).加盖封紧,将样品涡旋混匀10 s,置于摇床缓慢摇晃10 min,超声10 min.样品在离心机下以3500 r·min-1转速离心10 min,收集上清液,整个提取过程重复3次.最后合并收集到的上清液用超纯水稀释到400 mL.固相萃取柱(Strata X cartridge,polymeric reverse phase,6 mL/200 mg)进行净化富集:Strata X柱使用前用2×3 mL甲醇、2×3 mL超纯水进行预处理,萃取富集后,用2×3 mL超纯水清洗柱壁,然后在真空下干燥15 min,分3次依次加入2 mL、2 mL、1 mL甲醇洗脱柱子,收集洗脱液,在LC-ESI-MS/MS分析进样前,稀释到一定倍数用作药物残留浓度分析.HPLC色谱分离使用Thermo Scientific Surveyor分析仪器.色谱分离柱选用Hypersil ODS-2μm,150 mm×2.6 mm(Thermo Scientific).流动相A为乙腈,流动相B为0.1%甲酸溶于10 mmol·L-1的乙酸铵溶液(1 L).采用的梯度为:A起始于20%,持续3 min,在2 min后增加到50%,再在0.1 min内增加到90%,持续2.9 min,然后在0.1 min内降低到20%,3.9 min用来平衡.流动相速率为0.2 mL·min-1.回收率检测做3次平行.在3种单一土壤和牛粪添加过的土壤中注入1 mg·kg-1或200 μg·kg-1的 SMX、TRM,回收率分别为 SMX(71 ±5)%—(80 ±8)%(干重),TRM(60 ±9)%—(72 ±7)%(干重).
1.5 动力学模型
采用Wang等人[14]建立的调整后的一级动力学模型.此模型公式表达为:

式中,C0和Ct分别为时间0和时间t时对应的浓度.a被称作可用系数,为正值.k为反应速率常数.
目标化合物50%的降解时间(DT50)可用以下公式进行计算:

2 结果与讨论
2.1 SMX和TRM的好氧降解
SMX和TRM的降解过程见图1,好氧降解下的动力学参数如表2所示.
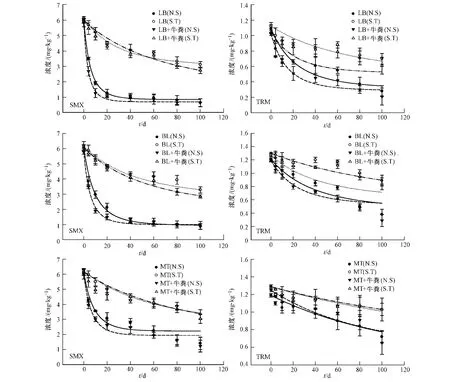
图1 SMX和TRM在土壤中(有无牛粪添加)的好氧降解(N.S=未灭菌,S.T=灭菌)Fig.1 Aerobic degradation of SMX and TRM in soils with and without manure amendment(N.S=Non-sterile,S.T=Sterile)
检测数据表明,在未灭菌的单一土壤或牛粪添加过的土壤中,SMX和TRM的降解速率常数要明显高于灭菌的样品,因此可以推测在这3种土壤中,微生物的活动对药物的降解起到了重要作用.结果和Accinelli等人[15]的研究结果相一致,在其实验中发现了微生物的活动对一组磺胺类药物在土壤中降解的重要性.此实验中看出,SMX和TRM在未灭菌的,牛粪添加过的土壤的降解速率常数 (kSMX=0.1077—0.2401 d-1;kTRM=0.0066—0.0503 d-1)高于未灭菌的,单一的土壤 (kSMX=0.0776—0.1582 d-1;kTRM=0.0053—0.0322 d-1).SMX 和 TRM 在未灭菌,牛粪添加过或未添加过的土壤中,50%的降解时间快慢均遵循以下顺序:LB(8.3%OC)>BL(4.7%OC)>MT(4.0%OC).这说明在好氧降解过程中,有机碳含量的重要性.在土壤中,有机质含量是维持微生物活动的主要来源,它可以增加土壤的松散能力和渗透性,从而给微生物生长繁殖提供更好的条件.此外,数据发现,在未被灭菌的单一土壤和牛粪添加过土壤中,对SMX和TRM的快速降解均发生在前20 d内,然后降解速率放缓.与所有未灭菌样品进行对比发现,SMX和TRM在灭菌过后的对照样品中出现一定程度的浓度下降.因此,非生物降解因素在药物的降解过程中不可忽略,降解过程由生物因素和非生物因素共同作用.在灭菌样品中的药物浓度损失同样也被Yang等人[16]在实验中发现.非生物因素可能涉及到多方面原因.Bialk和Stoob等人[17-18]曾报道了磺胺类药物和有机质的共价健结合,可能导致不可逆的吸附,从而导致生物利用率的降低.此外,土壤中矿物、金属氧化物等都有可能影响到非生物降解.

表2 好氧降解过程中的改进动力学模型的参数Table 2 Fitting results of aerobic degradation using availability-adjusted model
2.2 土壤添加SMX和TRM对微生物呼吸的影响
图2呈现了在3种对比土壤中,添加不同浓度水平的单一SMX、SMX和TRM的混合物对微生物呼吸的影响.研究发现,在前2 d的采样时间内,与空白样品比较,在3种添加药物后的对比土壤中均发生了明显的抑制呼吸效应(矿化效应).2 d后,反抑制效应出现,土壤呼吸能力快速恢复.这与Thiele-Bruhn等人[19]曾指出药物抗生素可能对土壤微生物活性产生暂时选择性抑制的报道相一致.在前2 d内,土壤中的有机碳含量与添加药物而产生土壤呼吸抑制作用相关.在添加了混合药物的沙质土(MT)中,在2 d内引起的土壤呼吸抑制效应显著高于仅添加SMX单体的情况.随着有机碳含量的增加,在BL和LB土壤中,添加混合药物后的抑制效应和仅添加单体SMX的差别已不再明显.2 d后土壤呼吸能力快速恢复,这可能与土壤中母体化合物的生物转化,短时间内SMX及TRM对土壤成分结合能力损失有关.

图2 SMX和TRM在3种土壤中的矿化效应Fig.2 The effect of SMX and TRM on mineralization in three soils
经过100 d后培养,计算了每种土壤总矿化率.数据发现,与空白样品对比,在3种土壤LB、BL、MT中,最大的差异均发生在添加100 mg·kg-1SMX和20 mg·kg-1TRM的土壤,其与空白样品矿化差别分别为(8±1)%、(7±1)%和(5±3)%.由于实验中所用药物剂量均明显高于环境中实际水平,因而在实际环境中的药物残留水平(ng·kg-1—μg·kg-1)[1,20]对土壤微生物呼吸的抑制作用几乎可以忽略.目前SMX和TRM对土壤种群结构的影响研究较少,今后仍然有必要去弄清SMX和TRM对土壤成分带来的变动效应,及土壤中母体化合物及代谢产物在不同作物中的累积效应.
3 结论
本研究一方面关注了SMX和TRM在3种添加和未添加牛粪的土壤中,在好氧条件下的降解行为.实验结果可用改进后的一级动力学模型进行描述,而SMX的降解过程比TRM更符合这个模型.在好氧条件下,微生物活动对于这两种化合物的降解都起到重要的作用.然而由于在灭菌样品中连续的浓度损失,所以非生物因素仍然不可忽视.另一方面,基质诱导呼吸实验发现,与空白样品对比,明显的微生物呼吸抑制作用发生在前2 d内,但100 d后在3种不同土壤中,总的百分比矿化率没有呈现显著差异.将来实验需进一步调查SMX和TRM在牛粪中的降解行为,并考虑不同影响因素.另外,在添加或未添加牛粪的土壤中的药物生物转化途径,以及土壤中土著微生物是否在药物作用下转换成耐性更强的物种仍待研究.
[1]Sarmah A K,Meyer M T,Boxall B A,et al.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics(VAs)in the environment[J].Chemosphere,2006,65(5):725-759
[2]Batt A L,Snow D D,Aga D S,et al.Occurrence of sulphonamide antimicrobials in private water wells in Washington County.Idaho,USA[J].Chemosphere,2006,64(11):1963-1971
[3]Díaz-Cruz M S,Lopez de alda M J,Barceclo D.Environmental behavior and analysis of veterinary and human drugs in soils,sediments and sludge[J].Trends in Analytical Chemistry,2003,22(6):340-351
[4]Xia K,Bhandari A,Dasc K,et al.Occurrence and fate of pharmaceuticals and personal care products(PPCPs)in biosolids[J].J Environ Qual,2005,34(1):91-104
[5]Baquero F,Martinez J L,Canton R.Antibiotics and antibiotic resistance in water environments[J].Current Opinion in Biotechnology,2008,19(3):260-265
[6]Al-Ahmad A,Daschner F D,Kümmerer K.Biodegradability of cefotiam,ciprofloxacin,meropenem,penicillin G and sulfamethoxazole and inhibition of waste water bacteria[J].Arch Environ Contam Toxicol,1999,37(2):158-163
[7]Demoling L A,Baath E,Greve G,et al.Effects of sulfamethoxazole on soil microbial communities after adding substrate[J].Soil Biology& Biochemistry,2009,41(4):840-848
[8]Boxall A B,Fogg L A,Blackwell P A,et al.Veterinary medicines in the environment[J].Rev Environ Contam Toxicol,2004,180,1-91
[9]Pfeifer T,Tuerk J,Bester K,et al.Determination of selected sulfonamides antibiotics and trimethoprim in manure by electrospray and atmospheric pressure chemical ionization tandem mass spectrometry[J].Rapid Communications in Mass Spectrometry,2002,16(7):663-669
[10]Vienoa N,Tuhkanen T,Kronberg L.Elimination of pharmaceuticals in treatment plants in Finland[J].Water Res,2007,41(5):1001-1012
[11]Gulkowska A,Leung H W,So M K,et al.Removal of antibiotics from wastewater by sewage treatment facilities in Hong Kong and Shenzhen,China[J].Water Research,2008,42(1/2):395-403
[12]Gobel A,Thomsen A,McArdell C S,et al.Occurrence and sorption behavior of sulfonamides,macrolides,and trimethoprim in activated sludge treatment[J].Environ Sci Technol,2005,39(11):3981-3989
[13]Gobel A,McArdell C S,Joss A.Fate of sulfonamides,macrolides,and trimethoprim in different wastewater treatment technologies[J].Science of the Total Environment,2007,372(2/3):361-371
[14]Wang Q,Guo M,Yates S R.Dissipation kinetics of manure-derived sulfadimethoxine in amended soil[J].J Agric Food Chem,2006,54(1):157-163
[15]Accinelli C,Koskinen W C,Becker J M,et al.Environmental fate of two sulfonamide antimicrobial agents in soil[J].J Agric Food Chem,2007,55(7):2677-2682
[16]Yang J F,Ying G G,Yang L H,et al.Degradation behavior of sulfadiazine in soils under different conditions.[J]J Environ Sci Health,Part B,2009,44(3):241-248
[17]Bialk H M,Simpson A J,Pedersen J A.Cross-coupling of sulfonamide antimicrobial agents with model humic constituents[J].Environ Sci Technol,2005,39(12):4463-4473
[18]Stoob K,Singer H P,Mueller S R,et al.Dissipation and Transport of Veterinary Sulfonamide Antibiotics after Manure Application to Grassland in a Small Catchment[J].Environ Sci Technol,2007,41(21):7349-7355
[19]Thiele-Bruhn S,Beck I C.Effects of sulfonamide and tetracycline antibiotics on soil microbial activity and microbial biomass[J].Chemosphere,2005,59(4):457-465
[20]Shelvera W L,Hakka H,Larsena G L,et al.Development of an ultra-high-pressure liquid chromatography-tandem mass spectrometry multi-residue sulfonamide method and its application to water,its application to water,manure slurry,and soils from swine rearing facilities[J].Journal of Chromatography A,2010,1217(8):1273-1282
AEROBIC DEGRADATION OF SULFAMETHOXAZOLE AND TRIMETHOPRIM AND EFFECT ON MICROBIAL RESPIRATION IN SOILS
WU Yang1CHEN Donghui2SMITH Lester3KOOKANA Rai3
(1.School of Environmental Science and Engineering,Donghua University,Shanghai,201620,China;2.Shanghai Institute of Technology,Shanghai,200235,China;3.CSIRO Land and Water,Adelaide,5064,Australia)
In this study,the degradation of antibiotics under aerobic conditions in three different soils with and without manure addition was investigated.The effect on microbial respiration in soils was also investigated using substrate-induced respiration.The results showed that manure addition slightly accelerated aerobic degradation of sulfamethoxazole in the first 20 days.Sulfamethoxazole was degraded rapidly mainly through microbial degradation,while trimethoprim was more persistent under aerobic conditions.Obvious respiration suppression by these antibiotics occurred in the first 2 days compared to control soils,but a quick recovery appeared later.There was no significant concentration-dependent inhibition on the total mineralization of soils after spiking with sulfamethoxazole or sulfamethoxazole combined with trimethoprim after 100 days,indicating no influence on microbial respiration regardless of the antibiotic concentrations,single compound or mixture added in soils.
sulfamethoxazole,trimethoprim,aerobic degradation,mineralization,microbial respiration.
2011年4月17日收稿.
*中国教育部-澳大利亚联邦科工组织联合培养博士生项目资助
**通讯联系人,Tel:13341688399;E-mail:chdonghui@163.com

