水体中亚硝酸盐的光降解*
李培峰 李文帅 刘春颖 朱逊驰 张 强
(中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重点实验室,青岛,266100)
水体中亚硝酸盐的光降解*
李培峰 李文帅 刘春颖**朱逊驰 张 强
(中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重点实验室,青岛,266100)
一定浓度的亚硝酸盐溶液经太阳光模拟器照射一定时间后,观测溶液中亚硝酸盐的含量变化.改变溶液条件(介质、pH)和光照条件(时间、光强)等实验条件,同时进行黑暗对照实验,探求影响亚硝酸盐光解的因素和规律.结果表明,在光照的8 h内,时间越长亚硝酸盐的降解率越大,基本符合一级反应动力学曲线;光照强度越大亚硝酸盐的降解程度越大,光照强度分别为765、500、250 W·m-2的条件下,光化学降解一级动力学常数分别为 0.0244 h-1、0.0102 h-1和0.0042 h-1;不同介质中亚硝酸盐降解程度为 Milli-Q 水、去离子水 >人工海水,盐度对亚硝酸盐降解有显著的影响;pH越小越有利于亚硝酸盐光解.光降解产生的一氧化氮(NO)有随亚硝酸盐浓度的增加而增加的趋势.
亚硝酸盐,光降解,水溶液,模拟太阳光,一氧化氮.
本研究利用模拟太阳光,从测定亚硝酸盐的光降解率入手,探讨水体中亚硝酸盐光降解的影响因素;并对NO的产生机制进行了初步的研究.这对探究亚硝酸盐的光降解过程,进一步认识全球氮循环和亚硝酸盐的环境生态效应具有重要意义.
1 材料与方法
1.1 仪器与试剂
Suntest-CPS+太阳光模器(德国ATLAS公司),循环制冷机(日本EYELA),UNICO2000分光光度计(尤尼柯(上海)仪器有限公司),电子分析天平(德国Sartorius赛多利斯),微量进样器(上海安亭微量进样器厂),精密 pH 计,移液枪(20—200 μL,100—1000 μL),Milli-Q 超纯水器(美国 MILLIPORE 公司),比色管(25 mL),采样瓶(无色窄口瓶,美国),0.45 μm醋酸纤维滤膜(上海医药工业研究院).
磺胺(A.R.),N-1-萘乙二胺盐酸盐(A.R.),亚硝酸钠(A.R.),盐酸(A.R.),NaCl(A.R.),MgCl2·7H2O(A.R.).
1.2 天然水样的采集方法
现场用河水或海水冲洗体积为500 mL的玻璃瓶3次,然后将虹吸管插到瓶底让河水或海水注入,取满500 mL水样于玻璃瓶中滴加约0.05 mL饱和HgCl2溶液,迅速密封好,测定前用0.45 μm醋酸纤维滤膜过滤.
1.3 实验方法
实验时将多支装有亚硝酸钠溶液的25 mL比色管竖直放入太阳光模器下方的控温水浴中,水浴温度采用循环水泵来控制,设置程序进行照射,每隔一段时间取3支平行样,测定其中亚硝酸盐的浓度.对照组采用相同的比色管,置于黑暗处.本实验采用萘乙二胺分光光度法测量水中亚硝酸氮的含量.此方法的检出限为 0.02 μmol·dm-3.当亚硝酸盐浓度为 0.5 μmol·dm-3,相对误差为 ±5.0%[10].
2 结果与讨论
2.1 光照时间对亚硝酸盐光降解的影响
用 Milli-Q 水配制大约0.6 μmol·dm-3的亚硝酸盐溶液,在温度为20 ℃,光照强度为 765 W·m-2,pH≈7.0的条件下考察在光照过程中亚硝酸盐浓度的变化,同时进行黑暗对照实验.结果如图1所示.

图1 光照下Milli-Q水溶液中亚硝酸钠浓度随时间的变化Fig.1 Change of NaNO2concentration with time in Milli-Q auqeous solution under simulated sunlight
由图1可见,在光照过程中亚硝酸盐的含量不断减少,光照时间越长亚硝酸盐降解的程度越大,基本符合一级反应动力学曲线.表1为不同光照时间下Milli-Q水溶液中亚硝酸钠的光降解率,照射1 h后光降解率为4.6%,照射8 h后光降解率为18.6%,随着时间的推移,光降解率不断升高,8 h内平均降解速度为0.013 μmol·dm-3·h-1.在相同条件下进行的黑暗实验显示,无光照射下亚硝酸盐的含量几乎没有减小.表明在考察时间范围内,黑暗条件下生物和化学降解对亚硝酸盐不会产生明显的影响.

表1 不同光照时间下Milli-Q水溶液中亚硝酸钠的光降解率Table 1 The degradation rate of NaNO2in Milli-Q auqeous solution under simulated sunlight
2.2 光照强度对亚硝酸盐光降解的影响
用 Milli-Q 水配制大约0.6 μmol·dm-3的亚硝酸盐溶液,在温度为 20 ℃,pH≈7.0,光照强度分别为250、500、765 W·m-2的条件下进行光照实验.不同光照强度下亚硝酸盐的降解情况如图2.
图2显示在相同的光照时间内,亚硝酸钠在不同光照强度下的降解有很大的差别,光强越大,亚硝酸钠降解程度越大.经过765、500、250 W·m-2光照强度的氙灯8 h照射后,亚硝酸钠的含量分别下降了18.6%、10.8%和7.4%.由表2也可以看到光降解率基本都是随着时间的推移而增大,并且各时间段,光降解率基本上符合765 W·m-2>500 W·m-2>250 W·m-2的顺序,3种光强下亚硝酸钠的平均降解速率分别为0.013 μmol·dm-3·h-1、0.008 μmol·dm-3·h-1和0.005 μmol·dm-3·h-1;光化学降解一级动力学常数分别为0.0244 h-1、0.0102 h-1和0.0042 h-1.研究表明,在相同的条件下,光照强度越大,亚硝酸钠的光化学降解越显著.Daniels等[11]和Mark等[9]报道,在碱性溶液中浓度变化与UV强度几乎呈线性相关性,本研究与他们的报道基本一致.

图2 Milli-Q水溶液的亚硝酸钠在不同光强下的浓度变化Fig.2 Change of nitrite concentration with time in Milli-Q aqueous solution under different light intensity

表2 Milli-Q水溶液的亚硝酸钠在不同光强下的光降解率(%)Table 2 The degradation rate of NaNO2in Milli-Q aqueous solution under different light intensity
2.3 不同介质对亚硝酸盐光降解的影响
分别用Milli-Q水、去离子水、人工海水配制浓度约为0.6 μmol·dm-3的亚硝酸钠溶液,在温度为20℃,光照强度为765 W·m-2,pH≈7.0的条件下考察其光解情况(图3).

图3 不同介质中初始浓度为0.6 μmol·dm-3的亚硝酸钠光照下的浓度变化Fig.3 Change of NaNO2concentration with time under the simulated sunlight with an initial concentration of 0.6 μmol·dm -3in different medium
在实验时间内,不同介质中的亚硝酸盐均发生了不同程度的降解.总体来看,在Milli-Q水和去离子水中亚硝酸盐降解程度最大,人工海水中降解最小.在去离子水、Milli-Q水和人工海水3种体系中8 h内的平均降解速率分别为0.013 μmol·dm-3·h-1、0.012 μmol·dm-3·h-1和0.005 μmol·dm-3·h-1,表3为亚硝酸钠在3种介质中的降解率,基本都呈现Milli-Q水、去离子水>人工海水的趋势.可见无机离子对亚硝酸盐光化学降解的影响大于有机物的影响.研究还发现,在没有光照条件下Milli-Q水中亚硝酸盐浓度最稳定,人工海水中亚硝酸盐浓度最不稳定.
同样条件下,对采自青岛市海泊河的表层水及海泊河河口表层海水进行光照实验,其平均降解速率为0.20 μmol·dm-3·h-1和0.023 μmol·dm-3·h-1.可见盐度的改变对亚硝酸盐降解有显著的影响.2.4 pH对亚硝酸盐光降解的影响
用 Milli-Q 水配制约 0.6 μmol·dm-3的亚硝酸钠溶液 3 份,用 0.1 μmol·dm-3的硫酸或氢氧化钠溶液调节 pH 分别为1.5、6.5、9.5,在温度为20 ℃,光照强度为765 W·m-2的条件下,考察各自的光降解情况.不同pH下亚硝酸盐的变化情况如图4所示.
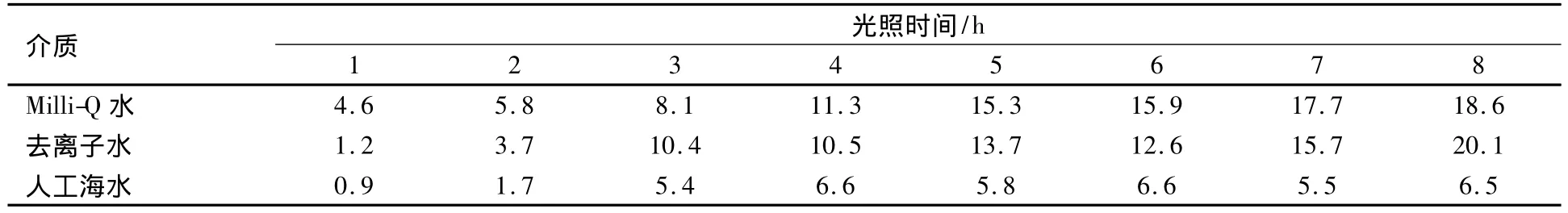
表3 初始浓度为0.6 μmol·dm-3的亚硝酸钠在不同介质中光照后的光降解率(%)Table 3 The degradation rate of NaNO2in different medium under simulated sunlight with an initial concentration of 0.6 μmol·dm -3
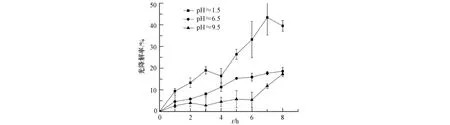
图4 不同pH亚硝酸盐的Milli-Q水溶液的光解规律Fig.4 Change of nitrite concentration with time in Milli-Q aqueous solution of different pH under simulated sunlight
pH值为 1.5、6.5和 9.5的亚硝酸钠溶液,经过 8 h的照射以后,平均降解速率分别为0.023 μmol·dm-3·h-1、0.014 μmol·dm-3·h-1和0.013 μmol·dm-3·h-1.Arakaki等[12]研究发现pH值为1.9时亚硝酸降解后的·OH量子产率约是6.5时的10倍.Ouyang等[13]发现pH值为1.5时,亚硝酸盐溶液基本以亚硝酸的形式存在(98.5%),本研究做了相同条件下的暗实验,发现在黑暗条件下,经过8 h后的降解率为8.7%,而在光照条件下8 h后的降解率为39.5%,亚硝酸自身分解占22%,所观测的是表观光降解率.本研究中pH值为6.5和9.5的亚硝酸钠经过8 h照射后的降解程度差不多,这与Zellner等[3]发现在298 K时在308 nm波长的辐射下pH 4—9溶液中亚硝酸降解后的·OH量子产率是一个常数基本一致,但8 h之内两者出现一定的差异,这需要做进一步的研究.
2.5 对亚硝酸盐光降解产生NO的初步研究
用 Milli-Q 水配制浓度分别为10、50、100 μmol·dm-3的亚硝酸盐溶液,在20 ℃和765 W·m-2强度下光照3 h,用鲁米诺-H2O2体系化学发光法检测NO浓度.此方法使用碳酸盐缓冲溶液制备发光液,当NO的浓度在9.8 ×10-10— 1.4 ×10-12mol·L-1范围内,浓度与相对发光积分值呈线性关系,检出限为3.4 ×10-12mol·L-1[14].检测到的NO浓度见表4.研究表明,在相同条件下,随着亚硝酸盐浓度的增加,光照后产生的NO也随之增加.可以看出亚硝酸盐的光解与释放的NO确实存在一定关系,具体规律还需进一步研究.

表4 Milli-Q水溶液中不同浓度亚硝酸钠光解产生的NO(pmol·L-1)Table 4 Concentrations of NO produced from photo-degradation of different concentrations of NaNO2in Milli-Q water
水体中的亚硝酸盐经太阳光照射后发生一系列复杂的化学反应及副反应(图5)[15],最终转化为激发态或者在光照作用下同样发生一些复杂反应,其中与有关的如图6所示[16].可见硝酸盐和亚硝酸盐在光降解过程中是密不可分的,硝酸盐是重要的光敏剂[15,17].Minero[18]等对河水和湖水表层水的亚硝酸盐降解进行了研究,结果发现光解产物OH-0—60%来自于亚硝酸盐降解,而0—40%来自于硝酸盐的降解.为便于讨论,本研究只观测亚硝酸盐的变化规律,但所观测到的是亚硝酸盐的表观光降解变化.
事实上,亚硝酸盐的光降解受到多种因素的影响,温度、波长和pH等共同影响到亚硝酸盐的光降解及·OH、NO自由基的产生.Zellner等[3]研究表明在308 nm和351 nm辐射下,pH 8的亚硝酸盐溶液·OH的量子产率随温度而指数变化.而对pH 6的亚硝酸盐溶液,随波长从280 mm增加到390 nm,·OH的量子产率逐渐减少[19].因此,对水体中亚硝酸盐的光降解规律应做综合研究,同时对降解的主要产物NO和·OH做实时检测,才能更完整地阐释亚硝酸盐的光降解过程.
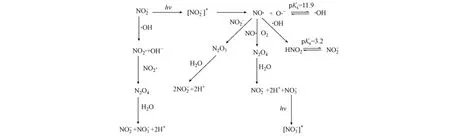
图5 N的光化学反应及副反应Fig.5 Primary photochemical and side reactions during Nphotolysis

图6 N的光化学反应及副反应Fig.6 Primary photochemical and side reactions during Nphotolysis
3 结论
通过改变光照时间、光照强度、溶液介质和pH值等条件研究了亚硝酸盐的降解规律,发现以上条件均能影响亚硝酸盐的降解程度.具体来说,光照时间越长、光照强度越大,亚硝酸盐的光降解率越大;相同时间内不同介质中亚硝酸盐降解程度分别为Milli-Q水、去离子水>人工海水;溶液pH越小,亚硝酸盐的降解程度越大.光降解产生的NO随亚硝酸盐浓度的增加而增加.
[1]Piotr B,Jerzy S,Eulalla O.Oxygen consumption in two aqueous systems:excited nitrite ions-oxygen and nitrite ions-singlet oxygen[J].Photochem Photobiol A,1988,45:269-288
[2]Grätzel V M,Taniguchi S,Henglein A,et al.Pulse radiolytic investigation of the hydrolysis of dirhodan[J].Phys Chem,1970,74:1003-1010
[3]Zellner R,Exner M,Herrmann H.Absolute OH quantum yields in the laser photolysis of nitrate,nitrite and dissolved H2O2at 308 and 351 nm in the temperature range 278—353 K[J].Journal of Atmospheric Chemistry,1990,10:411-425
[4]Zhou X,Mopper K.Determination of photochemically producedhydroxyl radicals in seawater and freshwater[J].Mar Chem,1990,30:71-88
[5]刘春颖,张正斌,邢磊,等.一氧化氮的海洋生物地球化学[J].中国海洋大学学报,2004,34(Sup.):19-22
[6]Zafiriou O C.Geochemical cycles:Laughing gas from leaky pipes[J].Nature,1990,347:6288
[7]Zafiriou O C,McFarland M.Nitric oxide from nitrite photolysis in the central equatorial Pacific[J].Journal of Geophysical Research,1981,86(C4):3173-3182
[8]Zafiriou O C,True M B.Nitrite photolysis in seawater by sunlight[J].Mar Chem,1979,8:9-32
[9]Mark G,Korth H G,Schuchmann H P,et al.The photochemistry of aqueous nitrate ion revised[J].Photochem Photobiol,A,1996,101:89-103
[10]祝陈坚,海水分析化学实验[M].青岛:中国海洋大学出版社,2006:62
[11]Daniels M,Meyers R V,Belardo R V.Photochemistry of the aqueous nitrate systems.1.Excitation in the 300-rap band[J].Phys Chem,1968,72:389
[12]Arakaki T,Miyake T,Hirakawa T,et al.pH dependent photoformation of hydroxyl radical and absorbance of aqueous-phase N(Ⅲ)(HNO2and N)[J].Environ Sci Technol,1999,33:2561-2565
[13]Ouyang B,Dong W B,Hou H Q.A laser flash photolysis study of nitrous acid in the aqueous phase[J].Chemical Physics Letters,2007,402:306-311
[14]丰卫华,刘春颖,杨桂朋,等.化学发光法测定天然海水中一氧化氮[J].海洋学报,待发表
[15]Mack J,Bolton J R.Photochemistry of nitrite and nitrate in aqueous solution:a review[J].Photochem Photobiol,A,1999,128:1-13
[16]Dejam A,Kleinbongard P,Rassaf T,et al.Thiols enhance NO formation from nitrate photolysis[J].Free Radical Biology& Medicine,2003,35(12):1551-1559
[17]刘国光,丁雪军,张学治,等.硝酸根对罗丹明B光解的敏化作用[J].环境化学,2003,22(6):564-567
[18]Minero C,Chiron S,Falletti G.Photochemincal processes involving nitrite in surface water samples[J].Aquat Sci,2007,69:71-85
[19]Fischer M,Warneck P.Photodecomposition of nitrite and undissociated nitrous acid in aqueous solution[J].Phys Chem,1996,100:18749-18756
THE PHOTODECOMPOSITION OF NITRITE IN WATER
LI Peifeng LI Wenshuai LIU Chunying ZHU Xunchi ZHANG Qiang
(Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,College of Chemistry and Chemical Engineering,Ocean University of China,Qingdao,266100,China)
The objective of this study was to investigate the photochemical reactions of nitrite in water.A nitrite solution was illuminated for a period of time under simulated sunlight,and the change of nitrite content in solution was observed.Different conditions of solution,such as concentration,temperature,medium and pH of medium,and conditions of illumination,such as duration,light intensity,and nitrite photodecomposition were discussed.Results showed that the longer illumination the higher the degradation rate of nitrite.First-order reaction kinetics model was found.The stronger light intensity the higher the degradation percentage of nitrite.The first-order kinetic constants for nitrite degradation were 0.0244 h-1,0.0102 h-1and 0.0042 h-1when the light intensity was 765,500 and 250 W·m-2,respectively.In different media,the degree of degradation exhibited the following sequence:Milli-Q,deionized water > artificial seawater.Low pH promoted the degree of nitrite photodecomposition.The concentration of nitric oxide from nitrite photodecomposition showed an increasing trend with the concentration of nitrite.
nitrite,photodecomposition,aqueous solution,simulate sunlight,nitric oxide(NO).
2011年1月29日收稿.
*国家自然科学基金(40706040);山东省中青年科学家科研奖励基金(2007BS08015);山东省自然科学基金(Y2008E04)资助.
**通讯联系人,Tel:0532-66781636;E-mail:roseliu@mail.ouc.edu.cn