对硝基甲苯合成对羟基苯甲醛工艺研究
蒋 琴 陈东初 周 虎
(湖南科技大学化学化工学院,湖南 湘潭 411201)
研究与开发
对硝基甲苯合成对羟基苯甲醛工艺研究
蒋 琴 陈东初*周 虎
(湖南科技大学化学化工学院,湖南 湘潭 411201)
以对硝基甲苯为原料,采用氧化还原、重氮化水解反应,通过改变物料摩尔比、反应时间等工艺参数,研究了合成对羟基苯甲醛的最佳工艺条件。在由对硝基甲苯氧化还原成对氨基苯甲醛及后处理时,易产生大量聚合物,实验主要从减少或消除聚合度以及寻求重氮化过程的最佳工艺条件出发。结果表明,Na2Sx中硫指数为5、乙醇与水的体积比大于1、反应时间为3 h、后处理速度快等可减少大量的聚合物,硫酸与对氨基苯甲醛摩尔比为2.2~2.4:1、酸化时间0.5 h、重氮化时间1~1.5 h时可提高对羟基苯甲醛的收率,由PNT制备PAB时收率可达93.2%,由PAB制备PHB时最高产率为77.1%。
对硝基甲苯;对羟基苯甲醛;聚合
对羟基苯甲醛 (PHB)为白色或淡黄色针状结晶,具有芳香气味,微溶于水,易溶于热水、甲醇、丙酮和乙醚等有机溶剂,在空气中易升华,相对密度为1.129[1]。PHB是重要的有机化工原料,是精细化学品的重要中间体,广泛应用于医药、农药、食品香料和香精、化妆品、电镀、纺织、液晶等领域[2]。随着国内外市场对其要求逐年增长,研究合成PHB的工艺路线有着重要的现实意义[3]。
目前,国内外报道的生产工艺主要有以下几种:对甲酚法、苯酚法、对硝基甲苯(PNT)法、对氨基苯甲醛(PAB)法、对氯苯酚甲酰化法、微生物法和电化学合成法等[4-6]。其中以PNT为原料,经氧化还原、重氮化、水解反应合成PHB和以对甲苯酚为原料,在钴、铜化合物混合催化剂作用下,经纯氧氧化合成PHB这2种生产工艺最值得关注。但是,对甲苯酚所用的起始原料及催化剂价格均较贵,并且催化剂、氧化剂以及设备与安全生产的要求均较高,生产操作复杂[7]。而PNT法具有原料易得、操作简单、产物容易分离提纯、产率高等优点,目前已有少量文献进行了这方面的报道[5,7-10]。但PNT氧化还原合成PAB时易产生大量的聚合物,从而使产品质量和产率均降低。故本研究主要从减少聚合物或聚合程度以及寻求重氮化过程的最佳工艺条件等方面来进行研究。
1 实验部分
1.1 原理
由PNT制备PHB分2步进行[8]。第1步将PNT在多硫化钠的碱性水-乙醇溶液中经氧化-还原反应生成对PAB:
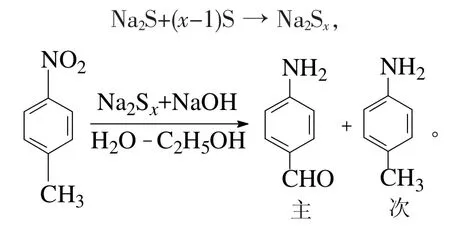
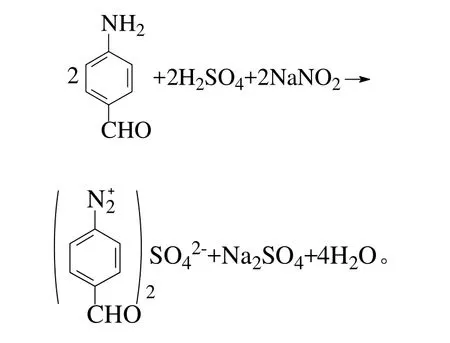
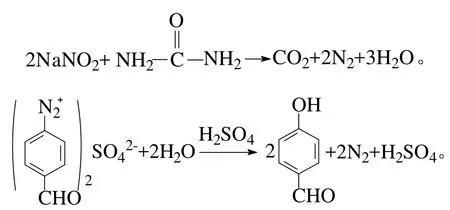
第2步是将PAB经酸化、重氮化及水解作用后生成PHB:
1.2 药品和仪器
1.2.1 实验药品
PNT,质量分数99%;工业酒精;九水硫化钠,硫磺粉,氢氧化钠,N,N-二甲基甲酰胺,亚硝酸钠,脲,乙酸铜,均AR。
1.2.2 实验仪器
JJ-1精密电动搅拌器,DF-Ⅱ集热式磁力搅拌器,D2TW调温电热套;WRS-2微机熔点仪。
1.3 实验步骤
1.3.1 Na2Sx溶液的制备
分别将3.0 g Na2S·9H2O、硫磺粉、2.8 g氢氧化钠投入装有回流冷凝管和搅拌装置的250 mL三口烧瓶中,再加入适量水,搅拌下加热使之溶解,回流反应1 h,再保温0.5 h,制得深红色的Na2Sx溶液,溶液中有极少量悬浮物,将Na2Sx溶液抽滤,备用。
1.3.2 PAB的制备
分别将PNT 6.85 g、乙醇加入250 mL的四口烧瓶中,加热使之溶解,再加入适量的N,N-二甲基甲酰胺,搅拌下升温至适宜温度,在1 h内滴入上述已制好的Na2Sx溶液;滴毕,在此温度下继续反应数小时,加入适量水稀释,迅速安装好水蒸汽冲蒸装置进行水蒸汽冲蒸,同时加热反应液,使冲蒸速度快,冲蒸时间少,当蒸馏温度达到101℃,立即冷却反应物,直至温度达到0~5℃,有大量亮黄色片状物体析出,抽滤得滤饼;将滤液减压蒸馏至晶体析出,抽滤,合并滤饼,真空干燥,称量。
1.3.3 PHB的制备
取一定量的上一步产物PAB、水置于250 mL的四口烧瓶中,加入硫酸,在常温下反映0.5 h左右,冷却至0℃以下,开始滴加质量分数为40%的NaNO2溶液,迅速滴加直至反应液使碘化钾淀粉试纸显蓝色并在5 min内不褪色,在0~5℃下反应1~1.5 h,颜色由深褐色变为土黄色。将另一四口瓶中的少量水溶液加热至沸,加入少量乙酸铜加速水解再将重氮化溶液滴加到瓶中煮沸约0.5 h,再加入少量活性炭煮沸约0.5 h,稍冷却后抽滤;滤液冷至0℃左右,有大量淡黄色结晶析出,抽滤,冰水洗涤,得粗品。将粗品经水重结晶即得成品,熔点为116.3~117.7℃。
2 结果与讨论
2.1 由PNT制备PAB的聚合影响因素
2.1.1 Na2Sx
Na2Sx在反应中既是氧化剂又是还原剂,Na2Sx中的硫能把甲基氧化成醛基,同时过量碱的存在能使伴同生成的H2S、NaSH、Na2S等一起把硝基还原成氨基。
Na2Sx中硫原子的数目(硫指数)对反应影响极大,水溶性的多硫化钠可以为Na2S2到Na2S10等多种[11]。多硫化钠中的硫对PAB的收率有着决定性作用,不同含量的硫指数对产率有不同的影响,其影响见表1(Na2S·9H2O、NaOH和PNT的投加量分别为3.0、2.8 和 6.85 g)。
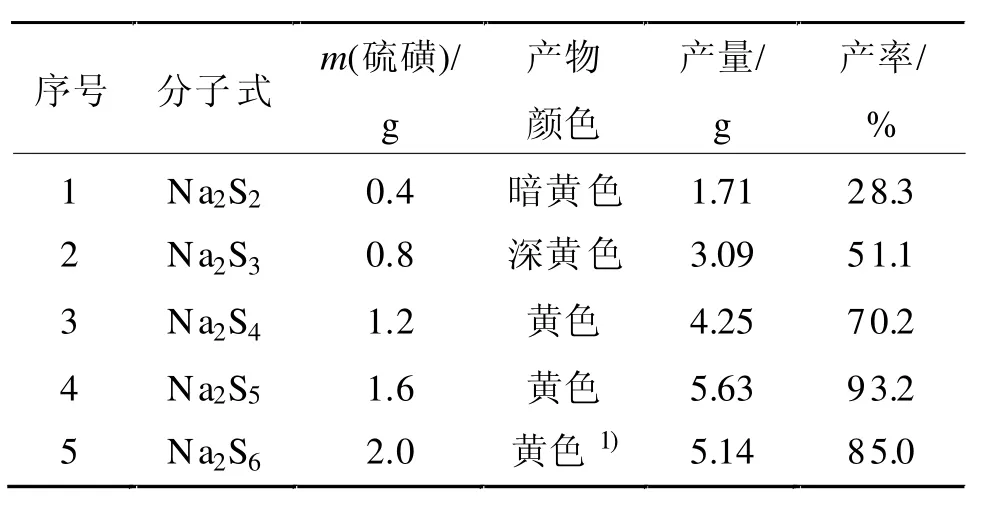
表1 Na2Sx对PAB产率的影响Tab 1 Effect of Na2Sxon PAB yield
由表1可知,硫指数x为5时,即Na2S·9H2O与S的摩尔比为1:4时对反应更有利。同时在制备Na2Sx溶液后将Na2Sx溶液进行抽滤,有利于提高氧化还原反应的产率;多硫化钠溶液不稳定,容易分解,故应现制现用。
2.1.2 乙醇与制Na2Sx溶液时加入水的体积比
在制备Na2Sx溶液时加入的水的体积大于或等于乙醇体积时,反应结束后,液体底部有少量暗红色固体物质析出,液面有1层暗红色的油状物质产生;在同样的水乙醇比例下,向反应液中加入阻聚剂之后依然有少量小颗粒暗黑色油珠产生。
当增大乙醇与水的体积比时,反应之后没有红色油状物产生,但出现分层现象,下层液极少,为碱液,上层液位暗红色液体,分离出上层液再进行稀释冲蒸,聚合减少。因此,反应液中的乙醇体积应比水体积大。
2.1.3 反应时间
PAB的产率随时间的变化如图1所示,产率随着时间的增加而增加,当反应时间超过3 h后,产率提高甚小,并且随着反应时间的增加聚合物增多,产品质量降低,故最佳的反应时间为3 h。
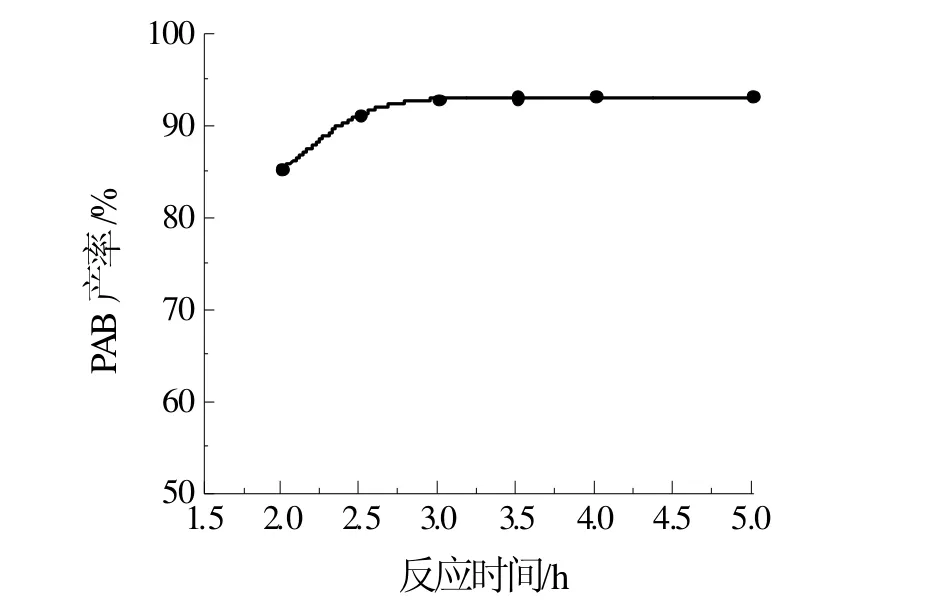
图1 反应时间对PAB产率的影响Fig 1 Effect of reaction time on PAB yield
2.1.4 稀释水量
蒸馏乙醇时,由于PAB的含量逐渐增加易使氨基和醛基发生缩聚,缩聚物对碱液稳定从而降低了产率,所以蒸馏乙醇时应向反应液中加入适量的水,并采用水蒸汽冲蒸装置来补充水分从而保持反应液恒定的体积,同时冲蒸速度要快,这样可减少大量的聚合物生成。其加入水量与聚合、产率的关系见表2。
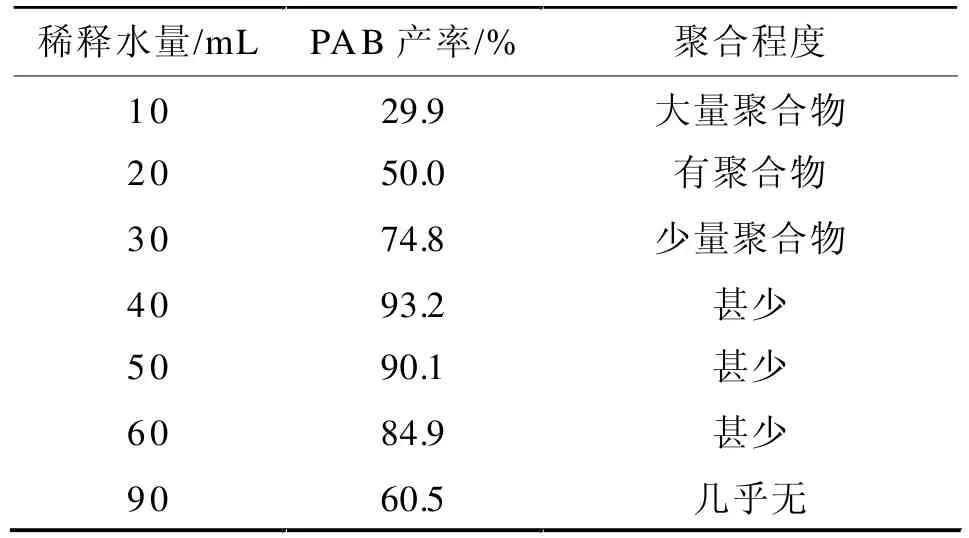
表2 稀释水量对PAB产率的影响Tab 2 Effect of water quantity for dilution on PAB yield
从表2中可以看出,加入的水量过少时有大量聚合物产生;加入的水量过多时,由于水对PAB有一定的水溶性,其产率明显降低,且加入大量的稀释水,增大了后处理的难度;当稀释水量为40 mL时,产率最高,且聚合物甚少,故最佳的稀释水量为40 mL。
2.1.5 冲蒸时间
在冲蒸时同时对反应液进行加热,经实验证明,在10 min冲蒸内达到101℃,瓶内没有聚合物;若冲蒸到101℃时超过15 min,反应物中有红色聚合物。冲蒸时间越长,聚合物越多,聚合程度愈严重,故达到101℃左右的最佳冲蒸时间为10 min以下。
2.1.6 冷却速度
将冲蒸后反应液室温冷却时,发现随时间的增加溶液颜色变深,并产生大量暗红色聚合物;而将冲蒸后反应液立即置于-10~0℃的冰盐水中冷却,并不断搅拌,有亮黄色晶体析出,但无红色聚合物固体物析出。所以处理冲蒸后反应液的速度要快,并且迅速在低温下冷却。
2.2 由PAB制PHB的影响因素
2.2.1 H2SO4的用量
PAB和亚硝酸作用生成重氮盐,由于亚硝酸易分解,所以在反应中用亚硝酸钠与硫酸作用生成的亚硝酸可立即与PAB反应。其中硫酸用量对重氮盐的生成有着显著的影响。
在重氮化过程和反应终了,要始终保持反应介质对刚果红试纸呈强酸性,如果酸量不足,可能导致生成的重氮盐与没有起反应的芳胺生成的重氮氨基化合物以形式
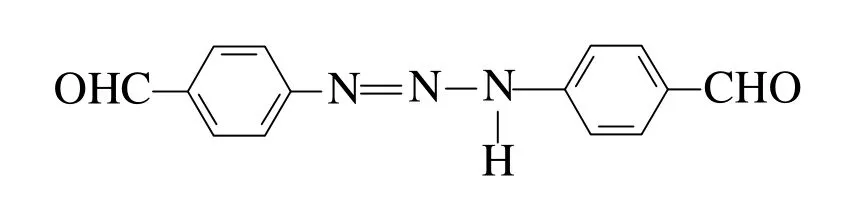
存在,此形式不稳定,比较活泼,容易与未反应的PAB形成不溶解的重氮氨基苯甲醛化合物;在重氮化过程和反应终了,溶液酸性较强,重氮盐以形式存在,此形式比较稳定,故该pH下的重氮盐可放置一段时间后再进行水解反应[12]。其硫酸用量的大小对PHB的影响如图2所示。
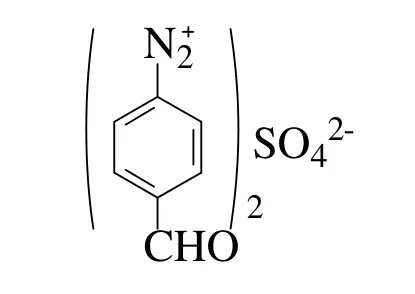
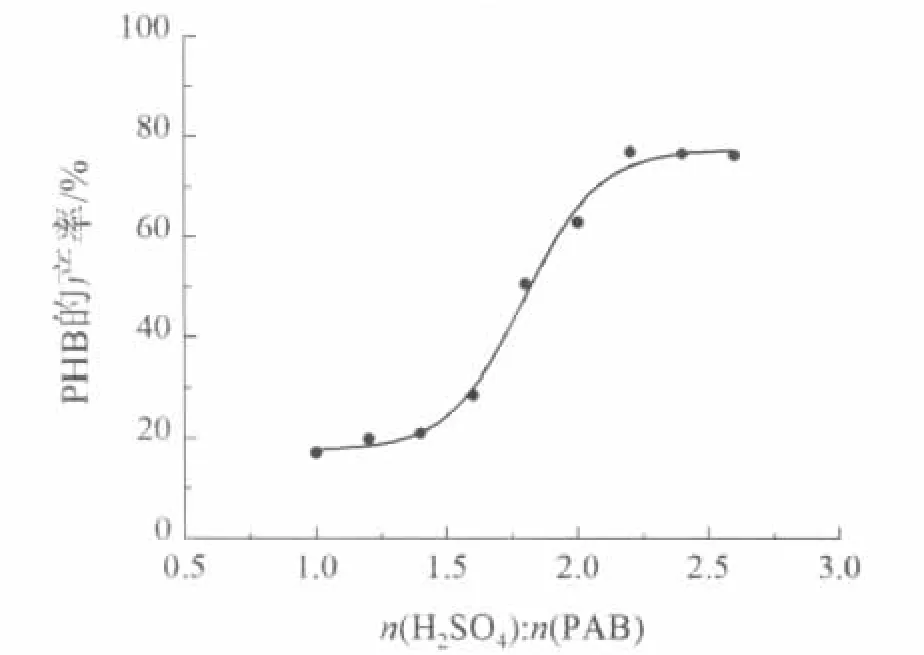
图2 硫酸与PAB摩尔比对PHB收率的影响Fig 2 Effect of mol ratio of sulfuric acid and PAB on PHB yield
由图2可看出,PHB产率随酸量的增加而有所提高。硫酸与PAB摩尔比为1.0时,PHB产率甚低;当摩尔比为2.2~2.4时,产率达到最大值,其值为77.1%;再提高摩尔比时,过多的硫酸对下一步亚硝酸钠的加入不利,易产生红棕色气体。故硫酸与PAB最佳摩尔比为2.2~2.4。
2.2.2 重氮化时间
H2SO4酸化时间不宜过长,放置过久会析出固体物质,酸化时间宜为0.5 h,后立即冷却到0℃,加入亚硝酸钠后,重氮化反应为0.5 h时溶液由深褐色逐渐变浅,继续反应至1~1.5 h时,溶液颜色变为土黄色且不变色。故重氮化时间宜为1~1.5 h。
2.2.3 NaNO2的量
重氮化反应中,如果亚硝酸不能至始至终保持过量或是加入亚硝酸钠溶液的速度过慢,也会生成重氮氨基化合物。故可将酸化液冷却至0℃以下,再快速加入NaNO2溶液,使反应液在NaNO2过量的情况下反应,但加入NaNO2量过多时,加入尿素易产生大量气泡溢出瓶口,故NaNO2应微过量。因为微过量的亚硝酸可以将碘化钾淀粉试纸中的碘化钾氧化,游离出碘而使试纸变为蓝色,所以NaNO2的量可用碘化钾淀粉试纸检测[12]。
3 结论
由PNT制备PAB时,Na2Sx中硫指数为5、乙醇与水的体积比大于1、反应时间为3 h、稀释水量为40 mL、冲蒸速度快冷却时间短、Na2Sx溶液抽滤后备用等工艺条件均可减少聚合物的产生,其PAB收率可达93.2%;由PAB制备PHB时,硫酸与PAB摩尔比为 2.2~2.4、酸化时间 0.5 h、重氮化时间 1~1.5 h、NaNO2快速滴加、反滴重氮液水解等工艺条件均可使产率提高,其最高产率为77.1%。
[1]王升文.对羟基苯甲醛的合成[J].化工中间体,2009(8):31-34.
[2]吕心阳,任学军,赵志林,等.对羟基苯甲醛的生产方法及其应用[J].化工中间体,2004(5):52-55.
[3]章思规.精细有机化学品技术手册[M].北京:科学出版社,1991:1132.
[4]Fompeyrine Patricia,Metz Francois.Process for the preparation of hydroxybenzaldehydes by hydro-cabonylation:EP,0351336[P].1990-01-17.
[5]张万宏,李财林,雷志刚.对羟基苯甲醛的合成方法概述[J].化工生产与技术,2006,13(10):45-48.
[6]刘智波,王晓光.合成对羟基苯甲醛的工艺路线[J].精细石油化工,1992(6):48-51.
[7]周辉,董世昌,李立威.由对硝基甲苯合成对羟基苯甲醛的工艺改进[J].药物研究,2010,19(6):16-17.
[8]唐振球.对羟基苯甲醛的制备及提高其得率的研究[J].沈阳化工,1987(6):11-14.
[9]张所信,江龙法,王为国,等.对硝基甲苯氧化-还原法合成对羟基苯甲醛的研究[J].化学世界,1996(8):425-428.
[10]王浩俨,顾小航,高永建,等.对羟基苯甲醛的合成[J].化学研究,1998,9(4):50-52.
[11]王建新,孙小梅,王林祥.表面活性剂在对氨基苯甲醛合成中的应用[J].无锡轻工大学学报,1997,16(1):51-55.
[12]唐培堃.精细有机合成化学及工艺学[M].2版.天津:天津大学出版社,1993:185-186.
TQ224.1
A DOI10.3969/j.issn.1006-6829.2011.01.006
国家自然科学基金(21006022)
* 通讯联系人,E-mail:chendongchu68@sina.com
2010-11-31

