孜然油树脂及其主要成分的体外抗氧化活性比较及动力学分析
陈芹芹,甘芝霖,戴蕴青,杨 阳,倪元颖
(中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心,农业部果蔬加工重点开放实验室,果蔬加工教育部工程研究中心,北京100083)
孜然油树脂及其主要成分的体外抗氧化活性比较及动力学分析
陈芹芹,甘芝霖,戴蕴青,杨 阳,倪元颖*
(中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心,农业部果蔬加工重点开放实验室,果蔬加工教育部工程研究中心,北京100083)
采用β-胡萝卜素—亚油酸法对孜然油树脂及其主要成分的体外抗氧化活性进行测定,通过IC50值(各物质抗氧化活性达到50%的浓度值)及动力学反应速率对其抗氧化能力进行综合评价,并与2,6-二叔丁基对甲酚(BHT)进行了比较。结果表明,孜然油树脂、β-蒎烯、p-对伞花烃、γ-萜品烯、枯茗醛等都表现出不同程度的抗氧化能力,但对β-胡萝卜素的氧化抑制作用小于BHT;抗氧化活性排序为γ-萜品烯>孜然油树脂>枯茗醛>β-蒎烯>p-对伞花烃,说明γ-萜品烯是孜然油树脂中的最有效的抗氧化活性组分之一,其IC50值为(0.73±0.07)mg/mL,动力学反应速率Rγ=-0.0168。
β-胡萝卜素—亚油酸法,孜然油树脂,抗氧化,动力学分析
1 材料与方法
1.1 材料与仪器
孜然 新疆和田地区的21-6新孜2号,由新疆农业科学研究院提供;BHT(2,6-二叔丁基-4-甲基苯酚)、吐温-20(分析纯)、氯仿(分析纯)等 北京蓝弋化工;枯茗醛、β-蒎烯、p-对伞花烃、γ-萜品烯、亚油酸、β-胡萝卜素等标准品 Sigma-aldrich公司。
HA-121-50-02型超临界CO2流体萃取装置江苏南通华安超临界萃取有限公司;SK5200H超声波清洗器 上海科导超声仪器有限公司;BP221S精密电子天平 德国SATORIOUS公司;RE-52A旋转蒸发器、SHZ-Ⅲ循环水真空泵 上海亚荣生化仪器厂;UV757CRT紫外可见分光光度计 北京普析通用仪器有限责任公司;WKX高速粉碎机 青州市精诚机械有限公司;7890A/5975c气相色谱-质谱联用仪美国安捷伦科技公司。
1.2 实验方法
1.2.1 孜然油树脂的提取 采用超临界萃取法提取孜然油树脂。超临界萃取工艺参数为:萃取压力35MPa,萃取温度40℃,CO2流量25kg/h,分离压力6MPa,分离温度50°C,萃取时间2h。在此条件下孜然油树脂的得率达到13.56%。
1.2.2 孜然油树脂的成分分析 采用气相色谱-质谱联用仪(GC-MS)对孜然油树脂的成分进行分析。
1.2.2.1 色谱条件 色谱柱:DB-5MS毛细管柱(30m×0.25mm×0.25μm);升温程序:40℃保持2min,以4℃/min的速率升到140℃,再以6℃/min的速率升到260℃保持5min;载气为高纯氦气,流速1.5mL/min;进样量1μL;分流比10∶1。
1.2.2.2 质谱条件 电子轰击(EI)离子源;电子能量70eV;质谱接口温度250℃;传输线温度250℃;离子源温度230℃;质量扫描范围m/z30~500amu。
1.2.3 β-胡萝卜素—亚油酸自氧化体系测定体外抗氧化活性 采用β-胡萝卜素—亚油酸自氧化体系中β-胡萝卜素的过氧化损失来评价孜然油树脂及其主要成分的抗氧化能力。参照Gachkar等[11]的方法,并在其基础上做了修改,具体如下。
1.2.3.1 β-胡萝卜素氯仿溶液配制 准确称取10mg β-胡萝卜素定容于 10mL中容量瓶中,浓度为1mg/mL.
1.2.3.2 乳化液的配制 准确量取0.4mL的β-胡萝卜素氯仿溶液,加入含有40mg亚油酸和400mg吐温-20的圆底烧瓶中,40℃下真空旋转蒸发5min,之后向残余物中加入100mL蒸馏水并不断搅拌,并在40kHz超声波中超声10min,以形成良好的乳化状态。其中空白乳化溶液的配制除不添加β-胡萝卜素外,步骤同上。
1.2.3.3 抗氧化活性测定 准确量取5mL的乳化液,加入0.2mL的不同浓度的待测样品(超临界萃取的孜然油树脂、枯茗醛、β-蒎烯、p-对伞花烃、γ-萜品烯、BHT等),立刻测定吸光度值(470nm)。在60℃下水浴120min,每30min测定一次吸光度值。
1.2.3.4 抗氧化能力评价 抗氧化活性
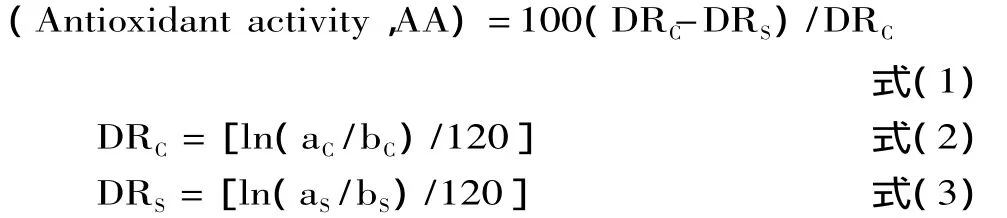
其中,DRC表示对照溶液的降解速率;DRS表示样品溶液的降解速率;aC=0min时的对照溶液吸光度值;bC=120min时的对照溶液吸光度值;aS=0min时的样品溶液吸光度值;bS=120min时的样品溶液吸光度值。
抗氧化能力用IC50值及动力学反应速率来综合衡量。
1.2.4 数据分析 采用Origin Pro 8.0进行IC50值的计算及多重比较分析,采用Sigma-plot 8.0进行动力学拟合分析。所有实验都平行三次进行。
2 结果与分析
2.1 孜然油树脂的成分分析
通过GC-MS分析,β-蒎烯、p-对伞花烃、γ-萜品烯和枯茗醛是孜然油树脂中的4种主要成分,其相对含量分别为13.58%、6.53%、8.77%、34.65%。这4种主要成分的化学结构详见图1。
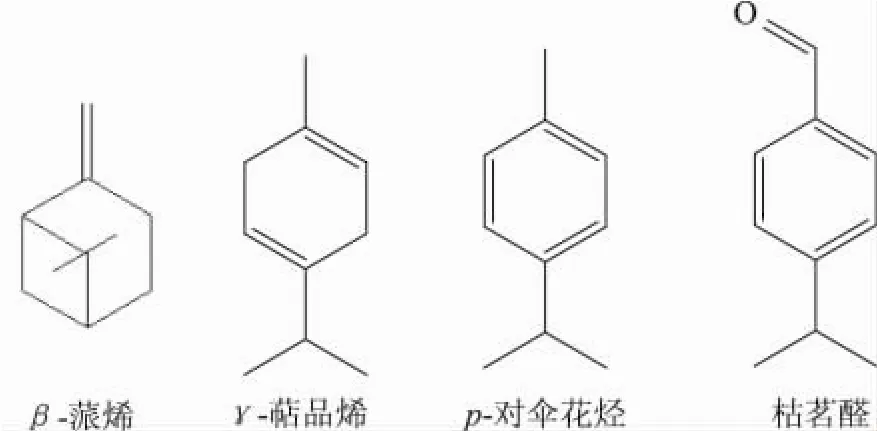
图1 孜然油树脂中4种主要成分的化学结构式
2.2 孜然油树脂及其主要成分的抗氧化能力比较分析
采用β-胡萝卜素—亚油酸法对孜然油树脂及其4种主要成分的抗氧化活性进行测定。β-胡萝卜素—亚油酸自氧化体系是涉及到氢原子转移反应的测定方法,其反应机理如下[12]:

β-胡萝卜素—亚油酸自氧化体系中各物质的抗氧化能力达到50%时的浓度值见图2,IC50值排序为: BHT<γ-萜品烯<孜然油树脂<枯茗醛<β-蒎烯<p-对伞花烃。孜然油树脂、β-蒎烯、p-对伞花烃、γ-萜品烯和枯茗醛都具有不同程度的抗氧化活性,图2中结果表明,孜然油树脂中有效的抗氧化物质之一是γ-萜品烯。物质的结构与功能是密切相关的,γ-萜品烯的化学结构(见图1)中含有环己二烯结构,故其具有较好的抗氧化活性,但经过均值比较分析,γ-萜品烯的抗氧化能力与BHT存在显著性差异。
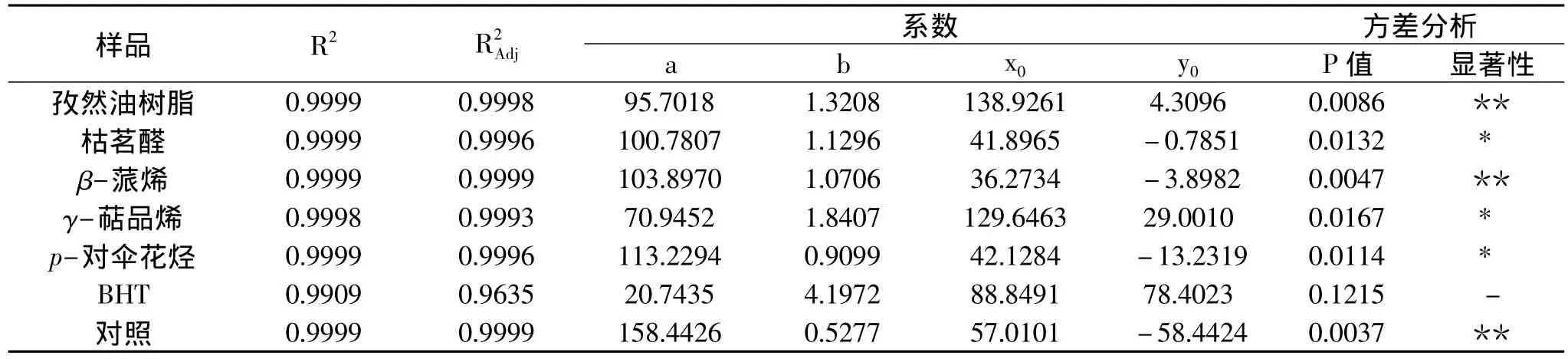
表1 β-胡萝卜素-亚油酸体系中各物质动力学曲线的方程系数及方差分析结果

图2 β-胡萝卜素-亚油酸体系中孜然油树脂及其4种主要成分抗氧化能力的IC50值
2.3 孜然油树脂及其主要成分的抗氧化动力学分析
以β-胡萝卜素—亚油酸自氧化体系中β-胡萝卜素的残留率为响应值,采用非线性拟合对孜然油树脂、β-蒎烯、p-对伞花烃、γ-萜品烯、枯茗醛、BHT的反应过程及β-胡萝卜素自氧化过程进行动力学分析,结果如图3所示。经过Sigma-plot 8.0软件分析发现,logistic方程(见方程(1))对7条曲线的拟合效果良好,7条曲线的回归系数R2均>0.99,且修正均>0.96(表1)。各曲线模型的方差分析结果(表1)表明,除BHT外,logistic模型拟合均达到了显著或极显著的水平。
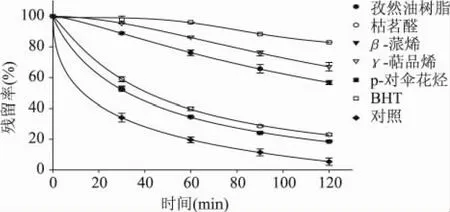
图3 各物质在5mg/mL浓度时对β-胡萝卜素残留率的动力学曲线图
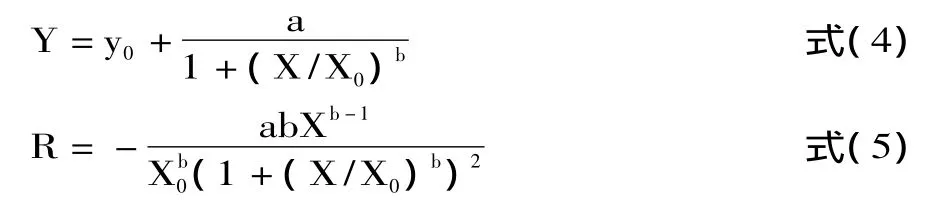
对式(4)求导得到各物质每个时刻的反应速率方程,见式(5);由于在β-胡萝卜素—亚油酸体系中反应初始阶段的反应速度是最快的,所以选取初始反应阶段的1min时的反应速率(R)对其进行抗氧化能力评价。各物质R值的大小排序为:BHT>γ-萜品烯>孜然油树脂>枯茗醛>β-蒎烯>p-对伞花烃>对照,表明对照(Rc=-7.91484)中β-胡萝卜素的残留率最低,消耗速度最快;添加人工抗氧化剂BHT组β-胡萝卜素的残留率最高,消耗速度最慢。在孜然油树脂及其主要组分中,γ-萜品烯的反应速率(Rγ=-0.0168)最大,表明β-胡萝卜素的保留率大,说明γ-萜品烯是孜然油树脂中的有效的抗氧化活性组分之一。
3 小结
采用β-胡萝卜素—亚油酸自氧化体系对孜然油树脂及其主要成分的体外抗氧化活性进行测定,抗氧化能力以IC50值结合反应速率来共同评价。各物质的IC50值排序为γ-萜品烯<孜然油树脂<枯茗醛<β-蒎烯<p-对伞花烃,而各物质的反应速率排序为γ-萜品烯>孜然油树脂>枯茗醛>β-蒎烯>p-对伞花烃。IC50值最小,反应速率值越大,说明其抗氧化活性最好。通过两种不同评价方法的衡量,得到了一致的结论:孜然油树脂、β-蒎烯、p-对伞花烃、γ-萜品烯、枯茗醛等都表现出不同程度的抗氧化能力,抗氧化活性排序为γ-萜品烯>孜然油树脂>枯茗醛>β-蒎烯>p-对伞花烃,说明γ-萜品烯是孜然油树脂中的最有效的抗氧化活性组分之一。
[1]陆占国,封丹,李伟.孜然精油成分以及对亚硝酸钠的消除作用研究[J].食品科学,2009,30(1):28-30.
[2]胡林峰,李广泽,李艳艳,等.孜然化学成分及其生物活性研究进展[J].西北植物学报,2005,25(8):1700-1705.
[3]杨文菊,杨涛,刘龙,等.气相色谱质谱法测定孜然挥发油中枯茗醛含量的方法研究[J].食品科学,2009,30(6): 208-212.
[4]Allahghadri T,Rasooli I,Owlia P,et al.Antimicrobial property,antioxidant capacity,and cytotoxicity of essential oil from cumin produced in Iran[J].Journal of Food Science,2010,75 (2):H54-H61.
[5]Martinez-Tome M,Jimenez A M,Ruggieri S,et al.Antioxidant properties of Mediterranean spices compared with common food additives[J].Journal of food protection,2001,64(9):1412 -1419.
[6]Gurdip S,Inder P S K,Santosh K P.Studies on essential oilspart thirteen:natural antioxidant for sunflower oil[J].Journal of Scientific&Industrial Research,1998,57(3):139-142.
[7]Clifford G,Beddows C,et al.Effect of ascorbyl palmitate on the preservation of α-tocopherol in sumflower oil,alone and withherbs and spices[J].Food Chemistry,2001,73(3):255-261.
[8]Roginsky V,Lissi EA.Review of methods to determine chainbreaking antioxidant activity in food[J].Food Chemistry,2005,92 (2):235-254.
[9]Von Gadov A,Joubert E,Hansmann.Comparison of the antioxidant activity of aspalathin with that of other plant phenols of Roobies tea(Aspalathus linearis),α-tocopherol,BHT,and BHA[J].Journal of Agriculture and Food Chemistry,1997,45: 632-638.
[10]Wannes W A,Mhamdi B,Stiti J,et al.Antioxidant activities of the essential oils and methanol extracts from myrtle(Myrtus communis var.italica L.)leaf,stem and flower[J].Food and Chemical Toxicology,2010,48(5):1362-1370.
[11]Gachkar L,Yadegari D,Rezaei M B,et al.Chemical and biological characteristics of Cuminum cyminum and Rosmarinus officinalis essential oils[J].Food Chemistry,2007,102(3): 898-904.
Antioxidant activity and kinetics analysis of cumin oleoresin and its main components in vitro
CHEN Qin-qin,GAN Zhi-lin,DAI Yun-qing,YANG Yang,NI Yuan-ying*
(College of Food Science&Nutritional Engineering,China Agricultural University,National Research Centre for Fruits and Vegetables Processing,Engineering Research Centre for Fruits and Vegetables Processing,Ministry of Education,Key Laboratory of Fruits and Vegetables Processing,Ministry of Agriculture,Beijing 100083,China)
Antioxidant activity of cumin oleoresin and its main components in vitro were determined byβ-carotenelinoleic acid assay,IC50value(the concentration of antioxidant when antioxidant activity was achieved 50%)and a kinetic approach were used to evaluate the efficiency of antioxidant ability.All of them(cumin oleoresin,β-pinene,γ-terpinene,p-cymene,and cuminaldehyde)showed antioxidant activities with different levels,but the effectiveness of them was not as good as BHT.Generally,the effectiveness of the various samples on linoleic acid oxidation was in the following descending order:γ-terpinene>cumin oleoresin>cuminaldehyde>β-pinene>pcymene,it indicated thatγ-terpinene was one of the most effective antioxidant materials in cumin oleoresin,which IC50value was(0.73±0.07)mg/mL,kinetics reaction rate(Rγ)was-0.0168.
β-carotene-linoleic acid assay;cumin oleoresin;antioxidant;kinetics analysis
TS221
A
1002-0306(2011)11-0111-04
孜然(Cuminum cyminum L.),英文名为cumin,中文音译名为枯茗,也叫孜然芹、安息茴香,为伞形花科,属一年生草本植物[1]。孜然原产埃及、埃塞俄比亚,我国主要在新疆、甘肃河西走廊有栽培[2]。孜然油已被美国食品及药品管理局(FDA)列入GRAS (generally recognized as safe)名单,美国食品香料与萃取物制造者协会(FEMA)也允许其在食品香精、烟用香精、酒用香精中使用[3]。目前关于孜然油的抗氧化活性在文献中报道不一。Allahghadri T等[4]研究发现孜然油表现出很强的抗氧化活性,其活性高于BHA和BHT。Martinez-Tome M等[5]研究结果表明,5%孜然油的抗氧化活性介于100μg/g的BHA和BHT之间。Gurdip S等[6]研究了孜然油对70℃下储藏的向日葵油的抗氧化活性,结果表明,孜然油具有良好的抗氧化性,其抗氧化能力高于 BHT。然而Clifford等[7]研究时发现,孜然种子油在与抗坏血酸棕榈酸酯联合作用时对向日葵油的腐败没有表现出任何活性。由此可见,孜然油的抗氧化活性还需要进一步的证实。β-胡萝卜素—亚油酸自氧化体系是一种常用的抗氧化活性评价方法,其原理是亚油酸在高温下产生的过氧化氢使β-胡萝卜素褪色[8],而通过添加抗氧化剂及含有抗氧化物质的天然提取物则使β-胡萝卜素的褪色反应被抑制[9-10]。本文利用β-胡萝卜素—亚油酸自氧化体系对超临界萃取得到的孜然油树脂及其4种主要成分(β-蒎烯、γ-萜品烯、p-对伞花烃和枯茗醛)的体外抗氧化活性进行测定,通过各物质的IC50值(各物质抗氧化活性达到50%的浓度值)及动力学反应速率来综合评价,以期为孜然的抗氧化能力提供基础数据依据。
2011-08-24 *通讯联系人
陈芹芹(1985-),女,在读博士生,研究方向:天然产物提取及功能食品研发。
科技部农业科技成果转化资金项目(2006GB23600453)。

