菊芋菊糖的提取和膳食纤维的制备
孙月娥,王卫东,2,高明侠
(1.徐州工程学院食品学院,江苏徐州221008; 2.江苏省食品生物加工工程技术研究中心,江苏徐州221008)
菊芋菊糖的提取和膳食纤维的制备
孙月娥1,王卫东1,2,高明侠1
(1.徐州工程学院食品学院,江苏徐州221008; 2.江苏省食品生物加工工程技术研究中心,江苏徐州221008)
采用超声波微波协同的方法从菊芋中同时提取菊糖和膳食纤维。结果表明,超声波微波协同比普通溶剂提取所需要的时间更短,提取率更高,最佳提取条件为超声波功率50W,微波功率400W,提取时间60s,料液比1∶10 (g∶mL)。利用扫描电镜对提取前后菊芋粉的形貌进行观察,发现超声波和微波对其细胞壁造成了破坏。菊芋粉提取菊糖后的剩余物含有丰富的多酚类化合物(317mg GAE/100g),可以作为膳食纤维,而干燥方法显著影响了其特性。
菊芋,菊糖,膳食纤维
1 材料与方法
1.1 材料与仪器
菊芋 购自徐州当地农贸市场;其它试剂 均为分析纯。
CW-2000型超声-微波协同萃取仪(超声波频率40kHz,功率 50W;微波频率 2450MHz,功率50~800W) 上海新拓分析仪器科技有限公司;756紫外可见分光光度计 上海成光仪器有限公司; XMT-152电热恒温干燥箱、数显式电热恒温水浴锅上海跃进医疗器械厂。
1.2 实验方法
1.2.1 菊芋预处理 菊芋去皮后切成2mm的薄片,90℃热烫2min,60℃热风干燥12h后粉碎,过40目筛得到菊芋粉,贮存在干燥器中备用。
1.2.2 溶剂提取 精确称取5g菊芋粉置于250mL锥形瓶中,加入100mL水,于50℃在振荡水浴锅中提取一定时间。提取液用布氏漏斗抽滤后测定滤液中菊糖的含量。
1.2.3 超声波微波协同提取菊糖 称取约5g菊芋粉置于250mL提取瓶中,加入一定体积的水,提取一定时间后,抽滤,测定滤液中菊糖的含量。提取时将超声波处于开的状态,超声波功率50W,频率40kHz。
1.2.4 膳食纤维的制备与测定 提取菊糖后的残渣分别再进行真空干燥、冷冻干燥和热风干燥。热风和真空干燥温度均为60℃。干燥后的残渣粉碎后测定其中的膳食纤维含量。
采用酶-重量法测定膳食纤维的含量[6]。称取1.0g的干燥残渣置于小烧杯中,加水搅拌至完全溶解后,加蛋白酶于一定温度水中进行酶解,再调pH为4.0~4.6后在一定温度水中进行二次酶解,以除去蛋白质和淀粉,沉淀过滤取滤液,加入4倍体积95%乙醇沉淀可溶性膳食纤维,再用78%、95%乙醇、丙酮等洗涤滤渣以去除脂肪等脂溶性物质,所剩残渣烘干后称其质量即得可溶性膳食纤维。按照下式计算膳食纤维含量:

式中:W1-烘干后总重量(g);W2-坩埚和滤纸重量(g);W0-样品重量(g)。
1.2.5 菊糖提取率的计算 以葡萄糖为标准品,采用苯酚-硫酸法[7]测定提取液中总糖含量;以果糖为标准品,采用3,5-二硝基水杨酸法[8]测定提取液中还原糖含量,然后采用下式计算菊糖的提取率(以干重计)[9]:


1.2.6 总酚含量的测定 总酚含量的测定采用Folin -Ciocalteau法[10]。
1.2.7 膨胀力测定 准确称取1.0g残渣,置于量筒中,加入30mL去离子水,室温下静置20h后,记录体积V。按照下式计算膨胀力:
膨胀力(mL/g)=膨胀后纤维体积(mL)-干品体积(mL)/样品干重(g)
1.2.8 持水力测定[11]准确称取0.3g残渣,置于离心试管中,加入20mL水,于室温下静置20h,然后在4000r/min的条件下离心20min,弃去上清液,称量残渣湿重,按照下式计算持水力:

1.2.9 持油力测定 用大豆油代替去离子水,测定方法同1.2.8。
1.2.10 扫描电镜(SEM)分析 将菊芋粉及提取菊糖后的菊芋粉残渣热风干燥后,在SEM样品台上贴上双面胶,将少许菊芋粉撒于双面胶上,吹去多余的粉末,然后喷金,采用SEM进行观察。加速电压为15kV,放大倍数100倍。
2 结果与分析
2.1 溶剂提取对菊糖得率的影响
采用传统的溶剂浸提方法,固定料液比为1∶10 (g∶mL),提取温度75℃,考察提取时间对得率的影响,结果如图1所示。由图1可见,菊糖得率随提取时间的增加而增加,且在前5min内菊糖得率增加明显,在5min时菊糖得率达到最高,为63.91%。当提取时间大于5min后,菊糖得率基本保持不变。

图1 溶剂提取时间对菊糖得率的影响
2.2 超声波微波协同提取对菊糖得率的影响
采用超声波微波协同提取菊芋菊糖,料液比为1∶10(g∶mL),微波功率400W,超声波功率50W。提取时间分别为30、60、90、150、180、300、450、600、900s,菊糖得率随提取时间的变化如图2所示。由图2可见,在其他条件相同的情况下,菊糖得率随提取时间变化而变化,在60s时菊糖得率达到最大,为73.96%。60s后菊糖得率变化趋于平稳。因此,采用超声波微波协同提取法提取菊芋菊糖时,应选择提取时间60s。此时能耗低,菊糖得率高。
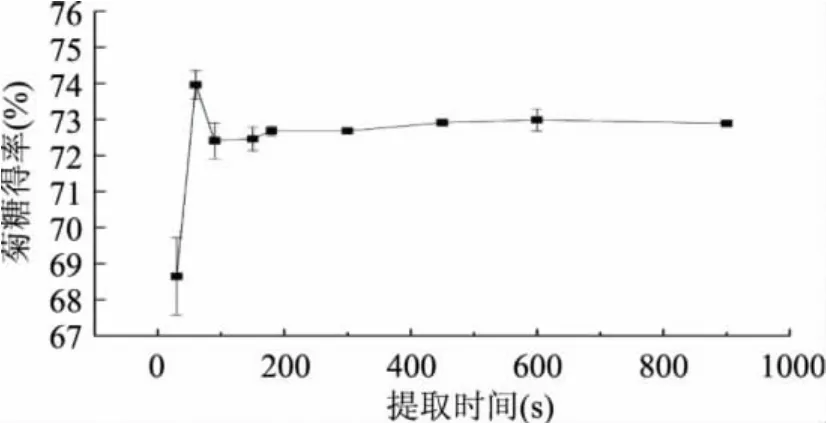
图2 提取时间对菊糖得率的影响
2.3 微波功率对菊糖得率的影响
固定料液比1∶10(g∶mL),超声波功率为50W,提取时间60s的条件下,考察微波功率对菊糖得率的影响,结果如图3所示。由图3可见,微波功率从250~400W,菊糖得率增加,微波功率在400W时菊糖得率最高,为73.34%。继续增加微波功率,菊糖得率下降。因此,采用超声波微波协同提取菊糖时,应选择微波功率为400W。
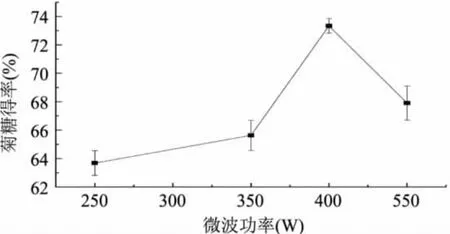
图3 微波功率对菊糖得率的影响
2.4 料液比对菊糖得率的影响
料液比对菊糖得率的影响如图4所示。由图4可见,在其它条件相同的情况下,菊糖得率随料液比变化而变化。料液比越小,菊糖得率越小。当微波功率为400W,超声波功率为50W,提取时间60s,料液比为1∶10(g∶mL)时菊糖得率最高,为73.54%。因此,采用超声波微波协同提取法提取菊糖时,应选择的料液比为1∶10(g∶mL)。
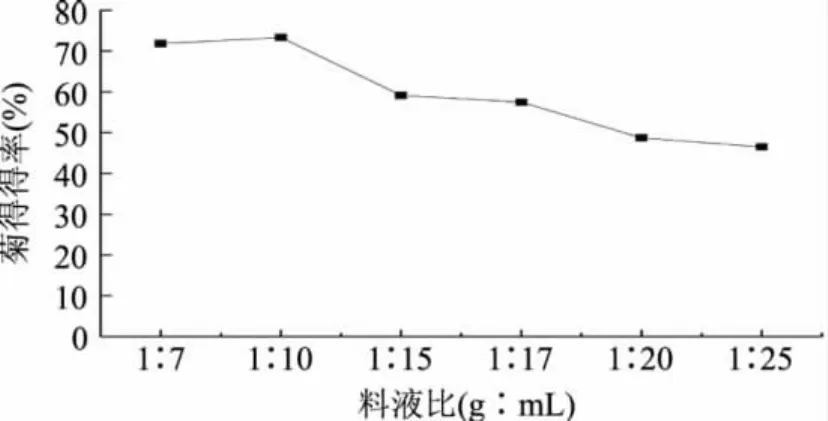
图4 料液比对菊糖得率的影响
2.5 提取菊糖后剩余物的扫描电镜(SEM)图
扫描电镜(SEM)可以揭示物质的微细结构,通过比较提取前后菊芋粉细胞壁结构的不同,进而可以揭示提取的机制。图5中a、b、c分别为未经过任何处理菊芋粉原样、溶剂提取后和超声波微波协同提取后的SEM图。显然,经过超声波微波协同提取前后的菊芋细胞组织形貌差异较大。在提取之前,菊芋细胞表面平整光滑、无折痕或裂痕。而经过超声波微波协同提取处理之后的菊芋粉残渣表面受热发生扭曲,出现不规则褶皱,表面积增大,有了层断裂面,这大大加速了溶出速率,此时菊糖的溶出彻底,得率达到最大值。超声波微波协同提取破壁普遍被认为主要是超声波的空化效应、机械效应和微波的热效应造成的[12]。

图5 提取菊糖前(a)、溶剂提取后(b)、超声波微波提取后(c)的菊芋粉的SEM图
2.6 提取菊糖后剩余物的成分
测定提取菊糖后残渣的化学成分,结果如表1所示。由表1可知,干燥方式对提取菊糖后剩余物中总膳食纤维及总酚含量有比较大的影响[9]。其中,采用冷冻干燥方法得到的提取剩余物中膳食纤维含量最高,真空干燥的次之,热风干燥的最少。经冷冻干燥后的提取剩余物中总酚含量最高,经真空干燥的次之,经热风干燥的最少。许多研究发现,食品中的总酚含量与其抗氧化性呈现明显的正相关性[13-15]。因此菊芋提取菊糖后的残渣可作为具有良好抗氧化性的膳食纤维,并且经冷冻干燥的剩余物可以较好地保留其中的多酚类物质,具有较高的抗氧化性。

表1 提取菊糖后剩余物的主要化学成分(mg/100g)
2.7 剩余物的功能特性
膳食纤维的膨胀性、持水力、持油力随可溶性膳食纤维的含量变化而变化。由表2可见,经冷冻干燥的剩余物的膨胀力、持水力及持油力最高,因此冷冻干燥可以较好的保持膳食纤维的功能特性。

表2 菊芋菊糖提取剩余物功能特性
3 结论
采用超声波微波协同提取菊芋中的菊糖,当超声波功率50W,微波功率400W,提取时间60s,料液比1∶10时,提取率可以达到70%以上,高于普通溶剂搅拌的提取率。提取菊糖后的剩余物是富含多酚的膳食纤维,经冷冻干燥后,其持水力、持油力以及膨胀力高于热风和真空干燥的剩余物,因此可以进一步开发作为功能性食品配料。
[1]赵琳静,燕方龙,宋小平.菊芋菊糖的研究进展[J].食品研究与开发,2008,29(4):186-189.
[2]胡蝶,邓钢桥,彭伟正,等.菊糖提取工艺的研究[J].湖南农业科学,2005(6):71-72.
[3]黄亮,王俊杰,王峰,等.菊芋中菊糖提取方法的研究[J].食品与机械,2007,23(4):76-79.
[4]胡秀沂,邱树毅,王慧,等.新鲜菊芋的预处理及微波辅助提取菊粉的研究[J].食品工业科技,2007,28(4):150-152,155.
[5]陆慧玲,胡飞.酶法提取菊糖工艺的研究[J].食品工业科技,2006,27(10):158-160.
[6]Lou Z,Wang H,Wang D,et al.Preparation of inulin and phenols-rich dietary fiber powder from burdock root[J]. Carbohydrate Polymers,2009,78(4):666-670.
[7]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substance[J]. Analytical Chemistry,1956,28:350-356.
[8]宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1998,33-37.
[9]Wei L,Wang J,Zheng X,et al.Studies on the extracting technical conditions of insulin from Jerusalem artichoke tubers[J].Journal of Food Engineering,2007,79:1087-1093.
[10]Dugh C S,Amerine M A.Methods for analysis of musts and wines(second edition)[M].New York:Wiley-Interscience,1988:203-205.
[11]Robertson J A,Monredon F D,Dysseler P,et al.Hydration properties of dietary fiber and resistant starch:a European collaborative study[J].Lebensmittel-Wissenschaft und-Technologie,2000,33:72-79.
[12]Cravotto G,Boffa L,Mantegna S,et al.Improved extraction of vegetable oils under high-intensity ultrasound and/or microwaves[J].Ultrasonics Sonochemistry,2008,15(5):898-902.
[13]王海敏,虞海霞,董蕊,等.苕子蜜总酚酸和总黄酮含量测定及抗氧化活性的研究[J].食品科学,2010,31(1):54-57.
[14]徐金瑞,张名位,刘兴华,等.黑大豆种质抗氧化能力及其与总酚和花色苷含量的关系[J].中国农业科学,2006,39 (8):121-124.
[15]张欣,赵新淮.几种多酚化合物抗氧化性的不同化学评价及相关性分析[J].食品科学,2008,29(10):85-89.
Study on simultaneous preparation of inulin and dietary fiber powder from jerusalem artickoke
SUN Yue-e1,WANG Wei-dong1,2,GAO Ming-xia1
(1.College of Food Engineering,Xuzhou Insitute of Technology,Xuzhou 221008,China; 2.Jiangsu Engineering Research Center for Food Biology Processing,Xuzhou 221008,China)
The simultaneous ultrasonic/microwave assisted extraction(UMAE)of inulin and production of phenolsrich dietary fiber powder from jerusalem artickoke was studied.It was found that UMAE required a much shorter extraction time,much higher yield than conventional stiring extraction.A comparison of scanning electron microscopy images ofraw and simultaneousultrasonic/microwave treated jerusalem artickokeindicated microfractures and disruption of cell walls in jerusalem artickoke flakes.The dietary fiber powder prepared from the residue of jerusalem artickoke after inulin extraction was rich in phenols(317mg GAE/100g powder),which could be used as dietary fiber.The results showed that drying method significantly affected the hydration properties.
jerusalem artickoke;inulin;dietary fiber
TS201.2+3
B
1002-0306(2011)09-0306-04
菊芋(Helianthus tuberosus L.)别名洋姜、洋菜、鬼子姜,属菊科向日葵属多年生草本植物,在我国的华北、华东、华南、华中等地均有分布。菊芋块茎中含有15%~20%菊糖,提取后可作为功能性配料,广泛应用于功能性食品、药品和保健品的制造,具有水溶性膳食纤维的生理活性功能[1]。目前,从菊芋中提取菊糖可以采用热水提取法[2]、超声波辅助提取法[3]、微波提取法[4]、酶法[5]提取等方法。近年来,微波、超声波提取技术在食品工业被广泛应用,但是目前还没有采用超声波微波协同提取菊芋中的菊糖的相关报道。虽然从菊芋中提取菊糖的研究报道很多,但是往往只注重菊糖的提取,而其它一些有用的成分被当作废物处理,比如其中含有相当数量的膳食纤维、多酚类化合物。因此,为提高菊芋的附加值,可以将菊芋提取菊糖后的剩余物加以利用,不但能够充分利用资源减少垃圾排放,同时有着良好的经济效益及社会效益。本实验采用超声波微波协同提取菊芋中的菊糖,确定菊糖制备的最佳工艺参数,对菊芋的综合开发利用和提高其经济价值具有重要的意义。
2011-06-09
孙月娥(1971-),女,讲师,博士,研究方向:功能性食品添加剂与配料。
徐州工程学院培育项目(XKY2009216);江苏苏北科技发展计划项目(BC2009411)。

