诺氟沙星单克隆抗体的制备及初步应用
李超英,姜金庆
(1.新乡医学院实验动物中心,河南新乡453003; 2.河南科技学院动物科学学院,河南新乡453003)
诺氟沙星单克隆抗体的制备及初步应用
李超英1,2,姜金庆2,*
(1.新乡医学院实验动物中心,河南新乡453003; 2.河南科技学院动物科学学院,河南新乡453003)
采用优化的碳二亚胺法制备诺氟沙星(NOR)人工抗原,紫外扫描和红外光谱图表明人工抗原偶联成功。采用细胞融合技术筛选抗NOR单克隆抗体(NOR mAb)杂交瘤细胞株,体内诱生腹水法制备NOR mAb,建立间接竞争ELISA(icELISA)标准曲线。结果表明,筛选的3株杂交瘤细胞分泌的抗体为IgG1亚型,具k轻链;建立的icELISA标准曲线在PBS中的的线性检测范围为0.04~43.6ng/mL,IC50值为0.62ng/mL,检测限(LOD)为0.02ng/mL;抗体与环丙沙星(87.2%)、培氟沙星(76.9%)、依诺沙星(66.8%)、恩诺沙星(48.6%)和洛美沙星(36.6%)有较高的交叉反应率;禽肉基质中NOR添加回收率满足检测要求。
诺氟沙星,人工抗原,氟喹诺酮,单克隆抗体,间接竞争ELISA
1 材料与方法
1.1 材料与仪器
诺氟沙星、环丙沙星、恩诺沙星、培氟沙星 瑞士Fluka公司;其它FQs标准品 中国兽医药品监察所;牛血清白蛋白(BSA)、鸡卵清蛋白(OVA) Sigma公司;鼠单克隆抗体鉴定试剂盒、碳化二亚胺(EDC)、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)Pierce;N-羟基琥珀酰亚胺(NHS) 日本株式会社;透析袋(8000~14000Da)Solarbio;小鼠骨髓瘤NS0细胞株 英国国家动物健康研究院惠赠; 96孔聚乙烯酶标板、96孔和 24孔细胞培养板、100mL细胞瓶 Costar公司;RPMI-1640、HAT、HT培养基 Gibco公司;PEG-1500(50%)Roche;胎牛血清(FBS) 杭州四季清生物工程公司;琥珀酸酐、四甲基联苯胺(TMB)、非那西丁、过氧化脲Sigma;其它所有试剂 均为分析纯。
MULTISKAN MK3酶标仪、GS15R高速冷冻离心机 美国Thermo公司;DU800核酸蛋白分析仪 美国Beckman-Coulter公司;TENSOR27红外光谱仪德国Bruker公司;Galaxy S+型CO2细胞培养箱 英国RS-Biotech公司;TS100-F倒置生物显微镜 日本Nikon公司;925REL#10超低温冰箱 Thermo Forma公司;eLINE微量移液器 芬兰百得公司; SZ-97自动三重蒸馏水器 上海雅荣生化仪器有限公司;PHS-3TC精密酸度计 上海天达仪器有限公司。
1.2 人工抗原的合成
参照文献[13],采用优化的EDC两步法合成NOR人工抗原(见图1)。将36mg NOR用3mL N,N-二甲基甲酰胺(DMF)溶解后,加入12mg NHS和38mg EDC,37℃条件下避光反应24h。离心后取上清液逐滴加入到4mL含66mg BSA(或40mg OVA)的PBS缓冲液中,37℃条件下避光振荡反应4h。反应完成后先用蒸馏水透析3d,再用PBS透析3d,紫外扫描透析液无小分子吸收峰时分装于安瓿瓶中,-20℃冻干保存。
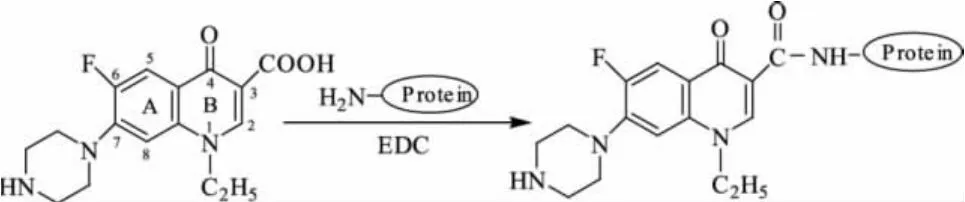
图1 EDC法制备NOR人工抗原的路线图
1.3 人工抗原的鉴定
分光光度计法测定蛋白质含量,计算公式为:蛋白质含量(mg/mL)=1.45A280nm-0.74A260nm。参照文献[14],用PBS将NOR标准品、BSA和免疫原分别配成0.01mg/mL和1mg/mL的溶液,用DU800核酸蛋白分析仪读取吸光度值,计算NOR与BSA的偶联比。计算公式为:Ca/Cb=(ACam×KBbm-ACbm× KBam)/(ACbm×KAam-ACam×KAbm),其原理和计算依据详见文献[14]。参照文献[15],取NORBSA固体样品0.1mg,制备KBr压片,用红外光谱仪进行光谱扫描鉴定。
1.4 单克隆抗体的制备
1.4.1 动物免疫 用NOR-BSA免疫8~10周龄雌性Balb/C小鼠10只,剂量为60μg/只,体积为0.2mL,颈背皮下多点注射。首免用PBS稀释的免疫原与等体积FCA完全乳化,以后每隔3周加强免疫一次,换用FIA乳化,共强化免疫3次。最后1次免疫后3周断尾采血分离血清,用间接ELISA和间接竞争ELISA筛选效价高、抑制效果好的小鼠作为融合备用鼠。融合前3~4d超免小鼠,尾静脉和腹腔各注射50μg免疫原,体积均为100μL。
1.4.2 细胞融合与杂交瘤细胞株筛选[16]融合前4~5d用含有8-氮鸟嘌呤的完全培养基(含15%FBS的RPMI-1640)传代培养NS0细胞;前1d用HAT培养滋养细胞。融合后 10~14d用间接 ELISA和icELISA筛选强阳性、抑制率高、生长状态好的杂交瘤细胞株,用有限稀释法进行3次亚克隆。筛选的单克隆细胞株用含10%DMSO的培养基在液氮中保存。
1.4.3 单抗制备与鉴定 杂交瘤细胞浓度达到约107/mL时,向10d前经液体石蜡处理过的经产母鼠腹腔内注射单克隆细胞108/只。10~12d后抽取腹水,抗体用饱和硫酸铵盐析法纯化,分装后-70℃冻存。分光光度计法测定蛋白质含量;Batty饱和法测定亲和常数(Ka)[17];单抗试剂盒进行亚型鉴定。
1.5 免疫学检测方法的建立
间接ELISA和间接竞争ELISA(icELISA)操作程序参考文献[18]。方阵滴定法优化检测抗原(NOR-OVA)浓度和单抗(mAb)稀释倍数,以B/B0值(B是不同浓度标准品时A450值,B0是不加标准品时A450值)为纵坐标,以不同浓度标准品的对数值为横坐标,四参数曲线拟合建立icELISA标准曲线,进行相关分析。灵敏度用IC50值表示,代表标准品与检测抗原偶联时的半数抑制浓度;线性范围表示最大信号值20%~80%的抑制率(IC20~IC80);最低检测限(LOD)以IC15值计算[19]。抗体特异性以交叉反应率(CR)表示[14],计算公式为:CR(%)=(IC50of NOR)/(IC50of competitors)×100%,CR越低,抗体的特异性越强。
1.6 添加回收实验
将家禽肌肉样品(鸡、鸭、鹅)放入组织均浆机中混匀,准确称取2g样品,用NOR标准品母液配制成10、20、50ng/g的加标浓度。将加标样品置于50mL塑料离心管中,加入乙腈-NaOH溶液10mL,充分混合后,4℃3000r/min离心20min。取出5mL上清液,加入PBS溶液5mL,混匀,上样检测。以回收率和变异系数(CV)确定检测方法的准确度。
2 结果与分析
2.1 人工抗原紫外鉴定
在220~400nm紫外光区,分别对NOR、BSA和NOR-BSA进行紫外扫描,结果如图2所示。NOR的最大吸收峰在271nm,BSA的最大吸收峰在278nm,而NOR-BSA的最大吸收峰在275nm,人工抗原的特征吸收峰发生了明显的偏移,其紫外光谱具有明显的NOR和BSA叠加的特性,证明偶联成功,鉴定结果与文献[20]相一致。根据计算公式,NOR-BSA的偶联率为24∶1,同理NOR-OVA的结合比为16∶1。
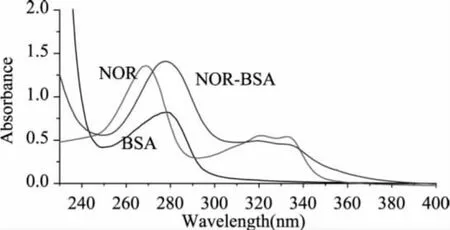
图2 NOR、BSA和NOR-BSA的紫外扫描图谱
2.2 红外光谱鉴定
鉴定结果如图3所示。BSA和NOR-BSA在2500~3200cm-1和1680~1500cm-1区域具有相似的吸收,这是BSA中氨基酸的特征峰,说明合成的人工抗原中含有BSA。NOR标准品在1760~1600cm-1区域和3005~3120cm-1处有强吸收峰,这是羧酸基团中羰基和羟基的特征峰;NOR-BSA人工抗原中保留了羰基吸收峰,而羟基吸收峰消失,证明抗原改造和偶联成功。
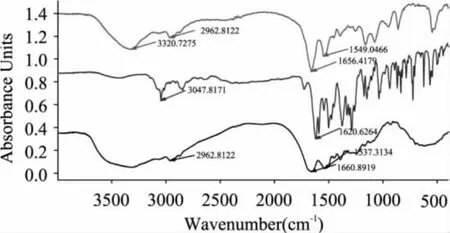
图3 NOR、BSA和NOR-BSA的红外光谱图
2.3 NOR mAb的制备及性能鉴定
细胞融合10d后观察融合效果,融合率为82%;间接ELISA和竞争ELISA检测细胞上清,阳性率为19%。有限稀释法三次亚克隆后,筛选出3株抗体分泌稳定的杂交瘤细胞株,分别命名为N3C5、N7B2和N7D2。细胞株单抗亚类均为IgG1型,具k轻链;亲和常数分别为4.8×109、2.3×1010、5.6×109L/mol。腹水纯化后的蛋白质含量为3.6~6.1mg/mL。方阵滴定法检测抗体效价和灵敏度,N7B2腹水的灵敏度最高,达到0.62ng/mL。因此,选择灵敏度最好的N7B2单克隆抗体建立ELISA标准曲线,并进行抗体特异性鉴定。
2.4 间接竞争ELISA标准曲线
依据检测抗原和单克隆抗体用量少的原则,选择A450值为1.5~2.0左右时,检测抗原和NOR mAb的最大稀释倍数为理想工作浓度(数据未显示),因此确定本实验体系NOR-OVA最佳包被质量浓度为2μg/mL,抗NOR mAb的最佳工作浓度为1∶60000倍稀释。优化的间接竞争ELISA(icELISA)标准曲线如图4所示,该曲线的回归方程式为y=-9.852Ln(x) +46.138(R2=0.9655),IC50值为0.62ng/mL,表明NOR mAb具有较高的灵敏度。根据公式计算出标准曲线在PBS中的线性检测范围为0.04~43.6ng/mL,最低检测限(LOD)为0.02ng/mL。
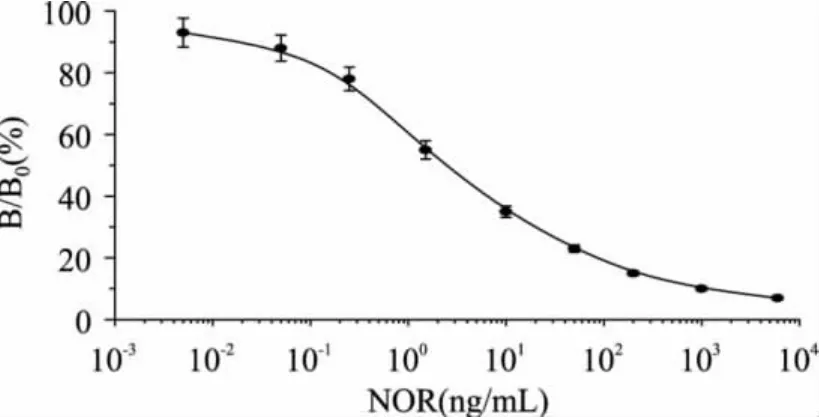
图4 NOR单克隆抗体间接竞争ELISA的标准曲线
2.5 抗体特异性
NOR mAb的交叉反应性决定了抗体的特异性,以FQs同类药物代替NOR标准溶液,进行交叉反应实验,结果见表1。由表1可知,NOR mAb与环丙沙星(87.2%)、培氟沙星(76.9%)、依诺沙星(66.8%)、恩诺沙星(48.6%)和洛美沙星(36.6%)有较高的交叉反应率,这说明该免疫学方法可同时检测6种FQs兽药残留。
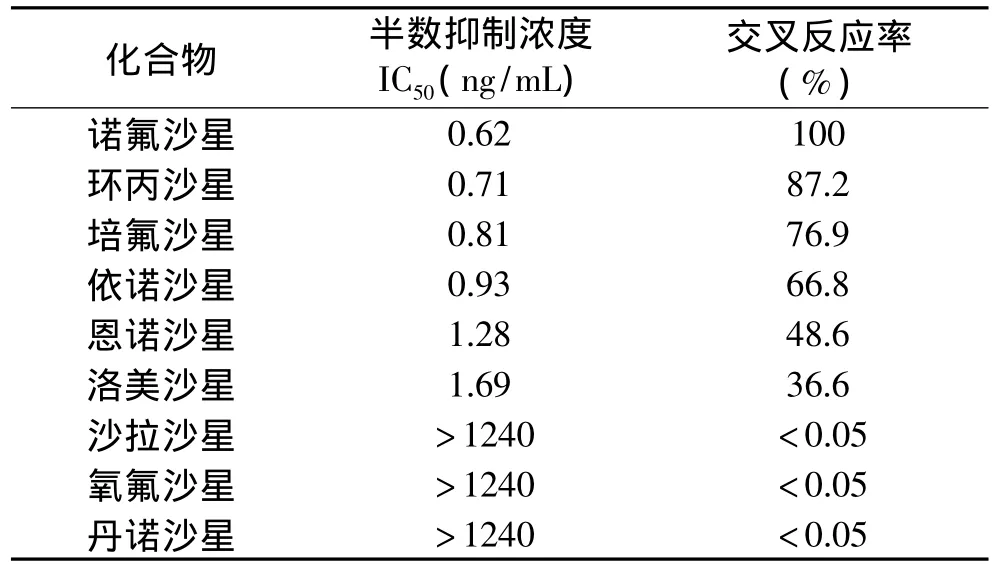
表1 NOR mAb与FQs功能类似化合物的交叉反应率
2.6 添加回收实验
禽肉样品添加浓度为10、20、50ng/g,经萃取缓冲液提取后,对应于1、2、5ng/mL。加标样品稀释10倍,ELISA曲线检测灵敏度相应下降10倍,其准确性实验结果见表2。鸡肉的回收率和CV值分别为90.8%~99.3%和6.2%~8.8%;鸭肉的回收率和CV值分别为89.7%~110.2%和6.8%~9.6%;鹅肉的回收率和CV值分别为96.6%~101.2%和7.5%~9.8%。结果表明,间接竞争ELISA具有较高的准确度,能够满足NOR残留检测要求。
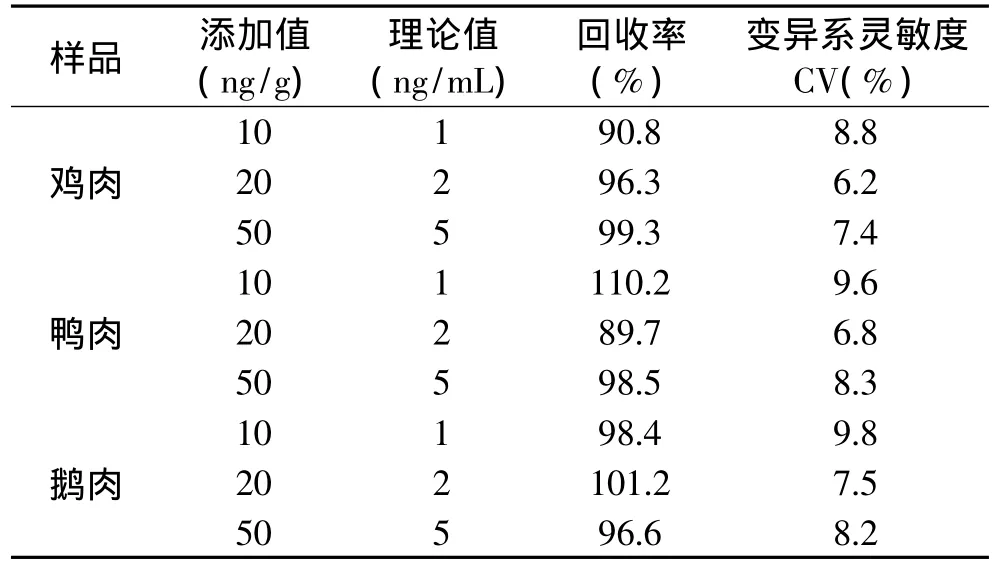
表2 间接竞争ELISA检测不同样品的准确度
3 讨论
3.1 NOR单克隆抗体的制备
免疫分析是以抗原抗体的特异性识别和可逆性反应为基础的痕量分析方法,已在残留物检测中得到广泛应用。而抗体质量的好坏决定着免疫学检测技术的成败,其特性主要体现在结合容量、灵敏度、亲和力和特异性等几个方面。多克隆抗体(pAb)通常含有干扰杂质及不同抗原决定簇诱导的免疫球蛋白,因此试剂盒的检测性能受到质疑。本实验利用细胞融合技术筛选出3株杂交瘤细胞,其中N7B2具有较好的灵敏度(0.62ng/mL)。以N7B2单克隆抗体为基础,建立了间接竞争ELISA分析方法,并在家禽基质中进行了NOR残留物含量检测,获得了满意的回收率。
3.2 NOR单克隆抗体的特异性
由于FQs化合物在A环的6号位有一个氟原子,7号位有一个哌嗪环;在B环(杂环芳香环)的1号位有一个N原子,3号位有一个羧基,4号位有一个酮基,因此FQs所共有的特征性基团非常明显。NOR半抗原具备最基本的羧基、酮基和哌嗪环,而且哌嗪环上没有取代基团,是制备人工抗原的首选。本实验利用NOR上3号位羧基进行偶联,这种方式导致哌嗪环距离连结位点最远,因此抗体与环丙沙星(87.2%)、培氟沙星(76.9%)、依诺沙星(66.8%)、恩诺沙星(48.6%)和洛美沙星(36.6%)具有较高的交叉反应率。从结构上看,其它检测化合物因取代基团、空间结构差异较大,因此交叉反应性可以忽略不计,这与刘庆堂等的研究结果相一致[21]。但文献[21]制备的诺氟沙星单克隆抗体没有对前边几种重要的FQs化合物进行特异性检测。
[1]Ashwin H,Stead S,Caldow M,et al.A rapid microbial inhibition-based screening strategy foruoroquinolone and quinolone residues in foods of animal origin[J].Anal Chim Acta,2009,637(1-2):241-246.
[2]钱卓真,苏秀华,魏博娟,等.高效液相色谱法同时测定水产品6种喹诺酮药物的残留[J].食品科学,2010,31(6):185 -189.
[3]Huet A C,Charlier C,Tittlemier S A,et al.Simultaneous determination of(fluoro)quinolone antibiotics in kidney,marine products,eggs,and muscle by enzyme-linked immunosorbent assay(ELISA)[J].J Agric Food Chem,2006,54(8):2822 -2827.
[4]Lu S,Zhang Y,Liu J,et al.Preparation of anti-pefloxacin antibody and development of an indirect competitive enzymelinked immunosorbent assay for detection of pefloxacin residue in chicken liver[J].J Agric Food Chem,2006,54(19):6995 -7000.
[5]Christodoulou E A,Samanidou V F,Papadoyannis I N. Development ofan HPLC multi-residuemethod forthe determination of ten quinolones in bovine liver and porcine kidney according to the European Union Decision 2002/657/EC[J].J Sep Sci,2008,31(1):119-127.
[6]San Martin B,Cornejo J,Iraguen D,et al.Depletion study of enrofloxacin and its metabolite ciprofloxacin in edible tissues and feathers of white leghorn hens by liquid chromatography coupled with tandem mass spectrometry[J].J Food Prot,2007,70(8): 1952-1957.
[7]Dufresne G,Fouquet A,Forsyth D,et al.Multiresidue determination of quinolone and fluoroquinolone antibiotics in fish and shrimp by liquid chromatography/tandem mass spectrometry[J].J AOAC Int,2007,90(2):604-612.
[8]饶勇,曾振灵,杨桂香,等.液相色谱-质谱联用检测牛奶中氟喹诺酮类药物残留的确证方法[J].中国农业科学,2007,40(5):1033-1041.
[9]Hermo M P,Nemutlu E,K S,et al.Improved determination of quinolones in milk at their MRL levels using LC-UV,LC-FD,LC -MS and LC-MS/MS and validation in line with regulation 2002/657/EC[J].Anal Chim Acta,2008,613(1):98-107.
[10]李雅丽,郝晓蕾,冀宝庆,等.HPLC-ESI-MS/MS测定动物性食品中19种喹诺酮类药物残留的研究[J].食品科学,2008,29(8):502-506.
[11]包晓丽,任一平,张虹.超高效液相色谱电喷雾串联四极杆质谱法检测牛奶中22种喹诺酮类抗菌素[J].分析化学,2009,37(3):389-394.
[12]祝颖,张虹.UPLC-MS/MS法同时检测水产品中喹诺酮类药物残留[J].中国食品学报,2010,10(2):206-213.
[13]Huang B,Yin Y,Lu L,et al.Preparation of high-affinity rabbit monoclonal antibodies for ciprofloxacin and development of an indirect competitive ELISA for residues in milk[J].J Zhejiang Univ Sci B,2010,11(10):812-818.
[14]于海峰,张森,万忠海,等.氧氟沙星完全抗原的合成鉴定及其单克隆抗体的制备纯化[J].食品科学,2006,27(10): 223-228.
[15]姜金庆,张海棠,李广领,等.19-去甲睾酮人工抗原及免疫学特性[J].农业生物技术学报,2010,18(5):725-731.
[16]Chen Y,Wang Z,Wang Z,et al.Rapid enzyme-linked immunosorbentassay and colloidal gold immunoassay for Kanamycin and Tobramycin in swine tissues[J].J Agric Food Chem,2008,56(9):2944-2952.
[17]Wang Y C,Guo Z Q,Li Y Z,et al.Production and characterization of anti-estrone monoclonal antibody[J].Biomed Environ Sci,2002,15(2):103-112
[18]姜金庆,张海棠,王自良,等.19-去甲睾酮异源性ciELISA试剂盒的研制及应用[J].中国生物工程杂志,2010,30(9):68-74.
[19]WangL,ZhangY,GaoX,etal.Determinationof chloramphenicol residues in milk by enzyme- linked immunosorbent assay:improvement by biotin-streptavidinamplified system[J].J Agric Food Chem,2010,58(6):3265 -3270.
[20]于海峰,谭建华,孙靖,等.诺氟沙星人工抗原的合成[J].吉林农业大学学报,2007,29(4):443-446.
[21]刘庆堂,职爱民,李青梅,等.诺氟沙星单克隆抗体的制备及特性鉴定[J].中国预防兽医学报,2010,32(9):716 -720.
Preparation and application of monoclonal antibody against norfloxacin
LI Chao-ying1,2,JIANG Jin-qing2,*
(1.Centre of Laboratory Animal,Xinxiang Medical University,Xinxiang 453003,China; 2.College of Animal Science,Henan Institute of Science and Technology,Xinxiang 453003,China)
Modified EDC method was employed to synthesize the artificial antigen of norfloxacin(NOR),which was proved by Ultraviolet absorbance and IR spectra.Cell fusion technology was used to screen anti-NOR hybridoma lines,and monoclonal antibodies(mAbs)were produced by using ascitic fluid in mice.Based on this,an indirect competitive ELISA standard curve was established.This assay was sensitive and had a linear range from 0.04~43.6ng/mL(R2=0.9655),with IC50and LOD values of 0.62ng/mL and 0.02ng/mL,respectively.The produced mAbs were of the IgG1isotype with a k light chain,and mAb from N7B2 exhibited high cross-reactivities to ciprofloxacin(87.2%),pefloxacin(76.9%),enoxacin(66.8%),enrofloxacin(48.6%)and lomefloxacin(36.6%). The spiking tests indicated that the established icELISA method could be used for determination of NOR residue in poultry.
norfloxacin;artificial antigen;fluoroquinolone;monoclonal antibody;indirect competitive ELISA
Q785
A
1002-0306(2011)09-0210-04
氟喹诺酮类药物(Fluoroquinolones,FQs)是重要的合成类抗生素,它通过抑制DNA解旋酶,进而影响细菌的生长和复制,发挥抗菌效力,具有抗菌谱广、吸收好和组织穿透力强等特点,在畜牧、水产行业被广泛应用于治疗和预防细菌感染,并作为饲料添加剂促进动物的生长[1]。长期以来,我国在防治动物细菌上使用的FQs药物品种混乱,同类药物反复出现,超量使用,耐药菌株不断出现,致使药物用量不断增大,且效果不佳。而此类药物残留对人、畜毒副作用很大,甚至有致畸、致癌、致突变等危害[2]。因此,此类药物的残留问题逐渐引起人们的关注。联合国粮农组织、世界卫生组织食品添加剂专家联席委员会、欧盟制定了恩诺沙星、环丙沙星、氧氟沙星、诺氟沙星等药物在动物源食品中的最高残留标准[3];美国于2005年开始禁止恩诺沙星应用于家禽和鱼类细菌疾病的治疗;中国农业部也对此类药物的适用范围、剂量和停药期等进行了严格限定[4]。FQs残留检测的传统方法有高效液相色谱(HPLC)[2,5]、液相色谱-质谱(LC-MS)[6-8]和液相色谱-串联质谱(LC-MS/MS)[9-12]等方法。这些方法灵敏度高、特异性强,但样品前处理繁琐,不适合大批量的市场监测要求。而免疫学检测方法是建立在抗体对抗原的分子识别上,其主要优点是亲合力高、快速、简单、经济实用,能够实现对生物液体的小体积、大通量检测,逐渐成为世界各国有毒有害残留物快速检测的方法之一。本研究选用具备FQs共同结构特征的诺氟沙星(NOR)制备人工抗原,通过细胞融合技术筛选抗NOR单克隆杂交瘤细胞株,制备高亲和力单克隆抗体,建立间接竞争ELISA检测方法。该研究可以优化液质联用和气质联用等理化方法的样品前处理过程,同时为免疫检测试剂盒和试纸条的研制提供基础。
2011-05-13 *通讯联系人
李超英(1976-),女,讲师,主要从事医用昆虫与实验动物饲养管理与教学研究。
十一五国家科技支撑计划重大项目(2006BAK02A21/1);河南省教育厅科技攻关项目(2011A230003)。

