儿茶素组成对化学氧化形成茶黄素的影响机理
张建勇,江和源,*,崔宏春,江用文
(1.中国农业科学院茶叶研究所,农业部茶及饮料植物产品加工与质量控制重点开放实验室,浙江杭州310008;2.杭州市农业科学研究院茶叶研究所,浙江杭州310024)
儿茶素组成对化学氧化形成茶黄素的影响机理
张建勇1,江和源1,*,崔宏春2,江用文1
(1.中国农业科学院茶叶研究所,农业部茶及饮料植物产品加工与质量控制重点开放实验室,浙江杭州310008;2.杭州市农业科学研究院茶叶研究所,浙江杭州310024)
采用Sephadex LH-20柱色谱法分离茶多酚,获得纯度为ECG 980.0mg·g-1、EC 960.0mg·g-1、EGC 900.0mg·g-1、EGCG 980.0mg·g-1的儿茶素单体,并以制备的儿茶素单体为反应原料,按照不同的比例,进行碱性氧化和酸性氧化反应,探讨儿茶素组成对茶黄素化学氧化形成的影响及作用机理。结果表明:儿茶素碱性氧化和酸性氧化产物存在明显差异,且碱性氧化产物较酸性氧化产物复杂,存在很多未知的氧化产物,有待进一步鉴定。
儿茶素,茶黄素,化学氧化,影响,机理,碱性氧化,酸性氧化
茶黄素类物质属于植物酚性色素,具有调节血脂、抗癌、抗菌、抗病毒等多种药理活性[1-6],在食品、医药、日化等多个领域有较高的应用价值。近几年来,随着茶黄素的医药价值和保健功能逐渐被人们所认识,茶黄素形成方面的研究已成为茶叶化学研究领域的热点之一。目前,研究茶黄素的形成主要采取酶促氧化和化学氧化两种方法,且二者在茶黄素形成的作用机理方面存在一定差异,相比较而言,化学氧化可消除酶提取纯化的高难度、酶性质不稳定、反应程度难以控制及受通氧条件制约等因素的影响,大大简化反应体系,可控性强,因而成为研究儿茶素氧化作用机理及其氧化产物形成的一种简便而有效的方法。根据化学氧化剂的不同,化学氧化主要分为碱性氧化和酸性氧化。现有的研究表明,茶黄素是由儿茶素类物质以及相关的没食子酸等简单黄酮类物质,经过氧化反应聚合而成的二聚体化合物,这在两种单一的纯化合物混合溶液中,容易形成特定的茶黄素分子;同时发生的干扰反应,一般只存在于同种分子间的氧化聚合或异种分子间的多聚反应中。如需要生产制备茶黄素,由于经济原因,一般以儿茶素等混合物为原料,其中多种儿茶素的组成和比例可能不同,会导致更为复杂的氧化、聚合、缩合、络合等反应。本文以此为切入点,研究儿茶素组成对化学氧化形成茶黄素的影响及其作用机理,从反应产物儿茶素类成分化学反应的本质和机理上探讨茶黄素的形成,以期为形成和富集茶黄素提供研究思路和理论依据。
1 材料与方法
1.1 材料与仪器
茶多酚(儿茶素总量为955.0mg·g-1,其中EGC 1.2mg·g-1、D,L-C4.4mg·g-1、EGCG855.5mg·g-1、EC44.8mg·g-1、GCG7.0mg·g-1、ECG42.1mg·g-1)
海南群力药业有限公司生产;TF、TF-3-G、TF-3'-G、TF-3,3’-G标准单体 为农业部茶及饮料植物产品加工与质量控制重点开放实验室自制,经HPLC检测,纯度分别为 934.2、900.3、886.7、976.0mg·g-1,HPLC出峰时间分别为27.5、29.8、31.0、31.6min;Sephadex LH-20 购自瑞典Pharmacia公司;乙腈(色谱纯)、乙酸乙酯、柠檬酸、铁氰化钾、碳酸氢钠、硝酸铁 均为国产分析纯。
BSZ-100自动部分收集器 上海沪西分析仪器厂;玻璃色谱柱(Φ1.6cm×80cm、Φ5cm×100cm)上海华美实验仪器厂;BTOO-100M恒流泵 保定兰格恒流泵有限公司;R-124旋转蒸发仪 德国BUCHI公司;MR3001磁力搅拌器 德国Heidoph公司;KQ100E医用超声波脱气机 江苏昆山医用超声仪器有限公司;FTS-BTD冷冻干燥机 美国KINETICS公司;Agilent 1100高效液相色谱仪 美国安捷伦公司;FA-210电子天平 上海舜宇恒平科学仪器有限公司;DHG-9123A型电热恒温鼓风干燥箱
上海精密实验设备有限公司。
1.2 实验方法
1.2.1 儿茶素单体分离方法 以茶多酚(儿茶素总量为955.0mg·g-1)为分离原料,Sephadex LH-20柱色谱一次分离(色谱柱Φ5.0cm×100cm、上样浓度200mg·mL-1、100%乙醇洗脱、洗脱流速1.0mL·min-1),分离得到ECG、EGCG、EC、EGC和ECG混合物及未知物,EGC和ECG混合物经Sephadex LH-20柱色谱二次分离(色谱柱Φ1.6cm×80cm、上样浓度200mg·mL-1、60%乙醇洗脱、洗脱流速0.7mL·min-1),得到EGC和ECG,分别收集ECG、EC、EGC、EGCG洗脱液,经旋转蒸发和冷冻干燥处理,备用。
1.2.2 儿茶素单体组合化学氧化 以 EC、ECG、EGCG、EGC单体组合为反应产物,按照表1的儿茶素组成和比例,进行碱性氧化和酸性氧化。
碱性氧化方法:碱性氧化剂浓度K3Fe(CN)637.5mg·mL-1+NaHCO312.5mg·mL-1,参与氧化反应体积1mL,磁力搅拌反应20min,温度25℃(磁力搅拌器控温±1℃),反应结束后,200μL柠檬酸水溶液(pH1.79)终止反应,反应终止后立即加入等体积冰乙酸乙酯(-15℃),磁力搅拌2min后,静止分层,酯层经等体积Tris-HCl洗涤1次,磁力搅拌2min后,合并酯层,放入4℃冰箱中待测。
酸性氧化方法:酸性氧化剂浓度10mg·mL-1,参与氧化反应体积1mL,磁力搅拌反应20min,温度25℃(磁力搅拌器控温±1℃),反应结束后,低温终止反应,反应终止后,立即加入等体积冰乙酸乙酯(-15℃),磁力搅拌2min后,静止分层,合并酯层,放入4℃冰箱中待测。
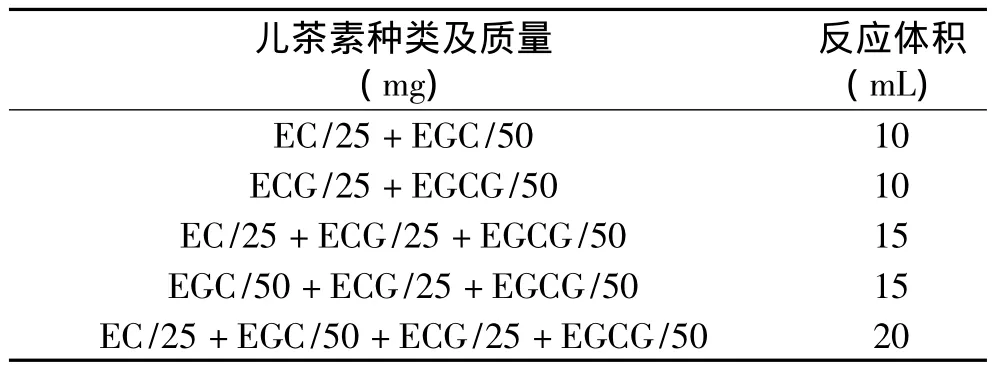
表1 儿茶素单体及组合化学氧化
1.2.3 HPLC检测方法 儿茶素HPLC检测方法:色谱柱Hypersil BDS C18(4.6mm×150mm,5μm),流动相A为2%乙酸,流动相 B为100%乙腈,流速1.0mL/min,柱温 30℃,检测波长 280nm,进样量5μL,梯度洗脱,流动相B在12min内由6.5%线性梯度变化到8%,16min变化到15%,20min变化到25%,26min回到初始状态,平衡5min。
茶黄素HPLC检测方法:色谱柱Hypersil BDS C18(4.6mm×150mm,5μm),流动相A为2%乙酸,流动相B为100%乙腈,流速1.5mL·min-1,柱温40℃,检测波长380nm,进样量5μL,梯度洗脱,流动相B在35min内由8%线性梯度变化到26%,40min回到初始状态,平衡5min。
2 结果与分析
2.1 儿茶素单体分离
茶多酚经Sephadex LH-20柱色谱二次分离,得到ECG、EC、EGC、EGCG,经HPLC检测,儿茶素单体纯度分别为 ECG980.0mg·g-1、EC960.0mg·g-1、EGC900.0mg·g-1、EGCG980.0mg·g-1(见图1)。
2.2 EC+EGC氧化产物
从图2可以看出,非酯型儿茶素(-)-表儿茶素与(-)-表没食子儿茶素(EC+EGC)碱性氧化产物单一,有1个主要 HPLC峰(峰1出峰时间27.519min);酸性氧化产物有一个主要HPLC峰(峰2出峰时间24.201min),以及1个小峰(峰3出峰时间27.503min),酸性氧化产物峰3同碱性氧化产物中峰1出峰时间相同,根据四种主要茶黄素标准单体HPLC出峰时间,该出峰时间对应的物质为TF,说明非酯型儿茶素(-)-表儿茶素与(-)-表没食子儿茶素)(EC+EGC)碱性和酸性氧化都可以得到TF,但是酸性氧化产物中还有一个主要未知物(峰2出峰时间24.201min)。Davies AP等[7]研究表明,EGC和 C可形成 Neotheaflavin,GC和 EC可形成Isotheaflavin。另外,Tanaka T等[8]研究表明,TF和TF可聚合形成Bistheaflavin A和Bistheaflavin B。茶树新梢中的多酚氧化酶,可催化儿茶素B环C2位置发生差向立体异构化作用,从而导致EC、EGC差向异构形成C、GC。本实验中,有酸性氧化产物峰2这个未知峰,推测EC+EGC在碱性和酸性条件下,也可能发生差向立体异构化作用形成C、GC,从而导致EGC和C反应、GC和EC反应,甚至TF和TF反应,生成Davies AP等和Tanaka T等研究得出的四种物质,但是这个未知峰对应这四种物质中的哪一种物质,需要进一步研究。

图1 儿茶素Sephadex LH-20柱色谱法分离TP(a)、EC(b)、EGCG(c)、ECG(d)、EGC(e)280nmHPLC图
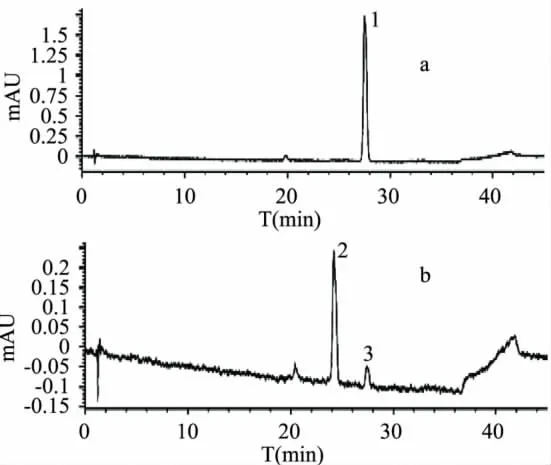
图2 EC和EGC碱性(a)和酸性(b)氧化产物380nmHPLC图
2.3 EGCG+ECG氧化产物
从图3可以看出,酯型儿茶素(-)-表儿茶素没食子酸酯与(-)-表没食子儿茶素没食子酸酯(EGCG+ECG)碱性和酸性氧化产物都比较复杂。碱性氧化产物有一个主要峰,即峰4(出峰时间为31.611min),以及3个小峰,即峰1、峰2、峰3,出峰时间分别为20.851、23.576、31.025min;酸性氧化产物主要峰为峰8(出峰时间25.653min),以及5个小峰,即峰5、峰6、峰7、峰9、峰10,出峰时间分别为19.181、20.756、22.039、28.101、31.038min。根据四种主要茶黄素标准单体HPLC出峰时间,碱性氧化产物主要峰4和酸性氧化产物小峰10为TF-3,3'-G(由EGCG和ECG形成),碱性氧化产物小峰3和酸性氧化产物峰10为TF-3'-G(由EGC和ECG形成),但是酯型儿茶素(EGCG+ECG)氧化体系的反应物中,并没有EGC,但在产物中却有TF-3'-G生成,说明EGC是在酯型儿茶素碱性氧化的过程中产生的,推测可能是EGCG脱没食子酰基形成的。而EGCG+ECG酸性氧化产物中没有此物质。Wan XC等[9]研究发现,ECG和 ECG形成 Theaflavate A。碱性氧化产物峰2~峰3和酸性氧化产物峰5~峰9等未知峰,其中一个未知峰有可能是 Theaflavate A,需要进一步分析。
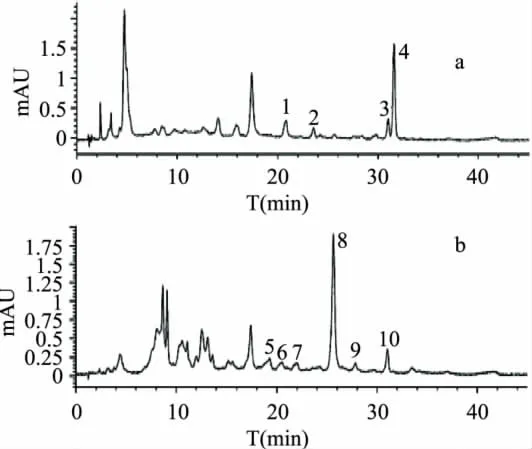
图3 ECG和EGCG碱性(a)和酸性(b)氧化产物380nmHPLC图
2.4 EGCG+ECG+EC氧化产物
从图4可以看出,酯型儿茶素(-)-表儿茶素没食子酸酯、(-)-表没食子儿茶素没食子酸酯)与(-)-表儿茶素(EGCG+ECG+EC)碱性氧化产物复杂,有1个主要HPLC峰(峰6出峰时间31.611min),以及5个小峰,即峰1~峰5,出峰时间分别为21.257、23.582、25.685、27.673、31.037min,根据四种主要茶黄素标准单体HPLC出峰时间,峰4、峰5、峰6分别为TF、TF-3’-G、TF-3,3'-G,而现有研究表明,TF由EC和EGC形成,TF-3'-G由ECG和EGC组成,TF-3,3'-G由ECG和EGCG组成,但是反应物中没有EGC,氧化产物中却有TF-3'-G生成,由此可再次推测,EGCG在碱性氧化中可能由脱没食子酰基作用形成EGC。Lewis JR等[10]研究发现,EGCG和 C形成Neotheaflavin-3-gallate,ECG和 EC形成 Theaflavate B。Sang S等研究发现,ECG和C形成NeoTheaflavate B。Wan XC等[9]研究发现,ECG和 ECG形成Theaflavate A。EGCG+ECG+EC碱性氧化产物未知峰峰1~峰3能否就是上述四种物质,需要进一步分析。
EGCG+ECG+EC组合碱性氧化产物图4(a)与EGCG+ECG配对碱性氧化与图3(a)相比,前者碱性氧化产物图比后者多两个峰,即EGCG+ECG+EC碱性氧化产物峰3和峰4,可推测峰3和峰4未知物的形成可能有EC参与;二者酸性氧化产物图比较后发现,前者酸性氧化没有产物出现,只有ECG的大量残留,而后者的酸性氧化产物复杂。
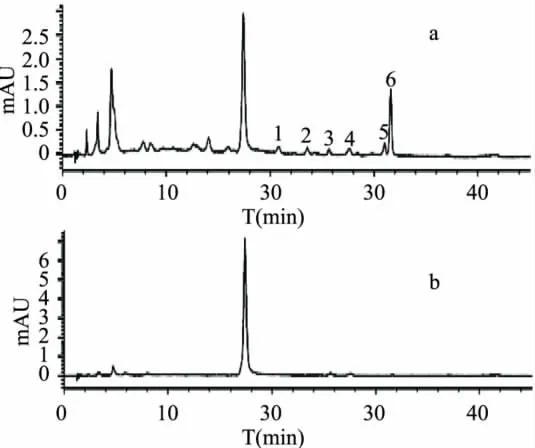
图4 ECG、EGCG和EC碱性(a)和酸性(b)氧化产物380nmHPLC图
2.5 EGCG+ECG+EGC氧化产物
从图5可以看出,酯型儿茶素(-)-表儿茶素没食子酸酯、(-)-表没食子儿茶素没食子酸酯)与(-)-表没食子儿茶素(EGCG+ECG+EGC)碱性氧化产物HPLC峰复杂,有1个主要峰(峰4出峰时间31.024min),以及四个小峰,即峰1、峰2、峰3、峰5,出峰时间分别为23.721、24.198、25.664、31.608min;根据四种主要茶黄素标准单体HPLC出峰时间,峰4、峰5分别为TF-3'-G、TF-3,3'-G。Davis A L等[11]研究发现,在红茶发酵过程中,EGC和EGCG还可在酶的作用下,通过B环酚羟基的氧化和次级环化作用形成一类色素物质 Theacitrin。EGCG+ECG+ EGC氧化产物未知峰峰1、峰2、峰3和峰5,有可能其中一种物质就是Theacitrin。
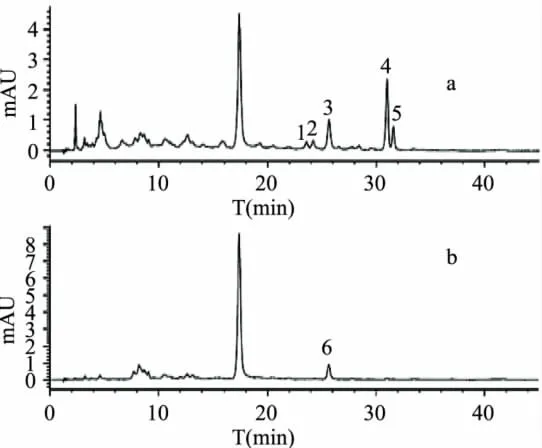
图5 ECG、EGCG和EGC碱性(a)和酸性(b)氧化产物380nmHPLC图
EGCG+ECG+EGC酸性氧化产物有1个未知峰,即峰6,出峰时间为25.650min,且峰6与碱性氧化HPLC峰3出峰时间接近,可能为同一未知物质。由此可知,EGCG+ECG+EGC组合碱性氧化可得到较多酯型茶黄素(TF-3'-G、TFDG),尤其是单酯型茶黄素TF-3'-G。另外,EGCG+ECG+EGC碱性氧化和酸性氧化产物图中,均有一个峰高值很大的主峰(出峰时间17.5min),与ECG单体空白对照图4比较后发现,这个主峰就是ECG,说明ECG在碱性氧化和酸性氧化中均比较稳定。
EGCG+ECG+EGC碱性氧化产物图5(a)与 EGCG+ECG碱性氧化产物图3(a)相比,前者可得到较多单酯型儿茶素TF-3'-G,而后者可得到较多的双酯型儿茶素TFDG,说明EGC对TFDG形成的影响较大,它可以与EGCG竞争,在EGC、EGCG、ECG三者共存的情况下,EGC与ECG的反应占主导,从而导致三者组合碱性氧化可得到较多单酯型茶黄素TF-3'-G。EGCG+ECG+EGC酸性氧化产物图5(b)与EGCG+ECG酸性氧化产物图3(b)相比,后者氧化产物峰较复杂,且前者的峰6与后者图谱中峰8出峰时间相近,可能为同一物质,说明在酸性氧化体系中,EGCG+ECG+EGC组合酸性氧化产物相对单一。
2.6 EGCG+ECG+EC+EGC氧化产物
从图6可以看出,酯型儿茶素(-)-表儿茶素没食子酸酯、(-)-表没食子儿茶素没食子酸酯)与非酯型儿茶素(-)-表没食子儿茶素、(-)-表儿茶素) (EGCG+ECG+EC+EGC)碱性氧化产物HPLC峰复杂,有3个主要峰(峰1出峰时间25.663min、峰2出峰时间31.032min、峰3出峰时间31.625min),以及一些杂峰。根据四种主要茶黄素标准单体HPLC出峰时间,峰2、峰3分别为TF-3'-G、TF-3,3'-G;其酸性氧化产物有1个未知峰峰1(出峰时间为25.640min),且峰4与碱性氧化HPLC峰1出峰时间接近,可能为同一个未知物质。由此可知,EGCG+ ECG+EC+EGC组合碱性氧化可得到较多酯型茶黄素,尤其是单酯型茶黄素TF-3'-G。Sang S等[12]研究发现,TFDG 可 与 两 分 子 EC 形 成Theadibenzotropolone A。EGCG+ECG+EC+EGC碱性氧化产物峰1,有可能就是Theadibenzotropolone A。EGCG+ECG+EC+EGC酸性氧化产物图只有1个峰(峰4出峰时间25.652min),这个峰出峰时间和碱性氧化产物峰1出峰时间相近,有可能为同一物质。
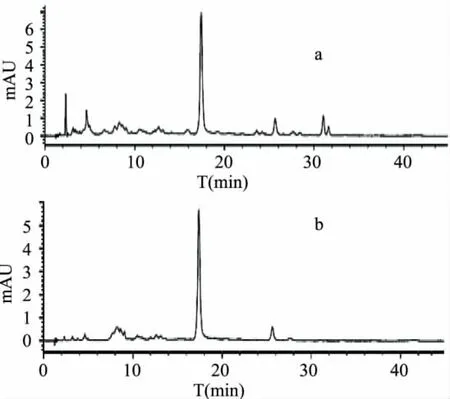
图6 ECG、EGCG和EGC、EC碱性(a)和酸性(b)氧化产物380nmHPLC图
EGCG+ECG+EC+EGC组合氧化图6和EGCG+ECG+EGC图5组合氧化比较分析,二者碱性和酸性氧化产物HPLC出峰数和出峰时间非常相近,且均有TF-3'-G和TFDG形成,但却都没有TF-3-G形成,说明EC对四种主要儿茶素组合氧化影响较小,即EC对酯型茶黄素形成影响较小。EGCG+ ECG+EC+EGC组合氧化图6和EGCG+ECG+EC组合氧化图4比较分析后发现,二者化学氧化产物略有不同,前者碱性氧化可得到较多单酯型茶黄素TF-3'-G,而后者碱性氧化可得到较多双酯型茶黄素TF-3,3'-G,进一步验证了EC对酯型茶黄素形成影响较小的推论,并且说明ECG、EGCG与EGC反应之间存在竞争作用,EGC与ECG的结合作用大于EGCG与ECG的结合作用,从而造成图6中单酯型茶黄素TF-3'-G较多,而图4中TFDG较多的情况。
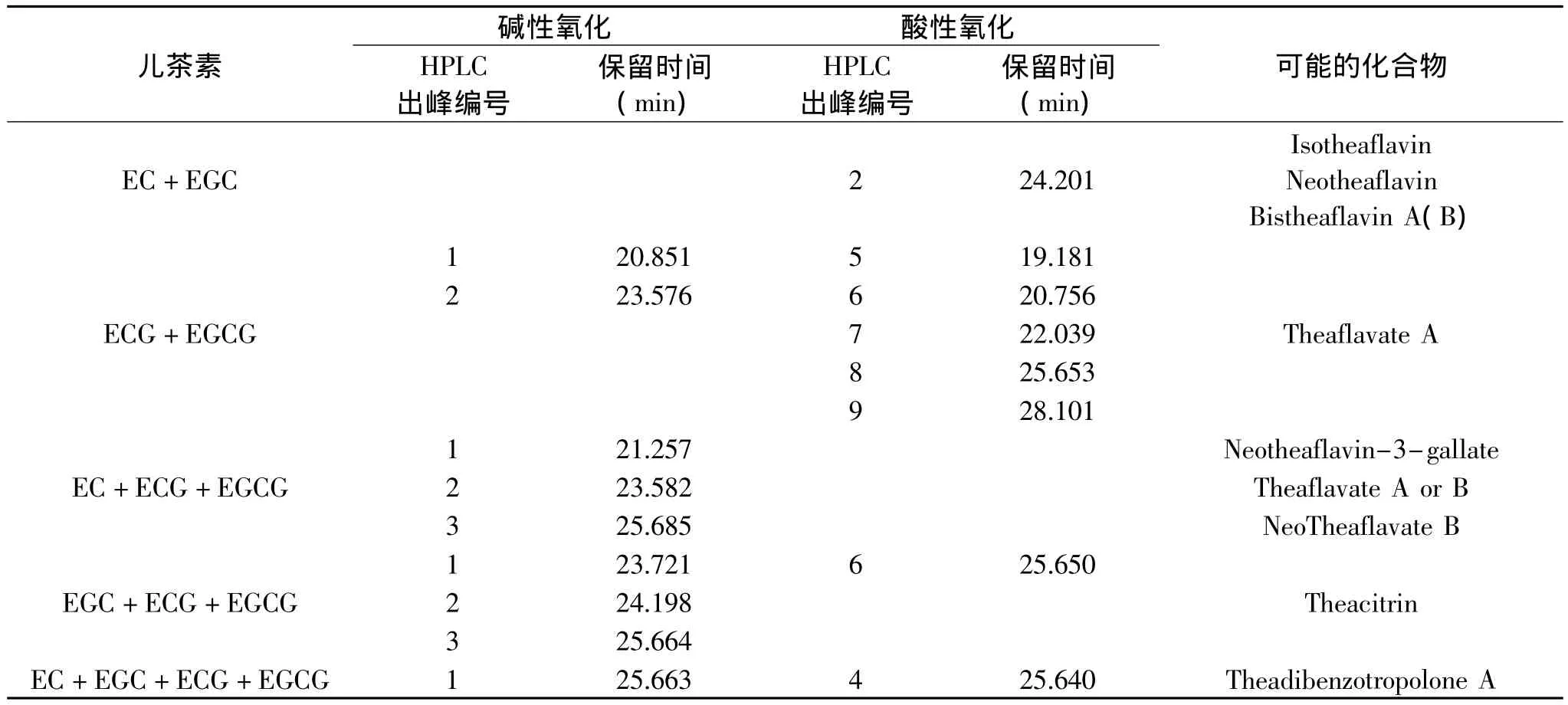
表2 儿茶素组合化学氧化未知物分析
EGCG+ECG+EC+EGC组合氧化图6和EGCG+ECG配对氧化图3比较后发现,后者碱性氧化和酸性氧化产物均较前者复杂,且后者较前者能得到更多TFDG,说明EC和EGC的确不利于TFDG的形成,同时也说明了EGCG和ECG在氧化形成TFDG的过程中,还发生其他复杂的反应,推测可能是发生EGCG和ECG脱没食子酰基作用后,又发生了复杂的化学反应,生成复杂的氧化产物成分;再者,从另外一个角度也说明了,儿茶素组合氧化的复杂相互作用,可能抑制一些副产物生成,使终产物相对单一,从而有利于提高产物中酯型茶黄素的纯度。EGCG+ECG+EC+EGC组合氧化图6和ECG+EC配对氧化图2比较后发现,前者氧化产物较后者复杂,前者碱性氧化能得到较多酯型茶黄素(TF-3'-G和TFDG),后者碱性氧化只得到TF;前者酸性氧化产物中没有 TF,只有一个未知峰 4(出峰时间25.652min),后者酸性氧化产物有少量TF生成,并有一个主要的未知物生成,说明儿茶素组合碱性氧化能得到较多酯型茶黄素,儿茶素组合酸性氧化产物相对较单一。
3 讨论
初步探明了反应本质对酯型茶黄素化学氧化形成的影响及作用机理,即在不同组成的儿茶素化学氧化体系中:ECG在碱性氧化和酸性氧化体系中均是比较稳定的;EC对酯型茶黄素化学氧化形成的影响较小;EGC有利于单酯型茶黄素碱性氧化形成,不利于TFDG碱性氧化形成,并且对茶黄素类物质酸性氧化形成不利;在碱性氧化体系中,EGCG可能发生B环脱羟基作用变成ECG,或者EGCG可能发生脱没食子酰基作用变成EGC,从而使儿茶素碱性氧化产物更加复杂;EGCG和ECG对单酯型茶黄素和双酯型茶黄素形成均有利;EC、EGC、ECG、EGCG之间存在复杂的竞争与协同作用,且EGC与ECG的氧化反应占主导作用,EGC与EGCG的氧化反应次之,从而有利于单酯型茶黄素TF-3'-G在氧化产物中的富集,而不利于TFDG的形成;总结出儿茶素组合化学氧化的未知产物。本研究立足于茶黄素化学氧化形成的影响因素及作用机理做了初步探索,以期为形成和富集茶黄素提供研究思路和理论依据。
[1]Alyssa G Schuck,Miriam B Ausubel,Harriet L Zuckerbraun,et al.Theaflavin-3,3’-digallate,a component of black tea:An inducer of oxidative stress and apoptosis[J].Toxicology in Vitro,2008,22(3):598-609.
[2]Sahdeo Prasad,Jaspreet Kaur,Preeti Roy,et al.Theaflavins induce G2/M arrest by modulating expression of p21waf1/cip1,cdc25C and cyclin B in human prostate carcinoma PC-3 cells[J].Life Sciences,2007,81(17-18):1323-1331.
[3]H Babich,SM Pinsky,ET Muskin,HL,et al.In vitro cytotoxicity of a theaflavin mixture from black tea to malignant,immortalized,and normal cells from the human oral cavity[J]. Toxicology in Vitro,2006,20(5):677-688.
[4]Shuwen Liu,Hong Lu,et al.Theaflavin derivatives in black tea and catechin derivatives in green tea inhibit HIV-1 entry by targeting gp41[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2005,1723(1-3):270-281.
[5]Elvira Gonzalez de Mejia,Marco Vinicio Ramirez-Mares,Sirima Puangpraphant,et al.Bioactive components of tea:Cancer,inflammation and behavior[J].Brain,Behavior,and Immunity,2009,23(6):721-731.
[6]Yatao Du,Yunfei Wu,Xueli Cao,et al.Inhibition of mammalian thioredoxin reductase by black tea and its constituents:Implications for anticancer actions[J].Biochimie,2009,91(3):434-444.
[7]Davies AP,Goodsall C,Cai Y,et al.Black tea dimeric and oligomeric pigments-Structures and formation[J].New York: Kluwer Academic/Plenum Publishers,1999:697-723.
[8]Tanaka T,Inoue K,Betsunriya Y,et al.Two types of oxidative dimerization of the black tea polyphenol theaflavin[J].Agric Food Chem,2001,49:5785-5789.
[9]Xiaochun Wan,Harry E Nursten,Ya CAI,et al.A new type of tea pigments-from the chemical oxidation of epicatechin gallate and isolated from tea[J].J Sci Food Agric,1997,74:401-408.
[10]Lewis JR,DavisAL,YaCai,etal.TheaflavateB,Isotheaflavins-3'-O-gallate and Neotheaflavins-3-O-gallate: three polyphenolic pigments from black tea[J].Phytochemistry,1998,49(8):2511-2519.
[11]Sang S,Lambert JD,Tian S,et al.Enzymatic synthesis of tea theaflavin derivatives and their anti-inflammatory snd cytotoxle activities[J].Bioorg Med Chem,2004,12:459-467.
[12]Davis AP Cai Y,Davis AL,et al.Polyphenol dimers of black tea[C].1997 Chinese international tea technology and tea culture meeting,1997(5):8-12.
Preliminary discussion on the influence mechanism of catechins composition on the chemical oxidation formation of theaflavins
ZHANG Jian-yong1,JIANG He-yuan1,*,CUI Hong-chun2,JIANG Yong-wen1
(1.Tea Research Institute of CAAS,Key Laboratory of Tea and Beverage Plant Products Processing and Quality Control of Agriculture Ministry,Hangzhou 310008,China; 2.Tea Research Institute of Hangzhou Academy of Agriculture,Hangzhou 310024,China)
The method of sephadex LH-20 column chromatography was used to separation tea polyphenol.Then,the catechin monomers were obtained,such as ECG,EC,EGC,EGCG,which purity separately was 980.0,960.0,900.0,980.0mg·g-1.According to the different proportion,the prepared catechin monomers were reacted with the alkalinity oxidation and the acidity oxidizing reaction.The influence and action mechanism of catechins composition on the chemical oxidation formation of theaflavins were discussed.The result indicated that the alkalinity oxidation and acidity oxidation product of catechins existed obvious difference,and the alkalinity oxidation products were more complex than the acidity oxidation products.The unknown oxidation products needed further study.
catechins;theaflavins;chemical oxidation;influence;mechanism;alkalinity oxidation;acidity oxidation
TS201.2
A
1002-0306(2011)12-0085-06
2010-04-28 *通讯联系人
张建勇(1982-),男,助研,硕士,主要从事天然产物研究与开发。
国家863项目(2007AA10Z303);国家自然科学基金项目(30570191);基本科研业务费专项(0032010033)。

