透性化处理提高黑曲霉细胞α-葡萄糖苷酶的表观转苷活力
陈桂光,李 玮,符佳精,张云开,梁智群,*
(1.广西大学生命科学与技术学院,广西南宁530005; 2.广西亚热带生物资源保护利用重点实验室,广西南宁530004; 3.广西大学轻工与食品工程学院,广西南宁530004)
透性化处理提高黑曲霉细胞α-葡萄糖苷酶的表观转苷活力
陈桂光1,2,李 玮2,3,符佳精1,2,张云开1,2,梁智群1,2,*
(1.广西大学生命科学与技术学院,广西南宁530005; 2.广西亚热带生物资源保护利用重点实验室,广西南宁530004; 3.广西大学轻工与食品工程学院,广西南宁530004)
黑曲霉菌株D-597所产α-葡萄糖苷酶是胞内酶,完整细胞呈现的酶活力较低。研究了吐温-80、十六烷基溴化铵(CTAB)、乙醚、丙酮、戊二醛、乙醇等渗透剂的透性化效果,并对最适渗透剂戊二醛的透性化条件进行了优化,最优透性化处理条件为:每1g湿菌丝体添加30mL浓度为10%(v/v)的戊二醛溶液,处理温度30℃,处理时间60min。制备所得的透性化细胞的表观酶活达到483.9U/g湿菌体,是完整细胞表观酶活的193.3%。使用透性化细胞转化生产低聚异麦芽糖(IMO),其转化周期为24h,较完整细胞缩短24h,转化率保持在70%以上,具有一定的工业化应用前景。
黑曲霉,低聚异麦芽糖,透性化,α-葡萄糖苷酶
功能性低聚糖因其具有多种独特生理功能,正日渐广泛地被应用于食品工业当中。低聚异麦芽糖(Isomaltooligosaccharides,IMO)作为一种重要的低聚糖产品,味质柔和,性质稳定,具有能促进人体内益生菌-双歧杆菌的生长繁殖、调理肠道功能、预防龋齿等诸多的保健作用[1-2]。通过添加IMO还能防止淀粉老化,延长食品的保存时间[3]。目前,低聚异麦芽糖主要是采用酶转化法进行生产,先用高温α-淀粉酶对淀粉浆进行液化,再用β-淀粉酶或真菌淀粉酶进行糖化,在糖化过程中或结束后添加α-葡萄糖苷酶催化淀粉糖化液进行转苷反应,生成IMO糖浆[4]。虽然该生产工艺较为成熟,但需要大量使用价格较为昂贵的酶制剂,糖化及转苷工序较繁杂,且产品糖浆中IMO的实际含量仅为50%~60%,这些都对低聚异麦芽糖产品生产成本的降低及后续精制造成了不利影响。黑曲霉具有较强的产生真菌淀粉酶及α-葡萄糖苷酶的能力,能够使淀粉液化液转化生成IMO糖浆。我们在先前的研究中选育获得了一株产α-葡萄糖苷酶能力较强的黑曲霉菌株D-597,其能以高转化率催化淀粉液化液生产IMO糖浆。由于具有转苷活性的α-葡萄糖苷酶为胞内酶,若直接用菌体催化转化反应,细胞壁及细胞膜会阻碍底物及产物在细胞内外的交换,造成酶的表观活力较低。因此,本研究通过细胞透性化方法改善菌体通透性,提高α-葡萄糖苷酶的表观转苷活力,以进一步提高转化生产IMO的效率,为IMO的生产提供新方法。

表1 不同渗透剂处理对α-葡萄糖苷酶表观酶活的影响
1 材料与方法
1.1 材料与仪器
黑曲霉(Aspergillus niger)D-597 广西大学生命科学与技术学院食品与发酵工程研究所保藏;斜面种子培养基(g/L) 麦芽汁干粉20、琼脂15、pH6;液体发酵培养基(g/L) 麸皮30、木薯淀粉200(经α-淀粉酶液化);十六烷基三甲溴化铵(CTAB)、乙醚、乙醇、丙酮、戊二醛、吐温-80 国药集团化学试剂有限公司;葡萄糖、麦芽糖、异麦芽糖、麦芽三糖、潘糖、异麦芽三糖标准品 Sigma公司。
LC-10AT型高效液相色谱仪 日本岛津公司; Labfors3 Fermentor 3L发酵罐 瑞士 infors-ht公司; METTLER TOLEDO 320 pH计、METTLER TOLEDO PL303精密电子天平 德国METTLER公司;SKY-211B振荡培养箱、SKJH-1109超净工作台 上海苏坤公司;SPX-250恒温培养箱 上海跃进医疗器械厂。
1.2 实验方法
1.2.1 黑曲霉D-597菌丝体的培养 取培养3d长满成熟孢子的斜面,用无菌水将孢子洗下,转移至盛有玻璃珠的100mL无菌三角瓶中,振荡30min将孢子充分振荡打散后,用血球计数板计算孢子数并调节孢子浓度至106个/mL。将所制得的孢子悬浮液按10%(v/v)的量接种到装有2L液体发酵培养基的3L小试发酵罐中。培养条件为:培养温度37℃,搅拌转速400r/min,通气量1L/min,培养时间60h。真空抽滤收集培养所得的菌丝体,用去离子水反复洗涤3次后用于透性化处理。
1.2.2 透性化处理方法 分别取1g黑曲霉菌丝体,各自悬浮于50mL pH5.0柠檬酸缓冲液配制而成的质量浓度为5%的CTAB、吐温-80溶液及体积比为5%的乙醚、乙醇、丙酮、戊二醛溶液中,30℃,160r/min振荡60min,抽滤收集处理后的菌丝体,用上述柠檬酸缓冲液洗涤3次,测定α-葡萄糖苷酶转苷活力。
1.2.3 粗酶液的制备 采用国外已报道的α-葡萄糖苷酶粗酶液制备方法制备粗酶液[5]。
1.2.4 酶活测定方法 将得到的透性化细胞悬浮于50mL由pH5.0柠檬酸缓冲液配制而成的250g/L麦芽糖溶液中,于55℃、160r/min振荡反应1h后,沸水浴10min终止反应。参照GB/T20881-2007《低聚异麦芽糖》强制性国家标准中IMO含量的检测方法检测反应产物中异麦芽糖、潘糖的含量。
α-葡萄糖苷酶转苷活力单位的定义[5]:在上述条件下,每小时转化生成1μmol异麦芽糖或潘糖所需的酶量为一个酶活单位U。透性化细胞表观酶活力以U/g湿细胞表示[6]。
1.2.5 透性化处理对α-葡萄糖苷酶热稳定性的影响 分别将完整细胞、透性化细胞及由相同湿细胞量制备成的粗酶液,分别于30~70℃下保温2h后,在酶转苷反应最适温度55℃下测定其相对酶活力。
1.2.6 透性化黑曲霉细胞转化木薯淀粉液化液生产IMO糖浆 各取3g(约相当于100mL发酵液中分离获得的菌体细胞量)透性化细胞和完整细胞,分别与100mL淀粉含量为250g/L的淀粉液化液充分混匀,于55℃、160r/min振荡条件下反应,观察IMO的生成情况。
2 结果与讨论
2.1 最适渗透剂的选择
渗透剂提高胞内酶表观酶活的机理是改变细胞壁及细胞膜的通透性[7],由于不同微生物的细胞壁及细胞膜的组成结构不尽相同,所以需要试用多种不同渗透剂,对比其透性化处理效果,选择最适的渗透剂。如表1所示,除乙醇处理的细胞表观酶活反而低于完整细胞外,其余渗透剂均能不同程度地提高细胞α-葡萄糖苷酶的表观酶活。其中经戊二醛处理的细胞表观酶活最高,故选择戊二醛进行进一步研究。
2.2 戊二醛浓度对α-葡萄糖苷酶表观酶活的影响
分别取1g黑曲霉菌丝体,各自悬浮于50mL pH5.0柠檬酸缓冲液配制而成的不同浓度戊二醛溶液中,在30℃下以160r/min振荡60min,测定细胞的表观酶活,结果如图1所示。随戊二醛浓度的增加,细胞的表观酶活逐渐增加,当戊二醛浓度达到10% (v/v)时,细胞的表观酶活达到最大值480.1U/g湿细胞,在此后继续提高戊二醛的浓度,表观酶活反而降低,且处理后的菌体颜色会由白色变为灰色,说明高浓度的戊二醛可能会导致酶变性失活。

图1 戊二醛浓度对α-葡萄糖苷酶表观酶活的影响
2.3 戊二醛处理时间对α-葡萄糖苷酶表观酶活的影响
分别取1g黑曲霉菌丝体,各自悬浮于50mL pH5.0柠檬酸缓冲液配制而成的10%(v/v)戊二醛溶液中,在30℃下以160r/min振荡不同的时间,测定细胞的表观酶活,结果如图2所示。当透性化处理时间为60min时,细胞的表观酶活最高,过度延长处理时间反而会使细胞的表观酶活下降。
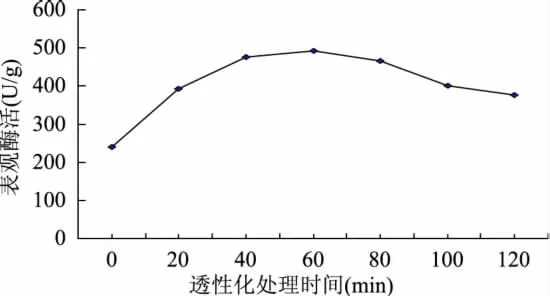
图2 戊二醛处理时间对α-葡萄糖苷酶表观酶活的影响
2.4 戊二醛处理温度对α-葡萄糖苷酶表观酶活的影响
分别取1g黑曲霉菌丝体,各自悬浮于50mL pH5.0柠檬酸缓冲液配制而成的10%(v/v)戊二醛溶液中,在不同温度下以160r/min振荡60min,测定细胞的表观酶活,结果如图3所示。结果表明,在室温下对黑曲霉菌丝体进行透性化处理,温度对于表观酶活的影响不大。

图3 戊二醛处理温度对α-葡萄糖苷酶表观酶活的影响
2.5 戊二醛溶液最小用量的确定
分别取1g黑曲霉菌丝体,各自悬浮于不同体积的pH5.0柠檬酸缓冲液配制而成的10%(v/v)戊二醛溶液中,在30℃下以160r/min振荡60min,测定细胞的表观酶活,结果如图4所示。结果表明,处理1g黑曲霉菌丝体以达到最佳透性化效果所需的戊二醛溶液量约为30mL,过多的戊二醛溶液添加量并不能进一步提高透性化的效果。

图4 戊二醛用量对α-葡萄糖苷酶表观酶活的影响
2.6 戊二醛处理对α-葡萄糖苷酶热稳定性的影响
分别将完整细胞、透性化细胞及粗酶液于不同温度下保温2h,测定其残余酶活力。结果如图5所示,完整细胞中α-葡萄糖苷酶的热稳定性最佳,但其所表现出的表观酶活较低;透性化细胞虽然由于细胞壁及细胞膜受到一定的破坏,热稳定性有所下降,但其在30~60℃保温2h后的残余酶活远高于未经处理的细胞;粗酶液中α-葡萄糖苷酶的活力虽高于同等质量的完整湿细胞,但其热稳定性最差。说明透性化处理能在不严重影响α-葡萄糖苷酶热稳定性的情况下,大幅度提高细胞α-葡萄糖苷酶的表观酶活性。

图5 戊二醛处理对α-葡萄糖苷酶热稳定性的影响
2.7 透性化黑曲霉细胞转化木薯淀粉液化液生产IMO
完整细胞与透性化细胞转化木薯淀粉液化液生成IMO的转化曲线如图6所示。结果表明,透性化细胞转化生成IMO的速度更快,其转化周期由完整细胞所需的48h左右缩短至约24h;使用透性化细胞的转化率为73.2%,完整细胞为75.0%,二者的转化率大体相当。

图6 透性化细胞与完整细胞转化IMO的生成曲线对比
3 结论
目前国内已报道的通过透性化处理提高细胞的胞内酶表观酶活的研究并不多[6-10]。本实验采用戊二醛作为渗透剂,通过透性化处理成功的大幅度提高了黑曲霉细胞α-葡萄糖苷酶表观酶活力。最优透性化处理条件为:10%(v/v)戊二醛,30℃,处理时间60min,处理1g湿菌丝体需要30mL戊二醛溶液。经最优条件处理后,透性化细胞的酶活达到483.9U/g湿菌体,是完整细胞酶活的193.3%。使用制备出的透性化细胞转化生产IMO,其转化周期较完整细胞缩短了24h,转化率保持在70%以上,高于传统的IMO生产技术[4],具有一定的工业化应用前景。
[1]毕金峰,王天荣,刘长江.分离纯化低聚异麦芽糖的酵母菌菌株筛选[J].沈阳农业大学学报,2002,33(2):126-128.
[2]王岁楼,张欣,王平诸,等.α-葡萄糖苷酶产生菌的筛选及其产酶条件的研究[J].郑州粮食学院学报,1997,18(2): 69-73.
[3]冯书领.新型糖源—低聚异麦芽糖[J].食品工业科技,1999(S1):112-114.
[4]Kuriki T,Yanase M,Takata H,et al.A new way of producing isomalto-oligosaccharide syrup by using the transglycosylation reaction of neopullulanase[J].Appl Environ Microbiol,1993,59 (4):953-959.
[5]Sheu DC,Duan KJ,Lin CT.Purification and characterization of α-glucosidase from aspergillus carbonarious[J].Biotechnol Tech,1994,8(7):515-520.
[6]魏明,崔玮,薛正莲.透性化处理对嗜酸乳杆菌细胞亚油酸异构酶静观活力的影响[J].食品工业科技,2010,31(4): 159-161.
[7]周帅,王凤山.细胞透性化技术及其应用[J].生命的化学,2008,28(4):481-484.
[8]于明安,朱晓冰,祁巍,等.CTAB透性化酵母细胞生物催化合成(S)-(+)-3-羟基丁酸乙酯[J].催化学报,2005,26 (7):609-613.
[9]薛璐,马莺.透性化海藻糖合酶的研究[J].食品科学,2003,24(3):26-29.
[10]张峻,陈晓云,齐欣,等,透性化细胞海藻糖合酶的制备及其性质研究[J].南开大学学报,2005,38(5):93-96.
Permeabilization of Aspergillus niger for enhancing apparent transglucosylation activity of α-glucosidase
CHEN Gui-guang1,2,LI Wei2,3,FU Jia-jing1,2,ZHANG Yun-kai1,2,LIANG Zhi-qun1,2,*
(1.College of life Science and Technology,Guangxi University,Nanning 530005,China; 2.Guangxi Key Laboratory of Subtropical Bioresources Conservation and Utilization,Nanning 530004,China; 3.College of Light Industry and Food Engineering,Guangxi University,Nanning 530004,China)
α-glucosidase was an intracellular enzyme in Aspergillus niger.The whole cells of Aspergillus niger exhibited low transglucosylation activity.Various chemical agents such as tween-80,cetyltrimethylammoinium bromide,diethyl ether,acetone,glutaral and ethanol were used to permeabilize the mycelium and demonstrated that glutaral was the most effective of them.The maximum transglucosylation activity(483.9U/g wet cells,increased by 93.3%compared to the whole cells)was obtained when cells were treated with 30mL 10%(v/v)glutaral per gram wet cells at 30℃ for 60min.The permeabilized Aspergillus niger cells convert liquefied cassava starch to isomaltooligosaccharides(IMO)within 24h(shorten by 24h than the whole cells),the IMO yield accounted for 70%,demonstrating the research had great potential on IMO industrial production.
Aspergillus niger;isomaltooligosaccharides;permeabilization;alpha-glucosidase
TS201.2+5
A
1002-0306(2011)12-0072-04
2010-12-14 *通讯联系人
陈桂光(1963-),男,学士,副教授,主要从事食品与发酵工程方面的研究工作。
国家自然科学基金项目(20362001);国家“863”项目(2006AA10Z339)。

