MPEG-SS修饰对DHPM去折叠胰蛋白酶相对活性、热稳定性和动力学参数的影响
邹立强,刘 伟,刘军平,刘成梅
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
MPEG-SS修饰对DHPM去折叠胰蛋白酶相对活性、热稳定性和动力学参数的影响
邹立强,刘 伟*,刘军平,刘成梅
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
采用ω-琥珀酰酯酸琥珀酰亚胺酯活化的α-甲氧基-聚乙二醇(mPEG-SS),修饰经动态高压微射流(Dynamic high-pressure microfluidization,DHPM)诱导的去折叠态(unfolding)胰蛋白酶,研究经mPEG-SS修饰后其相对活性、热稳定性、动力学(米氏常数Km、最大反应速率Vmax)变化情况。结果表明:经mPEG-SS修饰后,天然态和去折叠态胰蛋白酶的相对活性都没有明显改变;修饰后去折叠胰蛋白酶(DTP)较天然胰蛋白酶(NTP)的耐热性有明显提高,当温度为55、45℃条件下保温180min,NTP和DTP的相对活性分别提高了2%、7%和19%、30%;经mPEG-SS修饰后天然胰蛋白酶和去折叠胰蛋白酶的Km分别为4.67、3.24mg/mL,Vmax分别为0.042、0.034U/min,均比未经修饰的要小。修饰后去折叠胰蛋白酶(DTP)的Km比天然胰蛋白酶(NTP)小,表明修饰后去折叠胰蛋白酶比修饰后天然胰蛋白酶具有更强的与底物(酪蛋白)的亲和能力。
胰蛋白酶,mPEG-SS,相对活性,热稳定性,动力学参数
胰蛋白酶是一种碱性蛋白水解酶,被广泛应用于医药、食品、轻工等方面,天然胰蛋白酶的热不稳定性导致在工业应用中表现活性下降甚至失活。采用酶改性手段来提高胰蛋白酶活性或改善其热稳定性成为近年来酶学领域的热点问题。酶改性手段主要有:a.化学修饰手段,如Pilpel等[1]采用二硫苏糖醇处理胰蛋白酶极大地提高了其活性,Zhang等[2]和Treetharnmathurot等[3]采用聚乙二醇修饰胰蛋白酶以改善其生物活性和热稳定性;b.固定化手段,如Liu等[4]采用固定化手段将胰蛋白酶固定于亚油酸修饰的壳聚糖载体上以改善其反应稳定性,Andrzej等[5]研究了阴离子交换树脂固定胰蛋白酶的催化活性; c.物理手段,如Vercet等[6]采用超声波和热处理相结合的方法研究胰蛋白酶的活性与稳定性影响,Dufour等[7]和Maynard等[8]报道了静高压(High hydrostatic pressure,HHP)诱导胰蛋白酶的活性变化。本课题组采用动态高压微射流(Dynamic high-pressure microfluidization,DHPM)诱导的去折叠态(unfolded)胰蛋白酶,其热稳定性和 pH稳定性有极大的提高[9]。由于胰蛋白酶的去折叠态是一种不稳定状态,出于其能量最低化的趋势牵引或者其本身最低分子势能作用下,通常会自发地进行再折叠,或自身聚集,或与其它分子发生反应而聚集,在一定的时间内要么可逆回到天然态,要么重新演化形变到一种新的平衡稳定态。为稳定胰蛋白酶的去折叠态,采用聚乙二醇修饰是共价化学修饰的经典方法。早在1965年Badran在Nature杂志上就介绍了PEG共价化学修饰表面氨基酸是改变蛋白质(酶)性质的一种有力的辅助手段[10];Bailon等[11]进一步报道了PEG可与蛋白质(酶)表面的氨基酸残基发生反应,从而增强蛋白质(酶)的生物活性或稳定性;Roberts等[12]总结了PEG能与各种氨基酸以及N端和C端的羧基发生反应。已有研究报道,Gaertner等[13]和Zhang等[14]报道了天然胰蛋白酶经PEG修饰后其活性和热稳定性的影响。本文以动态高压微射流诱导的去折叠态胰蛋白酶为对象,采用ω-琥珀酰酯酸琥珀酰亚胺酯活化的α-甲氧基-聚乙二醇(mPEG-SS)为分子补丁,修饰天然胰蛋白酶和DHPM诱导的去折叠态胰蛋白酶,测定mPEG-SS修饰前后其相对活性、热稳定性和动力学参数(Km、Vmax),并比较修饰后天然胰蛋白酶和去折叠态胰蛋白酶的酶学性质之间的差异,为进一步研究胰蛋白酶的酶学性质的调控技术提供理论依据。
1 材料与方法
1.1 材料与仪器
胰蛋白酶(产品编号0785-1G) 美国Amresco公司;mPEG-SS(5kDa KZ-MO5SS-101209) 北京凯正生物工程发展有限责任公司;酪蛋白(AR) 广州齐云生物技术有限公司;三氯乙酸(AR) 天津市大茂化学试剂厂;Tris(AR) 上海蓝季科技发展有限公司;盐酸等 均为分析纯,天津市大茂化学试剂厂。
PC-1600紫外光谱仪 上海美谱达公司; M-110EH30超高压微射流均质机 美国Microfluidics公司;Delta 320 pH计 上海梅特勒-托力多仪器有限公司;数显恒温水浴锅 上海贺德实验设备有限公司;TGL-16C离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 DHPM诱导天然胰蛋白酶溶液的去折叠 参照文献[9]的方法,配制浓度为1.0mg/mL的胰蛋白酶溶液,采用M-110EH30超高压微射流均质机在90MPa下处理3次,获得去折叠态胰蛋白酶溶液。
1.2.2 mPEG-SS修饰胰蛋白酶溶液 参照文献[15]的方法。mPEG-SS溶液以5∶1的摩尔比加入到1.0mg/mL的天然胰蛋白酶和去折叠胰蛋白酶溶液中。mPEG-SS胰蛋白酶混合溶液在室温条件下用磁力搅拌器搅拌1h,然后在4℃下用透析袋透析48h进行纯化,冻干;对照组用缓冲液代替mPEG-SS,其它条件与实验组相同。天然胰蛋白酶、去折叠胰蛋白酶、经mPEG-SS修饰后的天然和去折叠态胰蛋白酶样品组分别简写为NT、DT、NTP、DTP。
1.2.3 胰蛋白酶活性的测定 以酪蛋白为反应底物,参照文献[16]的方法测定胰蛋白酶的活性。以Tris-HCl缓冲液(pH 8.0)配制胰蛋白酶溶液(NT、DT、NTP、DTP),取1mL胰蛋白酶溶液(NT、DT、NTP、DTP)加入2mL Tris-HCl缓冲液(pH8.0)在37℃下预热 10min,再加入 5mL 37℃下预热好的酪蛋白(2mg/mL),混匀,反应30min,加入5mL 5%三氯乙酸终止反应,将上述溶液于10000r/min条件下离心10min,在277nm下测定其吸光度。
酶活力单位的定义:每分钟增加1.0吸光度定义为一个活力单位(U)。
相对酶活性的定义:

1.2.4 胰蛋白酶热稳定性的测定 以Tris-HCl缓冲液(pH 8.0)配制胰蛋白酶溶液(NT、DT、NTP、DTP),分别在25、35、45、55、65℃保温30min,迅速冷却至室温,然后根据1.2.3方法测定活性。
将配制好的胰蛋白酶溶液(NT、DT、NTP、DTP)在45℃保温180min,每隔30min取出适量的酶液,迅速冷却至室温,然后根据1.2.3方法测定活性。
1.2.5 胰蛋白酶动力学参数 Km、Vmax的测定 按1.2.3方法测定在不同浓度的酪蛋白溶液中胰蛋白酶的反应速率,然后采用Lineweaver-Burk作图法计算出胰蛋白酶动力学参数Km、Vmax。
1.2.6 数据分析及处理 每个实验均重复三次,取平均值。采用SAS软件进行显著性分析。
2 结果与分析
2.1 mPEG-SS修饰对胰蛋白酶相对活性的影响
天然胰蛋白酶经过90MPa DHPM处理后其相对活性为97%,这与本课题组前期报道相一致[9]。经mPEG-SS修饰后,天然胰蛋白酶和去折叠态胰蛋白酶其相对活性变化不大,分别为102%、96%。Zhang等[14]报道了经过分子量为350、750u的mPEG修饰后的胰蛋白酶催化底物Nα-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(BAPNA)的活性分别下降至原酶的80%、85%,而经过分子量为2000、5000u的mPEG修饰后,其相对活性分别升高至原酶的 140%、150%。Hubert等[17]采用分子量为 350、550、750、2000、5000、8000、10000u的PEG对胰蛋白酶进行了修饰,其催化底物BAPNA的相对活性分别为原酶的3.56、4.17、3.89、3.55、3.64、2.93、1.66倍,而其催化底物N-苯甲酰-L-精氨酸乙酯盐酸盐(BAEE)的相对活性却分别为原酶的 1.54、1.45、1.45、1.54、1.54、1.27、1.27倍,这说明不同底物对PEG修饰胰蛋白酶的活性影响很大。
2.2 mPEG-SS修饰对胰蛋白酶热稳定性的影响
不同温度下的胰蛋白酶的相对活性变化情况,如图1所示,当反应温度为25、35℃时,NT、NTP、DT、DTP相对活性比较接近。当反应温度为45℃时,NT、NTP相对活性急剧下降分别为65%、70%,而DT、DTP相对活性保持较高的稳定性,分别为100%、102%,参照Jongh等[18]和Stupishina等[19]的分析,这可能是因为DHPM处理使胰蛋白酶内部的氢键发生了变化,胰蛋白酶分子转化成较为稳定的水合状态;当反应温度升至55℃时,DTP相对活性比DT高出19%,而此时NTP相对活性比NT仅高出2%,表明经mPEG-SS修饰后去折叠胰蛋白酶具有较好的耐热稳定性,而天然胰蛋白酶经mPEG-SS修饰后其耐热稳定性并没有显著的提高;当温度继续升至65℃时,NT、NTP、DT、DTP都降低到45%以下,这主要是高温影响胰蛋白酶的弱键(主要是氢键),改变了胰蛋白酶的构象,从而使其活性下降;DT、DTP的相对活性比NT、NTP的活性分别低了30%、17%,这可能是因为DHPM去折叠胰蛋白酶处于亚稳定状态,当温度过高时去折叠胰蛋白酶的结构更容易被破坏,从而活性下降更多。
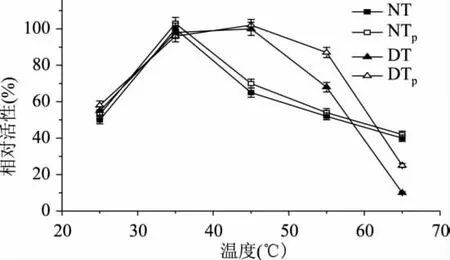
图1 不同温度对胰蛋白酶相对活性的影响
在45℃温度下不同保温时间胰蛋白酶的相对活性的变化情况,如图2所示,随着保温时间的延长,NT和DT相对活性都逐渐降低,但是DT的相对活性比NT高,当处理时间为180min时,DT的相对活性为64%,而NT仅为32%,表明DHPM处理能提高胰蛋白酶的热稳定性。NTP与NT的相对活性比较接近,表明mPEG-SS修饰并不能提高天然胰蛋白酶的热稳定性。随着保温时间的延长,DT相对活性下降的比较快,而DTP然仍保持在94%之上,表明mPEG-SS的修饰增强了去折叠态胰蛋白酶的稳定性。

图2 不同时间对胰蛋白酶相对活性的影响
2.3 mPEG-SS修饰对胰蛋白酶动力学参数的影响
以酪蛋白为反应底物测定了NT、NTP、DT、DTP反应速率随底物浓度的变化关系图(见图3)。采用Line weaver-Burk作图法,求出了NT、NTP、DT、DTP的 Km,Vmax值分别为 6.21、4.67、4.05、3.24mg/mL,0.053、0.042、0.040、0.034U/min。经过DHPM处理,DT的Km、Vmax值分别为NT的65.2%、75.5%,表明去折叠胰蛋白酶与酪蛋白亲和能力增强了。天然胰蛋白酶经过mPEG-SS修饰,其Km、Vmax值分别为NT的75.2%、79.2%,这表明mPEG-SS修饰也能提高胰蛋白酶与酪蛋白亲和能力。Hubert等[17]发现经过分子量350、550、750、5000、8000u的PEG修饰的胰蛋白酶的 Km分别为 0.68、0.62、0.46、0.41、0.42、0.49、0.37mmol/L,均比天然胰蛋白酶的 0.80都要低。DHPM去折叠处理胰蛋白酶经mPEG-SS修饰,其Km、Vmax值分别为 DT的 80.0%、85.0%,这表明mPEG-SS修饰也能提高去折叠胰蛋白酶与酪蛋白的亲和能力。但是DTP的Km值比NTP要低的多,这表明DTP与酪蛋白的亲和能力高于NTP。
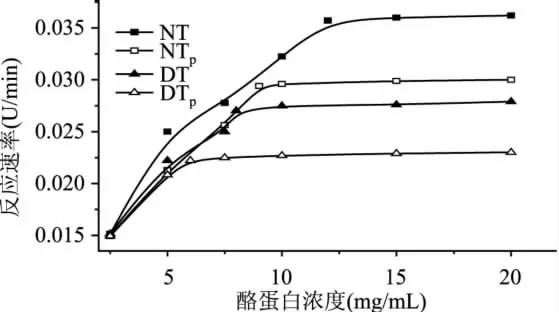
图3 底物浓度对胰蛋白酶相对活性的影响
3 结论
经mPEG-SS修饰对天然胰蛋白酶和动态高压微射流诱导去折叠态胰蛋白酶相对活性影响不大;虽然天然胰蛋白酶经mPEG-SS修饰后,其耐热性也没有明显的提高,但是DHPM去折叠态胰蛋白酶经mPEG-SS修饰后,其耐热性有显著的提高,在温度为55℃下的相对活性及在45℃下保温180min的相对活性均在87%之上。经mPEG-SS修饰后,天然胰蛋白酶和去折叠胰蛋白酶的 Km、Vmax都比未经mPEG-SS修饰的要小,但DTP的Km比NTP小,表明修饰后的DHPM诱导的去折叠态胰蛋白酶与反应底物(酪蛋白)的亲和能力高于修饰后的天然胰蛋白酶。
[1]PILPEL N,NEZER I,Applebaum S W,et al.Matingincreases trypsin in female Drosophila hemolymph[J].Insect Biochemistry and Molecular Biology,2008,38(3):320-330.
[2]ZHANG Ziding,HE Zhimin,HE Mingxia.Stabilization mechanism ofMPEG modified trypsin based on thermal inactivation kinetic analysis and molecular modeling computation[J].Journal of Molecular Catalysis B-Enzymatic,2001,14 (4-6):85-94.
[3]TREETHAMMATHUROTB,OVARTLARNPORNC,Wungsintaweekul J,et al.Effect of PEG molecular weight and linking chemistry on the biological activity and thermal stability of PEGylated trypsin[J].International Journal of Pharmaceutics,2008,357(1-2):252-259.
[4]LIU Chenguang,DESAI K G H,CHEN Xiguang,et al. Preparation and characterization ofnanoparticles containing trypsin based on hydrophobically modified chitosan[J].Journal of Agricultural and Food Chemistry,2005,53(5):1728-1733.
[5]JARZEBSKI A B,SZYMANSKA K,BRYJAK J,et al.Covalent immobilization of trypsin on to siliceous mesostructured cellular foams to obtain effective biocatalysts[J].Catalysis Today,2007,124(1-2):2-10.
[6]Vercet A,Burgos J,Crelier S,et al.Inactivation of proteases and lipases by ultrasound[J].Innovative Food Science and Emerging Technologies,2001,2(2):139-150.
[7]DUFOUR E,HERVE G,HAERTLE T.Hydrolysis of Beta-Lactoglobulin by Thermolysin and Pepsin under High Hydrostatic-Pressure[J].Biopolymers,1995,35(5):475-483.
[8]MAYNARD F,WEINGAND A,HAU J,et al.Effect of highpressure treatment on the tryptic hydrolysis of bovine betalactoglobulin AB[J].International Dairy Journal,1998,8(2): 125-133.
[9]LIU Wei,ZHANG Zhaoqin,LIU Chengmei,et al.The effect of dynamic high-pressure microfluidization on the activity,stability and conformation of trypsin[J].Food Chemistry,2010,123(3): 616-621.
[10]BADRAN A M,JONES D E.Polyethylene glycols-tannins interaction in extracting enzymes[J].Nature,1965,206:622-624.
[11]BAILON P,BERTHOLD W.Polyethylene glycol-conjugated pharmaceutical proteins[J].Pharmaceutical Science&Technology Today,1998,1(8):352-356.
[12]ROBERTS M J,BENTLEY M D,HARRIS J M.Chemistry for peptide and protein PEGylation[J].Advanced Drug Delivery Reviews,2002,54(4):459-476.
[13]GAERTNER H F,PUIGSERVER A J.Increased Activity and Stability of Poly(Ethylene Glycol)-Modified Trypsin[J].Enzyme and Microbial Technology,1992,14(2):150-155.
[14]ZHANG Ziding,HE Zhimin,GUAN Guoqiang.Thermal stability and thermodynamic analysis of native and methoxypolyethylene glycol modified trypsin[J].Biotechnology Techniques,1999,13(11):781-786.
[15]FERNANDEZ M,FRAGOSO A,CAO R,et al.Chemical conjugation of trypsin with monoamine derivatives of cyclodextrins-Catalytic and stability properties[J].Enzyme and Microbial Technology,2002,31(4):543-548.
[16]PURCENA L L A,CARAMORI S S,Mitidieri S,et al.The immobilization of trypsin onto polyaniline for protein digestion[J].MaterialsScience& EngineeringC-Biomimeticand Supramolecular Systems,2009,29(4):1077-1081.
[17]GAERTNER H F,PUIGSERVER A J.Increased Activity and Stability of Poly(Ethylene Glycol)-Modified Trypsin[J].Enzyme and Microbial Technology,1992,14(2):150-155.
[18]DEJONGH H H J,GOORMAGHTIGH E,RUYSSCHAERT J M.Monitoring structural stability of trypsin inhibitor atthe submolecular level by amide-proton exchange using Fourier transform infrared spectroscopy:A test case for more general application[J].Biochemistry,1997,36:13593-13602.
[19]STUPISHINA E A,KHAMIDULLIN R N,Vylegzhanina N N,et al.Ethylene glycol and the thermostability of trypsin in a reverse micelle system[J].Biochemistry-Moscow,2006,71(5): 533-537.
Effect of mPEG-SS modification on relative activity,thermal stability and kinetic parameters of DHPM unfolding trypsin
DHPM unfolding trypsin was modified by mPEG-SS.The relative activity,thermal stability and kinetic parameters(Km,Vmax)of trypsin were measured.Results showed that mPEG-SS modification did not change the relative activities of native and DHPM unfolding trypsin.mPEG-SS modification enhanced the thermal stability of unfolded trypsin more obviously than native trypsin.When incubated at 55℃or incubated at 45℃180min,the values of mPEG-SS modification enhancing the relative activity of native and unfolded trypsin were 2%,7%and 19%,30%respectively.The Kmand Vmaxof native and unfolded trypsin modified by mPEG-SS were 4.67,3.24mg/mL and 0.042,0.034U/min respectively,which were lower than native and unfolded trypsin.The Kmof unfolded trypsin modified by mPEG-SS was lower than native trypsin modified by mPEG-SS,which meant that the former would affine casein easier than later.
trypsin;mPEG-SS;relative activity;thermal stability;kinetic parameters
ZOU Li-qiang,LIU Wei*,LIU Jun-ping,LIU Cheng-mei
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
TS201.2
A
1002-0306(2011)12-0103-04
2011-08-31 *通讯联系人
邹立强(1987-),男,在读硕士研究生,研究方向:食物(含生物质)资源的开发与利用。
国家自然科学基金项目(31060209);国家重点实验室重点青年骨干研究基金(SKLF-QN-201101)。

